Высшую  и низшую
и низшую 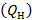 теплоту сгорания твердых и жидких нефтяных топлив, состоящих из углерода
теплоту сгорания твердых и жидких нефтяных топлив, состоящих из углерода  , водорода
, водорода  , серы
, серы  и кислорода
и кислорода  , молекулярная структура которых неизвестна, можно рассчитать по формуле Д.И. Менделеева:
, молекулярная структура которых неизвестна, можно рассчитать по формуле Д.И. Менделеева:

| (4.8) |

| (4.9) |
где  - содержание в топливе углерода, водорода, серы, кислорода и воды соответственно, масс. доля;
- содержание в топливе углерода, водорода, серы, кислорода и воды соответственно, масс. доля;
8 100, 30 000 и 2 600 - теплота сгорания  и
и 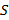 , ккал/кг;
, ккал/кг;
600 - среднее значение теплоты испарения /конденсации воды, ккал/кг.
Для газообразного топлива теплоту сгорания рассчитывают для 1 м3. Теплота сгорания газа сильно зависит от его параметров: температуры, давления, состава. Поэтому, чтобы рассчитать теплоту сгорания, необходимо задать параметры газа. Формула расчета теплоты сгорания 1 м3 природного газа при 273К и 1 атм:


| (4.10) |
где 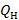 - низшая теплота сгорания газообразного топлива, ккал/м3;
- низшая теплота сгорания газообразного топлива, ккал/м3;
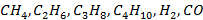 и
и 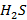 - содержание компонентов газообразного топлива, об. доли.
- содержание компонентов газообразного топлива, об. доли.
Числовые коэффициенты перед газообразными компонентами равны низшей теплоте их сгорания, ккал/м3.
Стехиометрический (по уравнению реакции) объем воздуха  , необходимого для количественного сжигания 1 кг сухого (безводного) топлива, в состав которого входят следующие элементы:
, необходимого для количественного сжигания 1 кг сухого (безводного) топлива, в состав которого входят следующие элементы:  и
и  , равен:
, равен:

| (4.11) |
где  и
и  - содержание в топливе указанных элементов соответственно, % масс.;
- содержание в топливе указанных элементов соответственно, % масс.;
0,089; 0,267 и 0,033 - объем в м3 воздуха состава: 21% об. 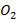 и 79% об.
и 79% об. 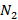 , необходимого для сжигания 10 г каждого из элементов
, необходимого для сжигания 10 г каждого из элементов  соответственно.
соответственно.
Стехиометрическое (по уравнению реакции) количество воздуха в кг  , необходимое для количественного сжигания 1 кг сухого (безводного) топлива, в состав которого входят следующие элементы:
, необходимое для количественного сжигания 1 кг сухого (безводного) топлива, в состав которого входят следующие элементы:  и
и  , равно:
, равно:

| (4.12) |
где  и
и  - содержание в топливе указанных элементов соответственно, % масс.;
- содержание в топливе указанных элементов соответственно, % масс.;
0,345; 0,114 и 0,043 - объем в м3 воздуха состава: 21% об. 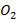 и 79% об.
и 79% об. 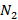 , необходимого для сжигания 10 г каждого из элементов
, необходимого для сжигания 10 г каждого из элементов  соответственно.
соответственно.
Для обеспечения полного сжигания любого вида углеводородного топлива фактическое количество воздуха больше стехиометрического.
Фактический расход воздуха 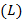 определяют в долях от стехиометрического и рассчитывают по уравнению:
определяют в долях от стехиометрического и рассчитывают по уравнению:

| (4.13) |
где 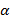 – коэффициент избытка воздуха.
– коэффициент избытка воздуха.
Значение 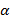 всегда больше 1. Величина коэффициента избытка воздуха зависит от вида топлива и типа используемых горелок. Так, для газомазутных горелок с паровым распылением мазута (т.е. распылением водяным паром)
всегда больше 1. Величина коэффициента избытка воздуха зависит от вида топлива и типа используемых горелок. Так, для газомазутных горелок с паровым распылением мазута (т.е. распылением водяным паром)  ; для тех же горелок, но с воздушным распылением мазута
; для тех же горелок, но с воздушным распылением мазута 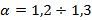 .
.
Количество дымовых газов, получающихся при сгорании 1 кг сухого углеводородного топлива с его воздушным распылением, равно:

| (4.14) |
ГЛАВА 5. ЭНЕРГЕТИЧЕСКИЙ И ТЕПЛОВОЙ БАЛАНСЫ
Закон А. Эйнштейна
В большинстве теплоэнергетических производств стоимость исходного топлива составляет значительную часть производственных издержек. Поэтому при оценке и практическом осуществлении того или иного энерготехнологического процесса необходимо добиться максимально эффективного использования сырья и энергии.
Поэтому важнейшим этапом при рассмотрении любого энерготехнологического процесса являются составления теплового и материального балансов процесса. В самом общем случае справедлив закон А. Эйнштейна, согласно которому полная энергия тела пропорциональна его массе:
 , ,
| (5.1) |
где  – энергия;
– энергия; 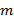 – масса;
– масса;  – скорость света в вакууме, равная ≈ 3·108 м/с.
– скорость света в вакууме, равная ≈ 3·108 м/с.
Прежде чем перейти к составлению теплового баланса попробуем оценить с помощью закона Эйнштейна энергию покоя (всю внутреннюю энергию), которой обладает любое топливо, в том числе и углеводородное, массой 1 г. Тогда получим:

| (5.2) |
Эффективность расхода энергии в энерготехнологическом процессе устанавливается с помощью энергетического баланса. Основой его служит закон Эйнштейна. Однако, когда в теплоэнергетической системе отсутствуют ядерные превращения, величина энергии в соотношении Эйнштейна с точностью по порядку величины 10-9 кДж/г постоянна.
Поэтому в дальнейшем составляют не энергетический, а тепловой баланс.
Дата: 2016-10-02, просмотров: 352.