Механизм реакции горения топлива
Горение - реакция высокотемпературного окисления топлива, сопровождающаяся выделением энергии (тепла, света). Как известно, химическое взаимодействие углеводородов с кислородом воздуха в промышленности осуществляют в двух режимах.
Если цель окисления углеводородов - получение кислородсодержащих продуктов высокой потребительской ценности (спирты, альдегиды, кетоны, кислоты), то процесс окисления ведут, как правило, при сравнительно низких температурах (не выше 250°С). При этой температуре реакция окисления протекает сравнительно медленно по механизму вырожденного разветвления (через первичное образование гидроперекисей), и для ее ускорения требуется присутствие гомогенных или гетерогенных катализаторов.
В отличие от этого, при использовании углеводородного сырья исключительно в качестве энергетического топлива с целью получения тепла и энергии процесс окисления ведут при температурах выше 1000°С. В этих условиях реакция протекает по обычному механизму цепных разветвленных реакций.
Механизм реакции горения углеводородов на примере реакции горения метана в кислороде (3.12):

Эта реакция относится к ценным реакциям.
Цепными реакциями называют такие, в которых превращение исходных веществ в продукты реакции протекает через регулярное чередование нескольких реакций с участием свободных радикалов.
Любая ценная реакция обязательно включает три основные стадии: зарождение цепи, продолжение цепи и обрыв цепи.
1. Зарождением (инициированием) цепи называют стадию цепной реакции, в которой из валентно насыщенных молекул образуются свободные радикалы.
2. Реакциями продолжения цепи называют стадии цепной реакции, в которых с сохранением свободной валентности расходуются исходные реагенты и образуются продукты реакции.
3. Обрывом цепи называют стадии цепного процесса, в которых происходит исчезновение свободной валентности.
Элементарная стадия цепной реакции, в которой превращение активных промежуточных частиц приводит к увеличению числа свободных радикалов и атомов называется разветвлением цепи.
Образование свободных радикалов в результате превращений стабильных продуктов реакции окисления называется вырожденным разветвлением цепи.
В общем виде схему реакции горения можно представить следующей схемой.
Стадия зарождения цепи:
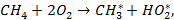
| (6.1) |
где 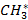 - метил;
- метил;
 - гидропериксидный радикал.
- гидропериксидный радикал.
Стадия продолжения цепи:
Ключевой стадией продолжения цепи является образование перекисного радикала  :
:

| (6.2) |

| (6.3) |
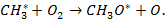
| (6.4) |
Гидропероксидный радикал может распадаться с образованием молекулы формальдегида 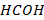 по реакции:
по реакции:

| (6.5) |
Вода образуется по реакции:

| (6.6) |
Вырожденное разветвление осуществляется при взаимодействии альдегида с 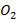 :
:
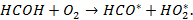
| (6.7) |
Продолжение цепи окисления происходит также по реакции:

| (6.8) |
Стадия обрыва цепи:
Наиболее часто обрыв цепи наблюдается в результате гибели радикала  на стенке и по так называемому механизму квадратичного обрыва в результате протекания реакции рекомбинации двух радикалов:
на стенке и по так называемому механизму квадратичного обрыва в результате протекания реакции рекомбинации двух радикалов:

| (6.9) |
Согласно этому механизму активными центрами реакции количественного горения метана в кислороде до 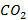 и
и 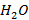 являются радикалы
являются радикалы  и
и  .
.
Состав продуктов горения
В условиях неполного сгорания углеводородные топлива частично окисляются до 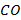 , а не до
, а не до 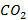 или разлагаются с образованием сажи (высокодисперсных частиц элементарного углерода). Топлива могут содержать и содержат в своем составе различные серосодержащие соединения, которые в условиях протекания реакции горения приводят к получению
или разлагаются с образованием сажи (высокодисперсных частиц элементарного углерода). Топлива могут содержать и содержат в своем составе различные серосодержащие соединения, которые в условиях протекания реакции горения приводят к получению 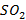 . Молекулярный кислород в качестве окислителя используют лишь для специальных целей. Сжигание ведут в воздухе, содержащем около 78% азота. Поэтому в условиях высоких температур горения топлива наблюдается образование оксидов азота.
. Молекулярный кислород в качестве окислителя используют лишь для специальных целей. Сжигание ведут в воздухе, содержащем около 78% азота. Поэтому в условиях высоких температур горения топлива наблюдается образование оксидов азота.
Результаты сжигания в факеле нефтезаводского газа, в основном состоящего из метана и имеющего теплоту сгорания около 4·104 кДж/м3 в газо-мазутной горелке. Показано распределение концентраций исходного газообразного топлива ( 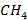 и
и 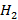 ), кислорода воздуха, продуктов горения метана
), кислорода воздуха, продуктов горения метана  , образующихся оксидов азота
, образующихся оксидов азота 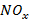 и температуры по длине факела.
и температуры по длине факела.
Длина факела приведена по оси абсцисс в условных единицах, как отношение длины факела к его диаметру, численно равному диаметру насадки (см. рис. 6.1).
Из рис. 6.1 видно, что факел имеет максимальную температуру в начале 2-ой четверти его длины. Следует отметить, что положение температурного максимума факела зависит от многих факторов, и определяется, прежде всего, конструкцией горелки, подачей воздуха и видом топлива.
В согласии с представлениями о кинетике реакции идет монотонное снижение концентрации компонентов исходного топлива  и окислителя
и окислителя 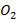 . Концентрация промежуточного продукта неполного окисления метана -
. Концентрация промежуточного продукта неполного окисления метана - 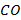 – проходит через максимум. Концентрация конечного продукта -
– проходит через максимум. Концентрация конечного продукта - 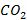 (другой конечный продукт – вода – на графике не показан) нарастает, достигая максимума в конце факела.
(другой конечный продукт – вода – на графике не показан) нарастает, достигая максимума в конце факела.

Рис. 6.1. Распределение температуры, концентраций исходного топлива и продуктов его сгорания по длине факела
Огонь, пламя всегда занимали, занимают и будут занимать значительное место в материальной и духовной жизни человека. Именно добывание и широкое использование огня способствовало быстрой эволюции человека.
Дата: 2016-10-02, просмотров: 303.