Э.Л. Топалов Ю.А. Булыгин
Е.Н. Нестеров А.С. Панышев
ЭНЕРГОСБЕРЕЖЕНИЕ
ПРИ ТРАНСПОРТЕ НЕФТИ И ГАЗА
Учебное пособие

Воронеж 2015
ФГБОУ ВО «Воронежский государственный технический университет»
Э.Л. Топалов Ю.А. Булыгин
Е.Н. Нестеров А.С. Панышев
ЭНЕРГОСБЕРЕЖЕНИЕ ПРИ ТРАНСПОРТЕ НЕФТИ И ГАЗА
Утверждено Редакционно-издательским советом
университета в качестве учебного пособия
Воронеж 2015
УДК 662.6
Энергосбережение при транспорте нефти и газа: учеб. пособие / Э.Л. Топалов, Ю.А. Булыгин, Е.Н. Нестеров, А.С. Панышев. Воронеж: ФГБОУ ВО «Воронежский государственный технический университет», 2015. 215 с.
Учебное пособие включает в себя задания для расчета энергоэффективности газонефтепроводов, а также рассмотрена проблема энергосбережения в нефтегазовой промышленности. Изложены основы энергосберегающей политики РФ, приведены основные понятия и законы энергосбережения, энергетический и тепловой балансы, диаграммы Сенке, механизм горения топлива, рассмотрены вопросы техники сжигания топлива, современные энерготехнологии в нефте- и газохимии, нефте- и газопереработке, трубопроводном транспорте газа. Приведены примеры ресурсо-энергосбережения по технологическим блокам работы вертикально интегрированных нефтегазовых компаний.
Издание соответствует требованиям Федерального государственного образовательного стандарта высшего образования по направлению 21.03.01 «Нефтегазовое дело» (профиль «Эксплуатация и обслуживание объектов транспорта и хранения нефти, газа и продуктов переработки»), дисциплине «Ресурсо- и энергосберегающие технологии».
Табл. 24. Ил. 37. Библиогр.: 13 назв.
Рецензенты: кафедра гидрогеологии, инженерной
геологии и геоэкологии Воронежского
государственного университета
(канд. техн. наук, доц. Ю.М. Зинюков);
д-р техн. наук, проф. Н.В. Мозговой
© Топалов Э.Л., Булыгин Ю.А.,
Нестеров Е.Н., Панышев А.С., 2015
© Оформление ФГБОУ ВО
«Воронежский государственный
технический университет», 2015
ВВЕДЕНИЕ
Одной из основных задач, стоящих перед мировым сообществом, является формирование устойчивой общественно приемлемой энергетики с высокой экологической и экономической эффективностью.
Мир с начала 70-х годов прошлого столетия живет в обстановке периодически возникающих энергетических кризисов. Поэтому в центре внимания промышленно развитых стран находятся и будут находиться проблемы обеспечения национальной энергетической безопасности, связанные с надежным энергообеспечением.
По прогнозным оценкам спрос на первичную энергию в мире будет увеличиваться на 1-2% в год в течение трех последующих десятилетий.
От энергопотребляющих компаний, в частности от вертикально интегрированных нефтегазовых компаний, в рамках повышения эффективности их работы требуется экономить энергию и углеводородное сырье на всех технологических этапах «от скважины до бензоколонки».
Энергосберегающие технологии углеводородного сырья - это дисциплина, изучающая комплексное и рациональное использование углеводородного сырья и запасенной в нем энергии.
Усилия ученых, инженеров, конструкторов, технологов, работающих в областях топливно-энергетического комплекса (ТЭК) всегда направлены на создание энергосберегающих технологий и оборудования. В результате проделанной за последние годы работы накоплен значительный практический опыт в деле разработки и применения энерго-экологоэффективных техники и технологий.
В вузах появились специальные программы и дисциплины, которые с разной степенью глубины и детализации освещают теорию и практику комплексного, эффективного и природозащитного использования топлива, энергии и углеводородного сырья. Эти дисциплины стали базовыми для подготовки и переподготовки квалифицированных кадров для отраслей ТЭК.
В методическом пособии приведены характеристика топливно-энергетического комплекса РФ, законодательство РФ в области энергосбережения, энергетический паспорт предприятия, положения программы Международной топливно-энергетической ассоциации по устойчивому развитию энергетики.
Рассмотрены теоретические вопросы, такие как термодинамические расчеты в энергосбережении, определение теплоты сгорания углеводородов в кислороде и воздухе, энергетический и тепловой балансы, диаграммы Сенке, механизм реакции горения топлива.
Нашли отражение экологические проблемы ТЭК, в том числе, государственные квоты на выбросы загрязняющих веществ.
Представлена характеристика оборудования для сжигания топлива и основные виды теплоутилизационных аппаратов.
Проанализированы конкретные решения энергосбережения в нефте- и газохимии, нефте- и газопереработке, в трубопроводном транспорте газа.
Методическое пособие написано в соответствии с программой курса «Энергосберегающие технологии углеводородного сырья» для студентов факультета бакалаврской подготовки.
И В МИРЕ
На теплоэлектростанции
Принципиальная схема работы теплоэлектростанции представлена на рис. 1.4. При сжигании природного газа в паровом котле (1) вырабатывается водяной пар с высокой температурой и давлением. Пар вращает паровую турбину (2), на валу которой установлен электрогенератор. (3), вырабатывающий электроэнергию. Тепло отработанного пара утилизируется в конденсаторе-холодильнике (4), а сконденсированная вода вновь поступает в паровой котел. Продукты сгорания природного газа (дымовые газы) после очистки от токсичных загрязняющих веществ ( 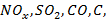 несгоревшее топливо) выбрасываются через дымовую трубу (5) в атмосферу.
несгоревшее топливо) выбрасываются через дымовую трубу (5) в атмосферу.
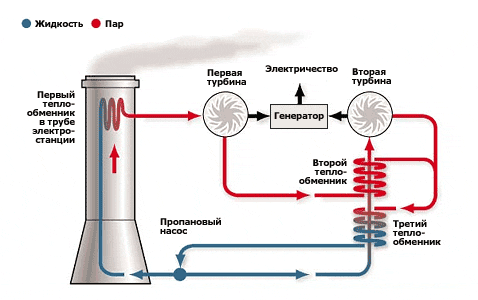
Рис. 1.4. Принципиальная схема работы ТЭС
Таким образом, для преодоления мировых энергетических кризисов необходимо создавать и использовать новые энергоэффективные и энергосберегающие технологии в энергетике и производстве, на транспорте и в повседневной жизни.
Энергоаудит
Энергетический аудит (энергоаудит) - это техническое инспектирование энергогенерирования и энергопотребления предприятия с целью определения возможностей экономии энергии и оказания помощи предприятию в осуществлении мероприятий, обеспечивающих экономию энергоресурсов на практике.
Согласно Минэнерго РФ энергоаудитор - юридическое лицо (организация, кроме надзорных органов), осуществляющее энергетическое обследование потребителей ТЭР и имеющее лицензию на производство этих работ.
В ходе проведения энергоаудита получают объективные оценки об энергетических событиях на предприятии, устанавливают уровень их соответствия показателям энергетической эффективности в соответствии с ГОСТ Р 51541-99 «Энергетическая эффективность. Состав показателей». Результаты энергоаудита в виде рекомендаций энергоаудитор представляет в Минэнерго РФ или иным заинтересованным организациям.
ГЛАВА 2. ОСНОВНЫЕ ПОНЯТИЯ И ЗАКОНЫ ЭНЕРГОСБЕРЕЖЕНИЯ
Водород
Водород входит в состав разнообразных газов нефтегазопереработки и нефтегазохимии, угле- и коксохимии. Так, водород содержат газы процесса риформинга бензиновых фракций нефти, паровоздушной конверсии метана, коксовый и водяной газы. Кроме того, водород содержат все виды углеводородного топлива.
Поэтому вполне логичным представляется начать рассмотрение процессов горения с наиболее простого представителя горючих газов - молекулярного водорода ( 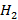 ).
).
Стехиометрическое уравнение реакции горения (глубокого окисления) молекулярного водорода имеет вид:

| (3.1) |
Реакция экзотермическая, ее протекание сопровождается выделением тепла АН. Найдем энтальпию реакции (3.1) по уравнению (2.2), для чего воспользуемся справочными данными, представленными в табл. 3.1.
Из табл. 3.1 видно, что стандартная энтальпия образования простых веществ (  и др.) в термохимических расчетах принимается равной 0 ккал/моль. Энтальпия реакции сжигании 1 моля
и др.) в термохимических расчетах принимается равной 0 ккал/моль. Энтальпия реакции сжигании 1 моля 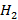 (≈ 22,4 л), например, при 400К составляет около 58 ккал или примерно 243 кДж. На основе данных табл.3.1 легко оценить, что при сжигании 1 м3 и 1 кг
(≈ 22,4 л), например, при 400К составляет около 58 ккал или примерно 243 кДж. На основе данных табл.3.1 легко оценить, что при сжигании 1 м3 и 1 кг 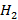 выделяется около 2 590 и 29 020 ккал или 10 840 и 121 420 кДж соответственно.
выделяется около 2 590 и 29 020 ккал или 10 840 и 121 420 кДж соответственно.
Высшая и низшая теплота сгорания топлива
В теплотехнике при сжигании водородсодержащего топлива (например, углеводородов), когда одним из продуктов реакции является вода, различают высшую и низшую теплоты сгорания топлива.
Таблица 3.1 Стандартные состояния исходных реагентов и продуктов реакции 
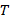 , К , К
| Экспериментальные данные | Реакция 3.1 | |||||
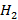
| 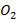
| 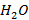
| |||||
 , кал/моль·град , кал/моль·град
|  , ккал/моль , ккал/моль
|  , кал/моль·град , кал/моль·град
|  , ккал/моль , ккал/моль
|  , кал/моль·град , кал/моль·град
|  , ккал/моль , ккал/моль
| 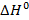 , ккал/моль , ккал/моль
| |
| 6,892 | 0,000 | 7,017 | 0,000 | 8,03 | -57,80 | -57,80 | |
| 6,974 | 0,000 | 7,194 | 0,000 | 8,19 | -58,04 | -58,04 | |
| 7,008 | 0,000 | 7,670 | 0,000 | 8,68 | -58,50 | -58,50 | |
| 7,078 | 0,000 | 8,064 | 0,000 | 9,25 | -58,91 | -58,91 | |
| 7,217 | 0,000 | 8,335 | 0,000 | 9,85 | -59,24 | -59,24 |
Под низшей теплотой сгорания 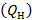 , применительно к реакции (3.1) понимают теплоту реакции горения водорода
, применительно к реакции (3.1) понимают теплоту реакции горения водорода 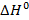 , когда продукт реакции
, когда продукт реакции 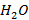 находится в виде водяного пара.
находится в виде водяного пара.
Под высшей теплотой сгорания  применительно к реакции (3.1), понимают теплоту реакции горения водорода
применительно к реакции (3.1), понимают теплоту реакции горения водорода 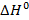 , когда образующийся продукт реакции - водяной пар находится в виде сконденсировавшейся воды. Высшая теплота сгорания по значению больше низшей теплоты сгорания на теплоту фазового перехода воды в водяной пар
, когда образующийся продукт реакции - водяной пар находится в виде сконденсировавшейся воды. Высшая теплота сгорания по значению больше низшей теплоты сгорания на теплоту фазового перехода воды в водяной пар  , т.е. на теплоту испарения воды (или конденсации водяного пара)
, т.е. на теплоту испарения воды (или конденсации водяного пара)

| (3.2) |
Уравнение Кирхгофа для процесса испарения воды (вода => пар) в дифференциальном виде можно записать так:

| (3.3) |
Это уравнение не вполне строго, поскольку записано для 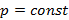 , и не учитывает изменение давления водяного пара в зависимости от температуры.
, и не учитывает изменение давления водяного пара в зависимости от температуры.
Однако, если давление не слишком велико, то теплоемкость пара можно считать не зависящей от давления. Дополнительно примем, что теплоемкости пара и воды в узком интервале температур (например, 298-400 К) от него не зависят и равны соответственно  ;
;  .
.
Тогда по уравнению (3.3):

| (3.4) |
При температуре 298 К теплота испарения воды равна  . Легко показать, что при 400К теплота испарения равна:
. Легко показать, что при 400К теплота испарения равна:


| (3.5) |
При 400 К получим:

| (3.6) |
С учетом данных табл. 3.1 видно, что при 400К  .
.
Таким образом, отношение высшей теплоты реакции к низшей для реакции горения водорода в кислороде при 400К равно:

| (3.7) |
т.е. высшая теплота реакции больше низшей теплоты реакции примерно на 16%. Поскольку теплота испарения (конденсации) воды и теплоемкость водяного пара зависят от температуры, то, очевидно, при другой температуре это соотношение будет другим. Например, при температуре 298К 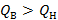 на 18%.
на 18%.
Следует отметить, что в теплотехнических расчетах обычно пользуются низшей теплотой сгорания.
Жаропроизводительностъ
Оценим максимальную температуру  адиабатического разогрева продукта сгорания (водяного пара), образующегося при сжигании водорода в кислороде или жаропроизводительность.
адиабатического разогрева продукта сгорания (водяного пара), образующегося при сжигании водорода в кислороде или жаропроизводительность.
Для адиабатических условий протекания экзотермической стехиометрической реакции окисления водорода можно записать следующее соотношение (3.8):

| (3.8) |
где  – число молей газовой смеси;
– число молей газовой смеси;
 – теплоемкость газовой смеси;
– теплоемкость газовой смеси;
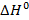 – теплота.
– теплота.
Возникает вопрос, какие значения подставить в числитель и знаменатель уравнения (3.8). Дело в том, что энтальпия реакции окисления молекулярного водорода кислородом и теплоемкость единственного продукта реакции - водяного пара зависят от температуры. Поэтому, наиболее надежные данные по жаропроизводительности (температуре адиабатического разогрева) можно получить лишь экспериментально, проведя реакцию в калориметрической бомбе с фиксированием температуры адиабатического разогрева реакционной смеси оптическим пирометром или термопарой.
Возможна оценка жаропроизводительности, если принять, что средняя температура сжигания определенного количества водорода в кислороде в соответствии со стехиометрическим уравнением реакции составляет около 1000К. Это значение можно объяснить тем, что температура горения 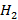 в
в 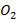 ; в процессе горения изменяется от некоторой начальной температуры, когда степень превращения
; в процессе горения изменяется от некоторой начальной температуры, когда степень превращения 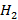 близка к 0, например, до некой конечной температуры в конце процесса горения, когда степень превращения водорода становится близка к 100%, а температура продуктов реакции приближается к
близка к 0, например, до некой конечной температуры в конце процесса горения, когда степень превращения водорода становится близка к 100%, а температура продуктов реакции приближается к  .
.
Из табл. 3.1 выбирают значения энтальпии реакции и теплоемкостей исходных реагентов и продукта реакции при температуре 1000К. Учитывая близость значений  для
для 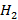 ,
, 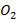 и
и 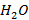 примам среднюю теплоемкость газовой смеси в процессе горения равной теплоемкости водяного пара.
примам среднюю теплоемкость газовой смеси в процессе горения равной теплоемкости водяного пара.
Для одного моля газовой смеси получим:

| (3.9) |
Из приведенной оценки видно, молекулярного водорода, как газообразного топлива, при сжигании его в чистом кислороде, в пламени водород-кислородной горелки, температура теоретически может достигать 6000 К.
Оксид углерода
Оксид углерода  - горючий газ, который получается в следующих процессах:
- горючий газ, который получается в следующих процессах:
1. Каталитическая конверсия природного метана водяным паром:
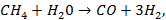
в результате чего образуется синтез-газ (смесь 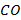 и
и 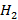 ) - сырье для промышленного синтеза метанола
) - сырье для промышленного синтеза метанола 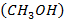 и аммиака
и аммиака 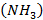 .
.
2. Газификация угля и кокса:
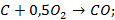


В результате этих реакций получается 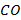 или смесь его с
или смесь его с 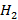 . Реакции газификации сопутствуют таким технологическим процессам, как выплавка чугуна и стали (реакция (a и (b) - доменный, конверторный и коксовый газы), генераторный газ - реакция (c).
. Реакции газификации сопутствуют таким технологическим процессам, как выплавка чугуна и стали (реакция (a и (b) - доменный, конверторный и коксовый газы), генераторный газ - реакция (c).
Стехиометрическое уравнение реакции горения (глубокого окисления) оксида углерода имеет вид:

| (3.10) |
Реакция экзотермическая, ее протекание сопровождается выделением тепла 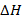 . Найдем энтальпию реакции (3.10) по уравнению (2.2), для чего воспользуемся справочными данными, представленными в табл. 3.2.
. Найдем энтальпию реакции (3.10) по уравнению (2.2), для чего воспользуемся справочными данными, представленными в табл. 3.2.
Из нее видно, что энтальпия экзотермической реакции горения 1 моля 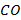 (≈ 22,4 л) п кислороде, например, при 298К составляет около 68 ккал или примерно 283 кДж. На основе данных табл. 3.2 легко можно оценить, что при сжигании 1 м3 и 1 кг
(≈ 22,4 л) п кислороде, например, при 298К составляет около 68 ккал или примерно 283 кДж. На основе данных табл. 3.2 легко можно оценить, что при сжигании 1 м3 и 1 кг 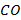 выделяется около 3020 и 2415 ккал или 12640 и 10100 кДж соответственно.
выделяется около 3020 и 2415 ккал или 12640 и 10100 кДж соответственно.
Для реакции сжигания 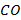 в кислороде с позиции теплотехники характерно наличие только одной теплоты сгорания топлива, поскольку топливо не содержит водород, следовательно, в продуктах реакции отсутствует водяной пар.
в кислороде с позиции теплотехники характерно наличие только одной теплоты сгорания топлива, поскольку топливо не содержит водород, следовательно, в продуктах реакции отсутствует водяной пар.
Оценим жаропроизводительность оксида углерода при горении его в кислороде в расчете на 1 моль газовой смеси. Для этого воспользуемся данными табл. 3.2 при 1000К для энтальпии реакции, а среднюю теплоемкость примем равной теплоемкости 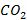 .
.
После подстановки соответствующих значений в уравнение получим:

| (3.11) |
Таблица 3.2 Стандартные состояния исходных реагентов и продуктов реакции 
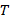 , К , К
| Экспериментальные данные | Реакция | |||||
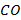
| 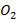
| 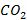
| |||||
 , кал/моль·град , кал/моль·град
|  , ккал/моль , ккал/моль
|  , кал/моль·град , кал/моль·град
|  , ккал/моль , ккал/моль
|  , кал/моль·град , кал/моль·град
|  , ккал/моль , ккал/моль
| 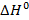 , ккал/моль , ккал/моль
| |
| 6,97 | -26,42 | 7,017 | 0,000 | 8,87 | -94,05 | -67,63 | |
| 7,01 | -26,32 | 7,194 | 0,000 | 9,87 | -94,07 | -67,75 | |
| 7,28 | -26,33 | 7,670 | 0,000 | 11,31 | -94,12 | -67,79 | |
| 7,62 | -26,52 | 8,064 | 0,000 | 12,29 | -94,22 | -67,70 | |
| 7,93 | -26,77 | 8,335 | 0,000 | 12,97 | -94,32 | -67,55 |
Из приведенной оценки видно, что жаропроизводительность оксида углерода, как газообразного топлива, при сжигании его в чистом кислороде теоретически может достигать 5200 К.
При температуре горения, превышающей 1700°С, всегда приходится считаться с протеканием реакций диссоциации продуктов горения. Речь прежде всего идет о реакции распада молекул 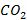 и
и 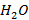 на
на 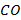 и
и 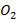 или
или 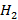 и
и 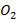 соответственно. Реакции диссоциации молекул эндотермические, поэтому практически достижимая жаропроизводительность существенно ниже ее теоретической величины.
соответственно. Реакции диссоциации молекул эндотермические, поэтому практически достижимая жаропроизводительность существенно ниже ее теоретической величины.
Для парциального давления 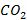 в продуктах сгорания около 0,2 атм степень диссоциации (%) составит (табл. 3.3).
в продуктах сгорания около 0,2 атм степень диссоциации (%) составит (табл. 3.3).
Таблица 3.3 Зависимость степени диссоциации 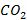 от температуры (парциальное давление
от температуры (парциальное давление 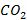 0,02 МПа)
0,02 МПа)
Температура, 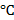
| Степень диссоциации, % |
| 3,7 | |
| 6,0 | |
Парциальное давление 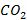 в продуктах сгорании также влияет на степень диссоциации углекислоты (табл. 3.4). Водяной пар при тех же температурах и давлениях диссоциирует в значительно меньшей степени, чем молекулы
в продуктах сгорании также влияет на степень диссоциации углекислоты (табл. 3.4). Водяной пар при тех же температурах и давлениях диссоциирует в значительно меньшей степени, чем молекулы 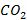 (табл. 3.5).
(табл. 3.5).
Таблица 3.4 Зависимость степени диссоциации 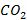 от его парциального давления (температура 2000°С)
от его парциального давления (температура 2000°С)
Парциальное давление 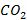 , МПа , МПа
| Степень диссоциации, % |
| 0,1 | 6,0 |
| 0,02 | 10,0 |
| 0,01 | 12,5 |
Таблица 3.5 Зависимость степени диссоциации 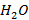 от его парциального давления (температура 2000°С)
от его парциального давления (температура 2000°С)
Парциальное давление 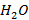 , МПа , МПа
| Степень диссоциации, % |
| 0,1 | 2,0 |
| 0,02 | 3,5 |
| 0,01 | 4,0 |
Из данных табл. 3.4 и 3.5 видно, что при 2000°С степень диссоциации 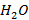 почти в 3 раза меньше, чем
почти в 3 раза меньше, чем 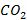 .
.
Метан
Стехиометрическое уравнение реакции горения метана 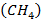 – основного компонента природного газа - имеет вид:
– основного компонента природного газа - имеет вид:

| (3.12) |
Реакция экзотермическая, ее протекание сопровождается выделением тепла 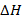 . Энтальпию реакции (3.12) определяют по уравнению (2.2). Для чего используют справочные данные, представленные в табл. 3.6, из которой видно, что при 1000К в реакции горения 1 моля
. Энтальпию реакции (3.12) определяют по уравнению (2.2). Для чего используют справочные данные, представленные в табл. 3.6, из которой видно, что при 1000К в реакции горения 1 моля 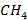 (≈ 22,4 л) выделяется около 192 ккал (≈ 803 кДж). На основе данных табл. 3.6 легко оценить, что при сжигании 1 м3 и 1 кг
(≈ 22,4 л) выделяется около 192 ккал (≈ 803 кДж). На основе данных табл. 3.6 легко оценить, что при сжигании 1 м3 и 1 кг 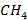 выделяется около 8570 и 12000 ккал или 35900 и 50200 кДж соответственно.
выделяется около 8570 и 12000 ккал или 35900 и 50200 кДж соответственно.
Таблица 3.6 Стандартные состояния исходных реагентов и продуктов реакции 
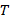 , К , К
| Экспериментальные данные | Реакция | |||||
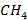
| 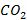
| 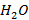
| |||||
 , кал/моль·град , кал/моль·град
|  , ккал/моль , ккал/моль
|  , кал/моль·град , кал/моль·град
|  , ккал/моль , ккал/моль
|  , кал/моль·град , кал/моль·град
|  , ккал/моль , ккал/моль
| 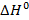 , ккал/моль , ккал/моль
| |
| 8,54 | -17,89 | 8,87 | -94,05 | 8,03 | -57,80 | -191,76 | |
| 9,71 | -18,63 | 9,87 | -94,07 | 8,19 | -58,04 | -191,52 | |
| 12,55 | -19,90 | 11,31 | -94,12 | 8,68 | -58,50 | -191,22 | |
| 15,18 | -20,82 | 12,29 | -94,22 | 9,25 | -58,91 | -191,22 | |
| 17,40 | -21,40 | 12,97 | -94,32 | 9,85 | -59,24 | -191,40 |
При оценке высшей и низшей теплоты сгорания метана в кислороде для температуры 298К, при которой теплота испарения воды  . Из стехиометрического уравнения реакции горения метана в кислороде видно, что мольная доля водяных паров в продуктах горения составляет примерно 0,67. Поэтому приближение для 298К можно записать:
. Из стехиометрического уравнения реакции горения метана в кислороде видно, что мольная доля водяных паров в продуктах горения составляет примерно 0,67. Поэтому приближение для 298К можно записать:

| (3.13) |
С учетом данных табл. 3.1 и 3.2  .
.
Соотношение высшей и низшей теплоты сгорания для реакции горения метана в кислороде при 298К равно:

| (3.14) |
т.е. высшая теплота реакции больше низшей теплоты реакции примерно на 4%.
По аналогии с вышеизложенным проводят приближенный расчет и сгорания 1 моля 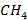 в кислороде, для чего используют уравнение (3.12).
в кислороде, для чего используют уравнение (3.12).
Из табл. 3.6 берут значения энтальпии реакции и теплоемкостей исходных реагентов и продукта реакции при температуре 1000К. В процессе горения средняя теплоемкость исходной стехиометрической смеси 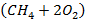 меняется до средней теплоемкости образующихся продуктов реакции
меняется до средней теплоемкости образующихся продуктов реакции 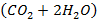 . При температуре 1000К средняя мольная теплоемкость исходной смеси
. При температуре 1000К средняя мольная теплоемкость исходной смеси  и продуктов реакции
и продуктов реакции  равна:
равна:

| (3.15) |

| (3.16) |
Учитывая близость значений  и
и  принимают среднюю теплоемкость газовой смеси в процессе горения
принимают среднюю теплоемкость газовой смеси в процессе горения 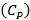 равной 11,1 кал/моль·град:
равной 11,1 кал/моль·град:

| (3.17) |
Из расчета видно, что жаропроизводительность метана, как газообразного топлива, при сжигании его в чистом кислороде теоретически составит примерно 5750К.
Расчетные максимальные температуры, достигаемые при количественном сгорании 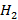 ,
, 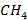 и
и 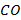 в кислороде, равны 6000, 5750 и 5200К соответственно и образуют следующий ряд:
в кислороде, равны 6000, 5750 и 5200К соответственно и образуют следующий ряд:

| (3.18) |
Этот ряд является свидетельством того, что жаропроизводительность газообразного топлива тем выше, чем больше водорода в нем содержится. Действительно чистый водород содержит 100%  , метан - 25%
, метан - 25%  ,
, 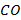 - 0%
- 0%  .
.
Становится понятным почему, когда говорят об энергетике будущего, то прежде всего имеют в виду водородную энергетику, как наиболее эффективную и экологически чистую, поскольку теоретически единственным продуктом горения 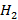 является вода.
является вода.
Водород
Стехиометрическое горение водорода в воздухе можно записать в следующем виде:

| (4.1) |
Разделив левую и правую часть уравнения (4.1) на 42, получают:

| (4.2) |
Из уравнения (4.2) видно, что для сжигания 1 м3 водорода по стехиометрии требуется 2,38 (0,5+1,88) м3 воздуха. По уравнению из 1 м3 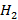 при количественном сгорании образуется 1 м3 водяного пара, то есть объем продуктов сгорания
при количественном сгорании образуется 1 м3 водяного пара, то есть объем продуктов сгорания 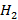 в воздухе суммарно составляет примерно 2,88 (1+1,88) м3.
в воздухе суммарно составляет примерно 2,88 (1+1,88) м3.
Энтальпия реакции горения 1 м3 водорода равна 2590 ккал/м3. В расчете 1 м3 образующихся продуктов сгорания энтальпия составит 2590/2,88 ≈ 900 ккал/м3.
Жаропроизводительность сжигания 1 м3 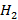 в воздухе:
в воздухе:

| (4.3) |
где 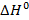 – стандартная энтальпия реакция горения
– стандартная энтальпия реакция горения 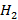 в
в 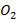 при температуре 1000К, ккал/м3 (табл. 3.1);
при температуре 1000К, ккал/м3 (табл. 3.1);
 – стехиометрический объем продуктов сгорания
– стехиометрический объем продуктов сгорания 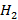 в воздухе, м3;
в воздухе, м3;
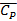 – средняя теплоемкость продуктов сгорания, ккал/м3·град.
– средняя теплоемкость продуктов сгорания, ккал/м3·град.
Из табл. 3.1 выбирают значения энтальпии реакции и теплоемкостей исходных реагентов и продукта реакции при температуре 1000К. учитывая близость значений  для
для  , принимают среднюю теплоемкость газовой смеси в процессе горения равной теплоемкости водяного пара при 1000К, т.е.
, принимают среднюю теплоемкость газовой смеси в процессе горения равной теплоемкости водяного пара при 1000К, т.е.  или
или  .
.
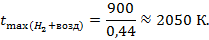
| (4.4) |
За счет увеличения объема продуктов сгорания водорода в воздухе до 2,88 м3 по сравнению с объемом продуктов сгорания 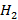 в чистом кислороде (1,0 м3), жаропроизводительность снизилась ждоке почти в три раза с 6000 до 2050К.
в чистом кислороде (1,0 м3), жаропроизводительность снизилась ждоке почти в три раза с 6000 до 2050К.
Метан
Стехиометрическое горение метана в воздухе можно записать следующим образом:

| (4.5) |
Т.е. для сжигания 1 м3 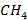 необходимо 9,52 м3 воздуха. При количественном протекании реакции образуется 10,52 м3 продуктов сгорания. Энтальпия реакции горения 1 м3 метана равняется 8750 ккал/м3 или 36580 кДж/м3. В расчете на 1 м3 образующихся продуктов сгорания энтальпия составит 8750/10,5 ≈ 830 ккал/м3.
необходимо 9,52 м3 воздуха. При количественном протекании реакции образуется 10,52 м3 продуктов сгорания. Энтальпия реакции горения 1 м3 метана равняется 8750 ккал/м3 или 36580 кДж/м3. В расчете на 1 м3 образующихся продуктов сгорания энтальпия составит 8750/10,5 ≈ 830 ккал/м3.
Оценим жаропроизводительность сжигания 1 м3 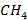 в воздухе.
в воздухе.
Для этого воспользуемся уравнением вида:
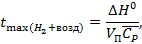
| (4.6) |
где 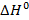 – стандартная энтальпия реакция горения
– стандартная энтальпия реакция горения 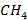 в
в 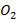 при температуре 298К, ккал/м3 (табл. 3.6);
при температуре 298К, ккал/м3 (табл. 3.6);
 – стехиометрический объем продуктов сгорания
– стехиометрический объем продуктов сгорания 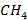 в воздухе, м3;
в воздухе, м3;
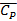 – средняя теплоемкость продуктов сгорания, ккал/м3·град.
– средняя теплоемкость продуктов сгорания, ккал/м3·град.
Из табл. 3.6 выберем значения энтальпии реакции и теплоемкостей исходных реагентов и продуктов реакции при температуре 298К. Учитывая близость значений  для
для  примем среднюю теплоемкость газовой смеси в процессе горения равной теплоемкости водяного пара при 298К, а именно
примем среднюю теплоемкость газовой смеси в процессе горения равной теплоемкости водяного пара при 298К, а именно  или
или  .
.
Тогда получим:

| (4.7) |
За счет увеличения объема продуктов сгорания метана в воздухе до ≈ 10,5 м3, по сравнению с объемом продуктов сгорания 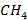 , в чистом кислороде (3,0 м3), жаропроизводительность с 5750 до 2300 К.
, в чистом кислороде (3,0 м3), жаропроизводительность с 5750 до 2300 К.
Закон А. Эйнштейна
В большинстве теплоэнергетических производств стоимость исходного топлива составляет значительную часть производственных издержек. Поэтому при оценке и практическом осуществлении того или иного энерготехнологического процесса необходимо добиться максимально эффективного использования сырья и энергии.
Поэтому важнейшим этапом при рассмотрении любого энерготехнологического процесса являются составления теплового и материального балансов процесса. В самом общем случае справедлив закон А. Эйнштейна, согласно которому полная энергия тела пропорциональна его массе:
 , ,
| (5.1) |
где  – энергия;
– энергия; 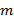 – масса;
– масса;  – скорость света в вакууме, равная ≈ 3·108 м/с.
– скорость света в вакууме, равная ≈ 3·108 м/с.
Прежде чем перейти к составлению теплового баланса попробуем оценить с помощью закона Эйнштейна энергию покоя (всю внутреннюю энергию), которой обладает любое топливо, в том числе и углеводородное, массой 1 г. Тогда получим:

| (5.2) |
Эффективность расхода энергии в энерготехнологическом процессе устанавливается с помощью энергетического баланса. Основой его служит закон Эйнштейна. Однако, когда в теплоэнергетической системе отсутствуют ядерные превращения, величина энергии в соотношении Эйнштейна с точностью по порядку величины 10-9 кДж/г постоянна.
Поэтому в дальнейшем составляют не энергетический, а тепловой баланс.
Эксергия
Для анализа эффективности различных энерготехнологических схем превращения энергии и тепловых процессов часто используют понятие эксергии. Эксергия - это энергия, пригодная для использования. В процессах преобразования энергии она характеризует ее работоспособность. Совершенство аппаратов (печей, парогенераторов, паросиловых установок и др.), производящих тепло, оценивают эксергетическим КПД. Эксергию определяют через максимальную работу, которая может быть получена при обратимом переходе рассматриваемой системы в равновесное состояние с окружающей средой. Использование эксергии для термодинамического анализа называется эксергетическим методом.
Реально протекающие процессы необратимы. При совершении процесса качество эксергии понижается. Например, отработанный пар характеризуется более низкими значениями температуры и давления и вследствие этого может совершить меньше работы. Следить за потоками эксергии удобно с помощью эксергетических диаграмм Сенке.
Детальное рассмотрение эксергии и ее приложений для термодинамического анализа различных систем выходит за рамки курса «Основы ресурсо-энергосберегающих технологий углеводородного сырья».
Более подробные сведения об эксергии содержатся в специальной литературе по технической термодинамике и теплотехнике.
Состав продуктов горения
В условиях неполного сгорания углеводородные топлива ч<
Дата: 2016-10-02, просмотров: 357.