Для выяснения возможности спектрофотометрического определения аскорбиновой кислоты необходимо установить интервал концентраций, в пределах которого, в системе медь-диметилглиоксим-аскорбиновая кислота соблюдается закон Бэра. Исследование проводили при pH=6, т. к. эта среда является оптимальной для процесса комплексообразования. Для этого в мерную пробирку на 10 мл помещали 0,1 мл раствора соли металла, с исходной концентрацией 10-2 моль/л и 0,1мл раствора диметилглиокисма с исходной концентрацией 10-3 моль/л. Концентрацию лекарства меняли в диапазоне от 1∙10-4 до 9∙10-4 моль/л. В каждую пробирку добавляли ацетатно-аммиачный буферный раствор с рН=6. Оптическую плотность снимали при λ=360 нм. На рис.9 приведен градуировочный график для фотометрического определения аскорбиновой кислоты в присутствии диметилглиоксима и меди.
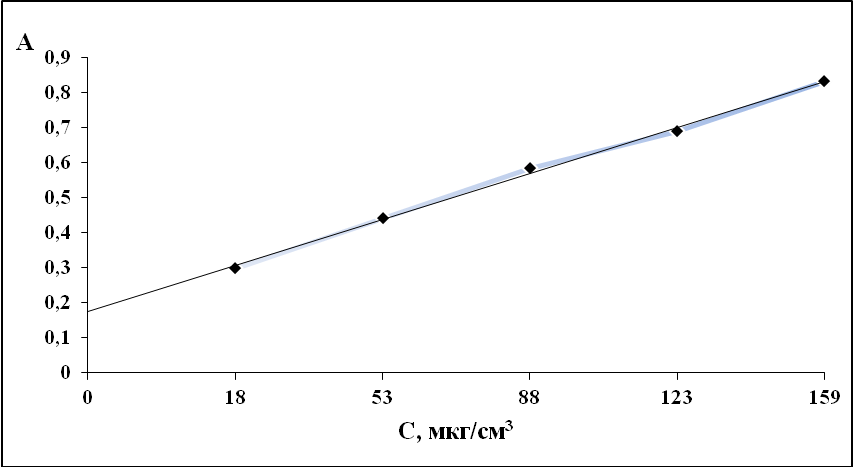
Рис.15. Градуировочный график для определения аскорбиновой кислоты.
С(ДМГ) = 10-4 моль/л, С (Cu2+) = 10-4 моль/л, λ = 360 нм, рН = 6, l = 1 см, спектрофотометр ПЭ-5400В.
Представленный график указывает на возможности определения концентрации аскорбиновой кислоты в интервале от 1∙10-4 до 9∙10-4 моль/л.
Параметры a и b градуировочного графика рассчитывали с помощью метода наименьших квадратов, суть которого заключается в том, что сумма квадратов отклонений экспериментальных точек от оптимальной кривой минимальна. В расчетах параметров a и b использовали следующие формулы:
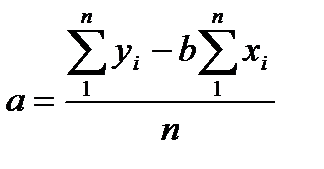 (2.8)
(2.8)
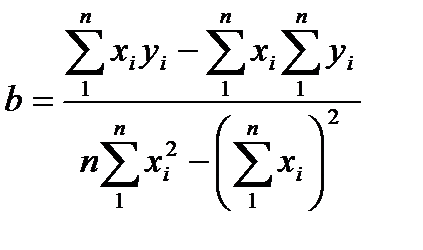 (2.9)
(2.9)
где xi - количество введенной аскорбиновой кислоты (мкг/см3);
yi - измеренная оптическая плотность; n - количество измерений.
Расчет параметров «а» и «b» градуировочного графика описывается уравнением:
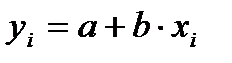
По уравнениям (1) и (2) получаем a = 0,12; и b = 0,15
В итоге получили следующее уравнение градуировочной прямой для определения аскорбиновой кислоты:
yi= 0,12 +0,15xi
Предложенный метод применен для анализа нескольких дозированных форм фармацевтических препаратов, содержащих аскорбиновую кислоту (раствор для инъекций, порошки или таблетки витамина С), при отсутствии помех от каких-либо других наполнителей и лучайных примесей.В качестве метода сравнения использована йодометрия.
Правильность разработанной методики определения аскорбиновой кислоты с использованием меди и диметилглиоксима также проверяли методом «введено – найдено». Результаты представлены в таблице 2.
Таблица 2.
Результаты определения аскорбиновой кислоты в растворе, содержащимся в ампуле и в таблетке аскорутина.
| Образец | Введено мкг/мл | Найдено мкг/мл | Xср ± S · t / √n |
| 1.Аскорбиновая кислота в ампуле | 49,5 | 49,5±0,8 | |
| 2.Аскорбиновая кислота в виде таблеток (рутин) | 47±2,1 | ||
| 3.Аскорбиновая кислота в виде порошка с сахаром | 48±1,5 |
Результаты, представленные в таблице 2, показывают, что воспроизводимость результатов анализа аскорбиновой кислоты в ампуле, достаточно хорошая. Ошибка определения аскорбиновой кислоты в аскорутине связана, вероятно, с влиянием второго компонента (рутина) на процессы комплексообразования с медью и диметилглиоксимом.
Результаты, полученные при применении предлагаемой методики и йодометрическим методом, хорошо согласуются, погрешность составляет менее 5%. Данная методика может быть использован как альтернативная стандартному йодометрическому определению аскорбиновой кислоты в фармацевтических препаратах.
Обсуждение результатов
Опубликовано много методик количественного определения аскорбиновой кислоты. Одной из ранних методик является титрование раствора аскорбиновой кислоты 2,6-дихлорфенол-индофенолом. Этот метод и многие другие основаны на восстановительной способности аскорбиновой кислоты с использованием иода, гексацианоферрата (III) калия, метиленового синиго, хлораимина и многих других окислителей.Однако все эти методы требуют специальной предварительной подготовки образца. Поэтому до сих пор существует наобходимость в создании недорогой и чувствительной методики количественного определения витамина С при массовых анализах фармакологических образцов.
В данной работе предложен спектрофотометрический метод количественного определения аскорбиновой кислоты в фармакологических прапаратах с использованием меди (II) и диметилглиоксима. Полученные результаты хорошо согласуются с данными иодометрического определения аскорбиновой кислоты.
Аскорбиновая кислота кроме своих ярко выраженных восстановительных свойств способна образовывать с ионами Cu2+ комплексное соединение.
Так, например, в работе А.Е.Мартеля показано, что взаимодействие в системе содержащей медь(II), аскорбиновую кислоту и кислород, протекает в несколько стадий. Одна из которых приводит к образованию комплекса аскорбиновой кислоты с Cu2+
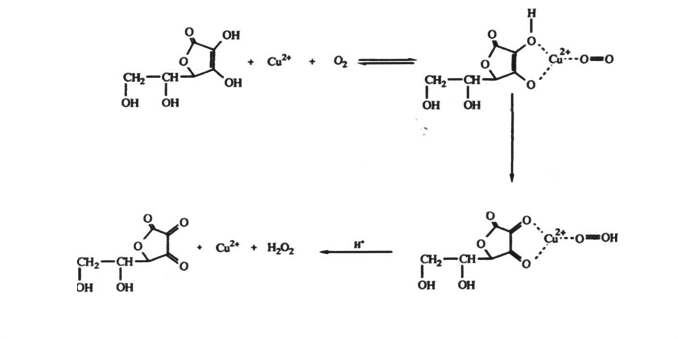
В работе Д.Н.Евтушенко, Н.А. Скорика и В.М.Плотникова[11] представлены данные по образованию комплекса медь-аскорбиновая кислота-1,10-фенантролин (Phen). Данный комплекс подает надежду в качестве противоопухлевого препарата. Авторами было высказано мнение, что образование комплекса идет с переносом заряда, при этом максимум поглощения претерпевает небольшой батохромный сдвиг. [19] Полосы поглощения в области 490 нм авторы относят к межлигандному переносу заряда в котором учавствуют d-орбитали металла. [15] В работе указывается [2] на способность лигандов типа Phen вызывать перенос электрона в результате наличия благоприятного пути для электрона через ненасыщенный лиганд или стабилизации более низкого валентного состояния центрального иона. [11]
Нами в качестве второго компонента был выбран диметилглиоксим:
СН3 С = N OH
CH3 C = N OH
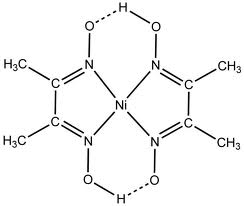
Диметилглиоксим широко применяемый органический реагент, образующий с ионами многих металлов интенсивно окрашенные комплексы, его присутствие повышает селективность и чувствительность фотометрического определения элементов.[41]
Так, например его комплекс с никелем активно используется в количественных методах анализа:
Авторы работы [4] указывают, что ДМГ образует устойчивые комплексные соединения с ионами меди.
Медь-элемент побочной подгруппы I группы периодической системы. Особенностью этого элемента является завершенность (у изолированных атомов) электронного d- подуровня с главным квантовым, числом, равным номеру предыдущего периода. Такая завершенность электронного подуровня 3d10 у меди, достигается за счет «перескока» на (n-l)d- подуровень одного из двух электронов ns-подуровня, заполненного еще у элементов подгруппы кальция.[8] Учитывая особенность электронного строения ионов меди можно объяснить особую склонность меди к реакциям комплексообразования с органическими реагентами, в состав которых входит азот- и кислородсодержащие функциональные группы.[54]
В качестве третьего реагента была выбрана аскорбиновая кислота, так как она может образовывать с медью комплексные соединения. Интересно было исследовать проявление восстановительных свойств аскорбиновой кислоты при взаимодействии медь(II) в присутствии диметилглиоксима.
Так как при фотометрировании раствора содержащего медь (I) , диметилглиоксим и аскорбиновую кислоту и предварительного встряхивании его на воздухе в течение некоторого времени наблюдали увеличение оптической плотности и поглощение при длине волны 360 нм, можно сделать вывод, то медь (I) в условиях эксперимента окисляется кислородом воздуха до меди (II), которая взаимодействует с диметилглиоксимом и аскорбиновой кислотой и приводит к поглощению при 360 нм. Проявление восстановительных свойств аскорбиновой кислоты при рн=6 менее выражено, поэтому и преобладает процесс окисления меди (I) до меди (II).
Учитывая литературные данные, образующийся тройной комплекс содержащий медь (II), диметилглиоксим и аскорбиновую кислоту может быть представлен следующим образом:
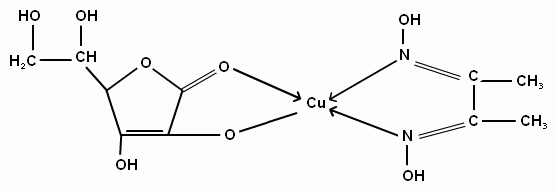
В полученном комплексе медь образует три координационные связи: с двумя атомами азота диметилглиоксима и кислородом аскорбиновой кислоты и одну ионную связь с кислородом гидроксильной группы аскорбиновой кислоты. Образующиеся пятичленные циклы достаточно устойчивые и позволяют использовать окрашенный комплекс Cu2+-ДМГ-АК для создания методики определения содержания аскорбиновой кислоты в различных фармпрепаратах. Предлагаемую методику можно рассматривать как альтернативную стандартному йодометрическому методу определения аскорбиновой кислоты.
ВЫВОДЫ
1.Спектрофотометрическим методом изучены условия комплексообразования в системе медь (II) - диметилглиоксим - аскорбиновая кислота. Показано, что комплексообразование идет в пределах рН=6–8, но оптимальным является рН=6, Максимум поглощения трехкомпонентной системы λ=360 нм.
2.Методом изомолярных серий установлен состав комплекса Сu - ДМГ - АК =1:1:1 при оптимальном рН раствора равным 6 и длине волны 360 нм.
3.Методом Н.П. Комаря для трехкомпонентной системы рассчитан молярный коэффициент поглощения - 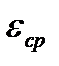 = (4,27۰103) и константа устойчивости: βобр.= (2,75۰1010).
= (4,27۰103) и константа устойчивости: βобр.= (2,75۰1010).
4.Было показано, что медь(I) не образует достаточно окрашенного комплекса с диметилглиоксимом и аскорбиновой кислотой. Со временем при контакте с кислородом происходит окисление меди(I) до двухвалентной, которая с диметилглиоксимом и аскорбиновой кислотой образует комплекс при длине волны 360 нм.
5.Закон Бэра соблюдается в интервале концентраций аскорбиновой кислоты от 18 до 160 мкг/см3 Уравнение градуировочной прямой: y =0,12 +0,15xi.
6.Исследована возможность применения реакции Сu - ДМГ - АК для определения содержания аскорбиновой кислоты методом «введено – найдено».
7.На основании полученных экспериментальных данных и с учетом сведений из литературных источников нами было сделано предположение о структуре образующегося комплексного соединения.
СПИСОК ЛИТЕРАТУРЫ
1. Алиева Р.А., Чырагов Ф.М., Махмудов К.Т. и др. Химия комплексных соединений: Тезисы докл. II Респ. конф. Баку, 202. -95 с.
2. Арзамасцев А.П. Фармацевтическая химия. – М.: ГЭОТАР – МЕД, 2004. – 307-315с.
3. Басоло Ф., Прирсон Р. Механизмы неорганических реакций. М.: Мир, 1971. -212-214 с.
4. Бек М., Надьпал И. Исследование комплексообразования новейшими методами. – М.: Мир, 1989 – 413с.
5. Березов Т.Т. Биологическая химия/Т.Т. Березов, Б.Ф. Коровкин.-М.: Медицина,1982.-147-160с.
6. Булатов М.И., Калинкин И.П. Практическое руководство по фотометрическим и спектрофотометрическим методам анализа. Л.: Химия, 1972. 407 с.
7. Бургер К. Органические реагенты в неорганическом анализе. Пер. с англ. 2 - ое изд. – М.: Химия, 1975. –453-462 с.
8. Вайнштейн Ю.А., Желиговская Н.Н., Галин А.М. // Журн. неогр. химии. 1998. Т.43. №9. -1425-1435 с.
9. Гавриленко Н.А, Мокроусов Г.М., Джиганская О.В. Оптический сенсор для определения аскорбиновой кислоты. // Журнал аналитической химии. 2004. Т. 59 № 9. -967-973 с.
10. Гликина Ф. Б., Ключнеков И. Г. Химия комплексных соединений. ИЗД. 2-е. Учебн. Пособие.- М.: Просвещение, 1973.- 168 с.
11. Глущенко Н.Н. Фармацевтическая химия / Глущенко Н.Н., Плетенева Г.В., Попков В.Н. - М.: Изд. центр «Академия», 2004. – 15-17с.
12. Гринберг А.А. Введение в химию комплексных соединений. - М.: Госхимизд., 1951. – 56-60с.
13. Девис М., Остин ДЖ., Патридж Д. Витамин С. Химия и биохимия. – М., «Мир», 1999. -25-43с.
14. Добаркина В. А., Скорик Н. А. // Журн. неорган. химии. 2001. Т. 46. № 12. -1981-1995с.
15. Евтушенко Д.Н., Скорик Н.А., Плотников В.М. Изучение взаимодействия европия, самария и платины (II) c аскорбиновой кислотой и 1,10-фенантролином // Журн. неорган. химии.2002. Т.47. №11. - 1877-1882с.
16. Инцеди Я. Применение комплексов в аналитической химии. -М.: Мир,1979.-64-98с.
17. Коростелев П.П. Приготовление растворов для химико-аналитических работ. -М.: Наука,1964.– 141-143с.
18. Коростелев П.П. Приготовление растворов для химико-аналитических работ. М. : Химия, 1994. 386 с.
19. Коростелев П.П. Титриметрический и гравиметрический анализ в металлургии. –М.,:Металлургия, 1985. – 314-316с.
20. Кулиев Р.И., Теймуров Э.Ф. Химия комплексных соединений: Тезисы докл. II Респ. конф. Баку, 1999. 155 с.
21. Кульберг Л.М. Органические реактивы в аналитической химии. – М.: Госхимиздат., 1950. - 52-65 с.
22. Машковский М.Д. Лекарственные средства. – 15-е изд., перераб., испр. и доп. – М.: ООО «Издательство Новая Волна», 2005. – 556с.
23. Орехов Ю.Ф. Витамин С. Химия и жизнь. 2001. №3. -12-15с.
24. Перрин Д. Органические аналитические реагенты – М.: Мир, 1967. - 407 c.
25. Пилипенко А.Т., Тананайко М.М. Разнолигандные и разнометалловые комплексы и их применение в аналитической химии.- М.: Химия, 1983. - 103-116с.
26. Подчайнова В.Н., Симонова Л.Н. Аналитическая химия элементов. Медь.- М.: Наука, 1990. - 279 с.
27. Робертс ДЖ., Касерио М. Основы органической химии. М.: Мир, Т.2. 1988. 888 с.
28. Скорик Н.А., Плотников В.М., Козик В.В // Журн. неорг.химии. 1996. Т.41.№7. – 1125-1128 с.
29. Соколовский В.В., ЛебедевЛ.В. О методе раздельного определения аскорбиновой кислоты, дегидроаскорбиновой кислоты, и декитогулоновой кислоты в биологических тканях.//Лабораторное дело №3, 1974. – 23-26с.
30. Сонгина О.А., Захаров В.А. Амперометрическое титрование – 3-е издание, изд. Химия, Москва 1979 - 256;
31. Сорокина Т.С. История медицины и некоторых лекарственных препаратов.- М.: Издательство РУДН, 1992. 89-123с.
32. Спицын В.И., Мартыненко Л.И. Неорганическая химия. - М.: МГУ, 1994. – 546-600с.
33. Угай Я.А. Общая и неорганическая химия. - М.: Высшая школа, 2000. – 222-241с.
34. Умланд Ф., Янсен А., Тиринг Д., Вюнш Г. Комплексные соединения в аналитической химии. М.: Мир, 1995. 531 с.
35. Фарайзаде М.А, Нагизаде С. Простой и надежный спектрофотометрический метод определения аскорбиновой кислоты в фармацевтических прапаратах.// Журнал аналитической химии.2003. Т. 58. №10.-1037-1043 с.
36. Чупахина Г.Н. Колориметрическое определение аскорбиновой кислоты//Специальный практикум по биохимии и физиологии растений/ Под редакцией М.М. Окунцова. Калининград,1981.-10-16с.
37. Ю.А. Золотова. Основы аналитической химии. Кн. 1, изд. Высшая школа , Москва 2002 г. -325-327 с.
38. Яцимирский К. Б. // Журн. неорган. химии. 1971. Т. 24. № 3. -528-530с.
39. Faraizadeh M.A., Nagizasdeh S. // J. Chin. Chem Soc. 2002 V. 49. P. 619
40. Herrero M.J., Simo A.E., Ramis R.G. et al. // Environ. Sci. and Technol. 200. V. 34. P. 1331.
41. http://ascorbinka.x51.ru/index.php?mod=text&uitxt=343
42. http://health.mail.ru/drug/acc_2. html
43. http://him.1september.ru/article.php. html
44. http://ru.wikipedia.org/wiki/Аскорбиновая_кислота
45. http://vitamin-online.ru/20.html
46. http://www.alhimikov.net/element/Cu.html
47. http://www.himikatus.ru/art/demo-exp/0047.php. html
48. http://www.ngpedia.ru/id105483p1.html
49. http://www.pandia.ru/text/77/337/67124.php. html
50. http://www.refstar.ru/data/r/id.22584_1.html
51. http://www.terramedica.spb.ru/2_2008/gromova.html
52. http://www.u-center.info/libraryschoolboy/researchfoodstuff/vitaminc2.html
53. http://www.ximia.org/spravochnik/311.html
54. http://www.xumuk.ru/encyklopedia/1343.html
55. Zhang G., Wang X., Shi X., Sun T. // Talanta. 200. V. 51. P. 1019
Дата: 2016-10-02, просмотров: 322.