Аскорбиновая кислота – органическое соединение, родственное глюкозе, является одним из основных питательных веществ в человеческом рационе, которое необходимо для нормального функционирования соединительной и костной ткани. Выполняет биологические функции восстановителя и кофермента некоторых кофермента и кофермента некоторых метаболических процессов, является антиоксидантом:
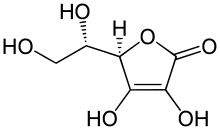
Биологически активен только один из изомеров — L-аскорбиновая кислота, который называют витамином C. В природе аскорбиновая кислота содержится во многих фруктах и овощах.[26]
Из-за наличия двух асимметрических атомов существуют четыре диастереомера аскорбиновой кислоты. Две условно именуемые L- и D- формы хиральны относительно атома углерода в фурановом кольце, а изо- форма является D-изомером по атому углерода в боковой этиловой цепи.
L-изоаскорбиновая, или эриторбовая, кислота используется в качестве пищевой добавки E315.
Аскорбиновая кислота является γ-лактоном, содержащим 2 спиртовых гидроксида в 5-м и 6-м положениях и 2 енольных гидроксида во 2-м и 3-м положении. Енольные гидроксилы обладают кислотными свойствами, дают кислую реакцию на лакмус, взаимодействуют и с NaOH и NaHCO3 . Кислотные свойства более выражены у гидроксила в 3-м положении:
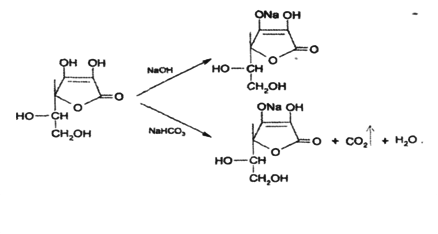
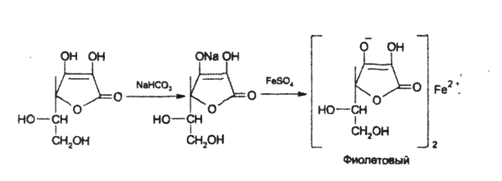
На наличие кислотных свойств основана реакция образования аскорбината железа. Реактив – железа (II) сульфат, не обладающий свойствами окислителя:
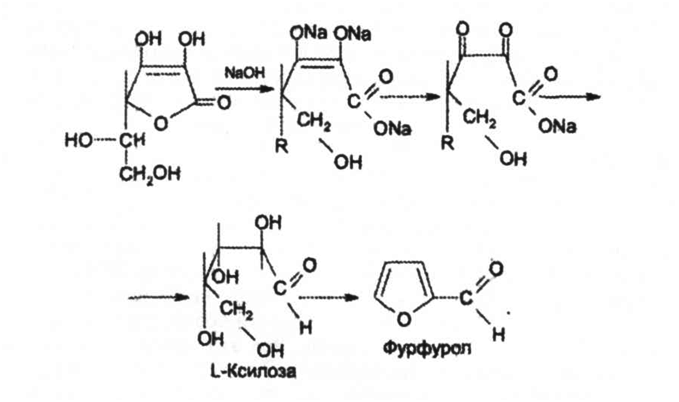
Следует иметь в виду, что аскорбиновая кислота является лактоном и при действии сильных щелочей лактонное кольцо гидролизуется [1], а затем образуется фурфурол:
Окисление L-аскорбиновой кислоты молекулярным кислородом, растворенным в воде, было предметом обсуждения в большом числе работ. Некоторые исследователи сосредоточивали внимание на механизме реакции в растворах, из которых были тщательно удалены переходные металлы, другие, наоборот, пытались выяснить их роль в катализе. В частности, эти исследования и выявили действие ионов Сu2+. Окисление L-аскорбиновой кислоты, дегидроаскорбиновой кислоты и продуктов дальнейшего окисления, по-видимому, катализируется ионами металлов, из которых наиболее сильным является ион Cu2+. Было выполнено много исследований реакций L-аскорбиновой кислоты в этих условиях, но каталитическому окислению других соединений внимания уделялось мало.[51] Авторы многих работ пытались ответить на вопрос, какова роль иона металла, особенно иона Сu2+, в механизме реакции. Хотя картина сегодня несколько и прояснилась, расхождения по этому поводу все же остались. Результаты важной в этой области работы А.Е.Мартеля продемонстрировали, что в соответствующих условиях реакция является процессом первого порядка по концентрации иона металла, аскорбиновой кислоты и молекулярного кислорода. Предложенный им механизм реакции предполагал образование тройного комплекса между L-аскорбиновой кислотой, атомом меди (II) и кислородом.
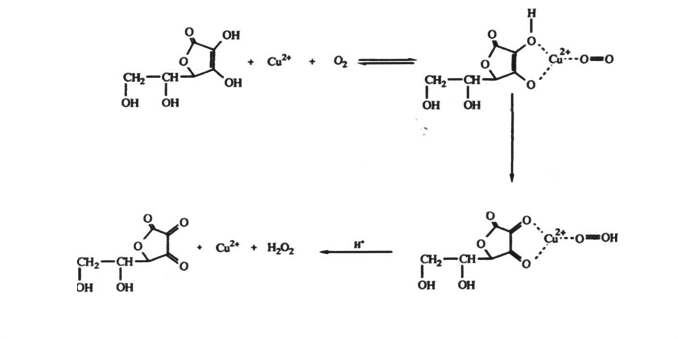
Однако это не окончательное заключение. Известно, что порядок реакции по концентрации кислорода снижается, так как снижается сама концентрация О2.[9]
Окислители (AgNO3,KMnО4,I2, FеCl3, реактив Фелинга и др.) окисляют кислоту аскорбиновую до кислоты дикетоаскорбиновой:
Для определения подлинности препарата обычно используют в качестве окислителей растворы 2,6-дихлорфенолиндофенолята натрия и серебра нитрата, При взаимодействии кислоты аскорбиновой с аммиачным раствором серебра нитрата выпадает темный осадок металлического серебра.[33]
При действии сильных окислителей образуется фурфурол (см. выше).
По физическим свойствам аскорбиновая кислота представляет собой белый кристаллический порошок кислого вкуса и является одноосновной кислотой, дающей соли, типа С6Н7О6М. Легко растворим в воде, растворим в спирте.[50]
Из-за наличия двух асимметрических атомов существуют четыре энантиомера аскорбиновой кислоты. Две условно именуемые L- и D-формы хиральны относительно атома углерода в фурановом кольце, а изо-форма является D –изомером по атому в боковой этиловой цепи.
L –изоаскорбиновая, или эриторбовая , кислота используется в качестве пищевой добавки Е315.[47]
Оптические изомеры аскорбиновой кислоты:
1а-L-аскорбиновая кислота, 2а –L-изоаскорбиновая кислота
1b-D-изоаскорбиновая кислота, 2b-D-аскорбиновая кислота
Недостаток аскорбиновой кислоты в пище человека ведет к развитию ряда недомоганий, приводящих постепенно к тяжелой болезни – цинге. [1]
Симптомы гиповитаминоза следующее: общая слабость, легкая утомляемость, вялость, сонливость (особенно весной), сердечная недостаточность. Снижается устойчивость к различным заболеваниям, в том числе простудным. Замедляется заживление ран и выздоровление при различных болезнях. Ухудшается общее самочувствие. Усиливаются склеротические изменения в сосудах. Увеличивается содержание холестерина в крови, и развивается холестериновый атеросклероз. Происходят частые кровоизлияния из носа. Появляются синие пятнышки на коже (синяки без ушибов). Усиливается гипертония. Возникают боль и кровотечения десен, кариес, расшатывание и выпадение зубов. [30]
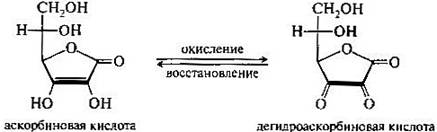
Аскорбиновая кислота отличается непрочностью вследствие наличия двойной связи в молекуле. Она способна обратимо окисляться и восстанавливаться. При обратимом окислении образуется дегидроаскорбиновая кислота (С6Н6О6), что обуславливается наличием в молекуле редко встречающейся в природе эндиольной группировки.
Последняя способна чрезвычайно легко окисляться в дикетогруппировку, обуславливая тем самым исключительную восстановительную способность аскорбиновой кислоты. Молекулярный вес аскорбиновой кислоты 176 г/моль, эквивалентный вес 88 г/мольэ. Она легко растворима в воде и в метиловом спирте, но в высших спиртах (например амиловом) почти нерастворима. Умерено растворима в ацетоне совсем нерастворима в безводном серном эфире и петролейном эфире. Водные растворы аскорбиновой кислоты устойчивы при отсутствии кислорода и в присутствии 2н. соляной кислоты.[39]
Наиболее характерным свойством аскорбиновой кислоты является ее способность давать химически и термодинамически обратимую окислительно-восстановительную систему; с этим свойством обычно связывают ее физиологическую функцию. [17]
Дата: 2016-10-02, просмотров: 322.