МИНОБРНАУКИ РОССИИ
Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования
«Астраханский государственный университет»
Кафедра неорганической и биоорганической химии
На правах рукописи
Сивущина Екатерина Вячеславовна
СПЕКТРОФОТОМЕТРИЧЕСКОЕ ИССЛЕДОВАНИЕ ВЗАИМОДЕЙСТВИЯ МЕДИ (I) В ПРИСУТСТВИИ ОРГАНИЧЕСКИХ РЕАГЕНТОВ
020100.68 Органическая химия
Диссертация на соискание академической степени магистра
000000.68Органическая химия
| Научный руководитель | |||
| к.х.н., доцент | |||
| Хабарова О.В. | |||
Астрахань – 2014
СОДЕРЖАНИЕ
Введение ……………………………………………………………..……..5
Глава I. ЛИТЕРАТУРНЫЙ ОБЗОР ……………………………...……….7
1.1.Аскорбиновая кислота - важный регулятор окислительно-восстановителыных процессов………………………………………..…..7
1.2.Свойства аскорбиновой кислоты……………………...….…………..9
1.3.Применение аскорбиновой кислоты…………………...….………...15
1.4. Химические методы определения аскорбиновой кислоты…...…..19
1.4.1. Качественное определение аскорбиновой кислоты метиленовым синим………………………………………………………………………19
1.4.2.Определение аскорбиновой кислоты методом титрования реактивом Тильманса…………………..………………………..………..19
1.4.3. Определение аскорбиновой кислоты методом йодометрического титрования………………………………………………………………....21
1.4.4.Определение аскорбиновой кислоты методом броматометрического титрования………………………..……..……….21
1.4.5. Алкалиметрия……………………………………..………………..22
1.4.6. Йодометрия…………………….…………………………………...22
1.4.7.Смешанолигандное комплексообразование меди (II) с фенантролином, аскорбиновой и никотиновой кислотой…...…....……23
1.5. Биологические методы определения аскорбиновой кислоты…....26
1.6.Физико-химические методы определения аскорбиновой кислоты...…………………………………………………………………..27
1.6.1.Спектрофотометрический метод……………..……...…...…..…....27
1.6.2. Электрохимический метод…………….……………...………...…29
1.6.3. Хроматографический метод…………………………..…...…...…29
1.7. Аскорбинометрия……………………......………………………..….31
1.8. Комплексные соединения меди (II)……………….….…………..…33
1.9. Взаимодействие диметилглиоксима с медью……………...……….35
Глава II. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ…………………..………..37
2.1. Материалы и аппаратура…………...…………………............……..37
2.2. Исследование условий реакций комплексообразования меди(II) с аскорбиновой кислотой в присутствии диметилглиоксима…...……….38
2.2.1. Влияние рН на процесс комплексообразования системы медь-диметилглиоксим-аскорбиновая кислота…………………………..…...38
2.2.2.Исследование влияния аскорбиновой кислоты на комплексообразование меди с диметилглиоксимом..…………...……..42
2.2.3.Влияние стабилизаторов на устойчивость комплекса..…..…..…..43
2.2.4.Изменение оптической плотности во времени………...….………44
2.3.Определение состава разнолигандного комплекса……...………….46
2.3.1.Определение молярного соотношения между медью и диметилглиоксимом………………………………………………..….….46
2.3.2.Определение молярного соотношения между медью и аскорбиновой кислотой………………………………………….……….47
2.3.3.Определение соотношения между диметилглиоксимом и аскорбиновой кислотой………………………………………………..…48
2.4. Сравнение восстановительных свойств аскорбиновой кислоты и АЦЦ………………………………………………………………………..50
2.5. Исследование светопоглощения трехкомпонентной системы в зависимости от формы выпуска лекарственного аппарата (аскорбиновой кислоты)…………………………………………………51
2.6. Исследование комплексообразования одновалентной меди с диметилглиоксимом и аскорбиновой кислотой………………………52
2.7.Молярный коэффициент поглощения комплекса медь диметилглиоксим – аскорбиновая кислота………………………...……55
2.8.Спектрофотометрическое определение аскорбиновой кислоты в присутствии меди и диметилглиоксима…………………………………58
Обсуждение результатов………………………………………....………62
Выводы………………………………………………………….……..…..67
Список использованной литературы…………………………..………...68
ВВЕДЕНИЕ
Разработка простых, экспрессных, экономичных, но в то же время - чувствительных и селективных методов определения лекарственных средств в различных объектах, остается одной из актуальных задач аналитической и фармацевтической химии. Это связано с постоянным ростом количества фальсифицированных лекарств.
В последние годы для этих целей успешно используются различные варианты комплексообразования некоторых элементов, в частности металлов, с органическими реагентами. Поэтому актуальным явилось исследование процесса комплексообразования витамина С с медью в присутствии органического реагента - диметилглиоксима.
Витаминные препараты широко применяют в медицине с учетом их специфического и неспецифического лечебного действия на организм. Витамины как специфические фармакопрепараты используются для лечения заболеваний, основу этиологии и патогенеза которых составляет авитаминоз или гиповитаминоз.
Витамины как неспецифические препараты применяют в разных целях. Так, многие витамины назначают для повышения общей реактивности организма, его сопротивляемости к инфекциям, улучшения обмена веществ, трофики тканей, функции центральной нервной системы, активизации процессов свертываемости крови, восстановления нарушенной проницаемости и резистентности капилляров.
Одним из представителей витаминов является витамин С (аскорбиновая кислота). Аскорбиновая кислота имеет важное значение для жизнедеятельности организма: участвует в регуляции окислительно-восстановительных процессов, углеводного обмена, в обеспечении нормальной проницаемости капилляров, в процессах свертывания крови, синтезе стероидных гормонов, транспорте кислорода, повышает иммунологическую реактивность организма, активизирует процессы кроветворения, функцию паращитовидных желез, оказывает противовоспалительное действие, потенцирует действие гонадотропных гормонов гипофиза. [3]
Для определения подлинности аскорбиновой кислоты используется ее способность к окислительно-восстановительным реакциям: с реактивом Фелинга, с раствором перманганата калия, с феррицианидом калия в присутствии разбавленной хлороводородной кислоты, с солью двухвалентного железа и т.д. [7]
Данные методы имеют определенные недостатки, поэтому актуальной является разработка новой чувствительной и селективной методики определения аскорбиновой кислоты.
Поэтому целью данной работы явилось исследование возможности определения аскорбиновой кислоты по реакции образования разнолигандного комплекса с медью и диметилглиоксимом.
Исходя из выше указанной цели, нами были поставлены следующие задачи:
1. Изучить образование разнолигандного комплекса при различных значениях кислотности среды.
2. Определить основные спектрофотометрические характеристики комплекса медь-аскорбиновая кислота-диметилглиоксим.
3. Выяснить молярные соотношения компонентов в образующейся тройной системе.
4. Изучить возможность количественного определения содержания аскорбиновой кислоты с помощью новой аналитической системы.
Глава I. Литературный обзор
Алкалиметрия
Кислотные свойства кислоты аскорбиновой выражены в достаточной степени, что позволяет количественно определять лекарственное вещество алкалиметрически. Кислота аскорбиновая титруется стандартным 0,1 М раствором натрия гидроксида как одноосновная кислота по енольному гидроксилу в 3-м положении.
Выраженные восстановительные свойства кислоты аскорбиновой лежат в основе нескольких методик количественного определения данного лекарственного вещества (йодатометрия, йодометрия, йодхлорметрия). [1]
Йодометрия
Кислота аскорбиновая окисляется титрованным раствором йода в нейтральной, слабокислой или слабощелочной средах до кислоты дегидроаскорбиновой.
Возможны и другие методики, например титрование натрия 2,6-дихлорфенолиндофенолятом.
Кислота аскорбиновая используется в виде порошков, таблеток и растворов для инъекций. Поскольку в растворах она легко окисляется, инъекционные растворы готовят на воде, насыщенной СО2, с добавлением стабилизаторов-антиоксидантов (Na2SО3, Na2S2О5). В раствор для инъекций добавляют натрия гидрокарбонат, так как препарат имеет кислую реакцию среды, раздражающую ткани.
При йодатометрическом методе количественного определения кислоты аскорбиновой в инъекционном растворе следует учитывать наличие антиоксидантов-стабилизаторов, которые будут реагировать с титрантом - КIO3. Поэтому вначале к раствору добавляют раствор формальдегида, связывающий антиоксиданты. [20]
1.4.7.Смешанолигандноекомплексообразование меди (II) с фенантролином, аскорбиновой и никотиновой кислотой
Жизненно важные металлы, такие как железо, медь, цинк, марганец, молибден, кобальт и другие, образуют комплексные соединения с биолигандами, в качестве которых выступают аминокислоты, витамины, белки, гормоны. Органические лиганды могут одновременно входить в координационную сферу металла и оказывать взаимное влияние. Изучение смешанолигандного комплексообразования помогает выяснить характер этого влияния. [24]
В качестве комплексообразователя авторами выбран катион Cu2+ , а в качестве лигандов — витамины и слабые органические основания. Комплексы металлов с аскорбиновой кислотой (витамин С) играют важную роль в процессах окисления аскорбиновой кислоты в живых клетках.
Никотиновая кислота (пиридин-3-карбоновая кислота), известная как витамин РР, тоже является комплексообразующим агентом благодаря наличию карбоксильной группы и гетероциклического атома азота в ее молекуле.
Фенантролин — органическое основание — в процессах комплексообразования выступает в качестве лиганда, способного участвовать в образовании d- и р-связей и облегчающего вхождение в координационную сферу металла второго лиганда.[43]
Методами pH-потенциометрии, спектро- и фотометрии (в сульфатной и нитратной средах) установлено смешаннолигандное комплексообразование (СЛК) в системах: медь (II)–аскорбиновая кислота–фенантролин, медь(II)–аскорбиновая кислота–никотиновая кислота. Определены состав и устойчивость однолигандного комплекса [CuHAsc]+, [CuHAscPhen]+, [CuHAscNic].
Изучению смешанолигандного комплексообразования предшествовало исследование однолигандных комплексов в системах: медь (II)–аскорбиновая кислота, медь (II)–никотиновая кислота [25] и медь (II)–фенантролин.
Взаимодействие в системе Сu2+–H2Asc представляет собой сложный химический процесс, состоящий из нескольких стадий и протекающий в соответствии со схемой:
Cu2+ + n Lz–←→ [CuLn]2 + z→ Cu+ + продукты окисления → Сu(тв) (1)
где Lz– — анион аскорбиновой кислоты.
Стадия окислительно-восстановительного распада образующегося промежуточного протонированного аскорбатного комплекса меди (II) состава 1 : 1 является реакцией первого порядка и лимитирующей. Однолигандный аскорбатный комплекс характеризуется константой устойчивости, логарифм которой равен 2.09 ± 0.06.
Измерение оптической плотности в системе CuSO4–Phen при различных рН показывает, что 100 %-ный выход фенантролинатного комплекса меди (II) состава 1 : 1 достигается при pН ≈ 3 и характеризуется коэффициентом молярного погашения = 28.5 (λэф = 670 Нм).
Комплекс [СuРhen]2+не подвергается окислительно-восстановительному распаду, о чем свидетельствует постоянство окраски в течение длительного времени. По данным Инцеди [12] логарифм константы устойчивости комплекса [CuPhen]2+составляет 9.25 (I = 0.1).
Состав комплексов в системах Cu2+–H2Asc, Cu2+–H2Asc–HNic и Cu2+–H2Asc–Phen определяли при pН ≈ 3.1 и ионной силе I = 0.2. Состав однолигандных комплексов устанавливали методом изомолярных серий, смешанолигандных — скорбатникотинатного [CuHAscNic] и аскорбатфенантролинатного [CuHAscPhen]3+ комплексов — по методу насыщения из графика зависимости ∆D от CL/CCuHAsc, построенному по полученным экспериментальным данным.
В системах CuSO4–H2Asc–Phen и CuSO4–H2Asc–HNic образуются комплексы состава 1:1:1:
Cu2+ + HАsc– + Phen [CuHAscPhen] + (2)
Cu2+ + HАsc–+ Nic– [CuHAscNic] (3)
Изучена устойчивость [CuHAscPhen]+, [CuHAscNic] в водных растворах с ионной силой I = 0.2 при pH от ≈ 3 до 6, рассчитанных константы устойчивости. Найдены эффективные константы скорости окислительно-восстановительного распада комплексов [CuHAsc]+, [CuHAscPhen]+, [CuHAscNic] в сульфатной и нитратной средах. Электронные спектры поглощения (ЭСП) в видимой области сняты на спектрофотометре UVIKON 943 при комнатной температуре и при температуре 2–3 ºС. В ЭСП двойных и тройных систем по сравнению с водным раствором CuSO4 наблюдается смещение максимума полосы поглощения в коротковолновую область, что может свидетельствовать о комплексообразовании в этих растворах. [8]
1.5. Биологические методы определения аскорбиновой кислоты
Сегодня биологические методы представляют главным образом исторический интерес. Но на самом деле их преимущество заключается в том, что они основаны на определении конкретного профилактического и лечебного свойства, а именно антискорбутной активности, присущей и дегидроаскорбиновой кислоте. Биологические методы требуют больших затрат времени и средств и дают широкий разброс результатов, которые не всегда надежны. Для проведения биоанализа используют морских свинок, так как крысы синтезируют собственный витамин С. Животных выдерживают на искусственном рационе с добавлением различных количеств витамина, затем забивают, а их зубы подвергают гистологическому анализу. В результате устанавливают степень защиты от цинги в зависимости от количеств аскорбиновой кислоты, поступающей с пищей. Антискорбутная активность 0,05 мг аскорбиновой кислоты принята в качестве международной единицы для измерения содержания витамина С. [9]
1.6. Физико-химические методы определения аскорбиновой кислоты
Электрохимический метод
Электрохимический метод предоставляют возможность высокоселективного анализа с высокой точностью и воспроизводимостью; к тому же он очень прост в исполнении. Было предложено множество методик. Например, в таблетках поливитаминов, содержащих соединения Fe2+, витамин С был проанализирован методом дифференциальной пульсирующей вольтамперометрии на стеклянном углеродном электроде. Однако эти методики не нашли широкого применения, так как необходима большая работа по их совершенствованию.[36]
Хроматографический метод
Хроматографический метод дает самую большую надежду на преодоление основной проблемы, связанной с присутствием в смесях, содержащих витамин С, множества мешающих анализу веществ. Как мы уже видели, пока не существует методов, позволяющих четко и непосредственно определять небольшие количества L-аскорбиновой кислоты и продуктов ее окисления в присутствии любых других соединений. Единственный удовлетворительный способ достижения специфичности заключается в хроматографическом отделении анализируемых соединений друг от друга, а также от остальных веществ.
Вплоть до относительно недавнего времени наиболее часто из хроматографических методов использовали обычно газожидкостную хроматографию (ГЖХ). Определить L-аскорбиновую кислоту непосредственно этим методом невозможно из-за ее нелетучести. Для того чтобы иметь такую возможность, была разработана длительная процедура превращения L-аскорбиновой кислоты в летучий триметилсилиловый эфир. Такой метод позволяет получать точные и воспроизводимые результаты, но из-за длительности предварительной подготовки образца он не так удобен, как разработанный недавно метод высокоэффективной жидкостной хроматографии (ВЭЖХ).
В настоящее время ВЭЖХ стала альтернативным способом быстрого определения самых разнообразных органических и неорганических соединений. Она часто находит применение в фармацевтической промышленности для анализа болеутоляющих и других препаратов. ВЭЖХ давно используется и для анализа витаминов. Однако это не решает всех проблем в случае определения витамина С. [17]
Аскорбинометрия
В аскорбинометрии рабочим раствором служит стандартный раствор аскорбиновой кислоты, которая окисляется по уравнению:
ЗС6Н8О6 = ЗС6Н606 + 6Н+ + 6е.
Аскорбинометрия основана на использовании аскорбиновой кислоты (АК) С6Н8О6 как восстановителя. Ее применяют для прямого титрования различных окислителей. [1]
Аскорбинометрию применяют I2,IO-3, BrO-3,VO-3, CrO4-2, NO3-, MnO4-, Sn (IV), Ag+, Hg2+, H2O2, PbO2, Cu2+ и т.д.
Окислительно-восстановительный потенциал аскорбиновой кислоты
при рН=7 и 21 °С равен +0,185 В. Аскорбинометрическое определение Fe3+ является одним из лучших, так как при этом не мешают нитраты и фосфаты; присутствие фторидов вызывает незначительную ошибку.
Недостатком является малая устойчивость титрованного раствора аскорбиновой кислоты при хранении.
Вариаминбляу является редокс-индикатором в кислой среде. Окисленная форма имеет синюю или красную окраску; восстановленная форма бесцветна. Переход окраски обратим. Сильные окислители постепенно разрушают индикатор.
При определении Fe3+ титрованием аскорбиновой кислотой индикатор добавляют незадолго до наступления точки эквивалентности, так как сильно окисляющий раствор частично разрушает индикатор. Для ускорения реакции титруемый раствор нагревают до 40 — 50 °С. Титрование с вариаминбляу дает более точные результаты, чем с роданидомаммония. [14]
Основные недостаткиаскорбинометрии следующие: аскорбиновая кислота подвержена действию энзим и ультрафиолетовых лучей, каталитически ускоряющих ее разложение. Поэтому для приготовления стандартных растворов рекомендуется применять особо чистые образцы аскорбиновой кислоты и хранить их на холоде в темноте в склянках из оранжевого стекла. Для стабилизации растворов аскорбиновой кислоты рекомендуется добавлять к ним этилендиаминтетрауксусную кислоту (ЭДТА) и муравьиную кислоту, благодаря чему ее стандартные растворы сохраняются дольше.
В химическом анализе, использующем редокс-реакции, сложился набор веществ, которые наиболее широко используют в качестве титрантов. Поэтому в руководствах по аналитической химии для реакций окисления отдельно рассматриваются перманганатометрия, бихроматометрия, цериметрия, броматометрия, а для реакций восстановления - хроматометрия, титанометрия, аскорбинометрия. [27]
Обсуждение результатов
Опубликовано много методик количественного определения аскорбиновой кислоты. Одной из ранних методик является титрование раствора аскорбиновой кислоты 2,6-дихлорфенол-индофенолом. Этот метод и многие другие основаны на восстановительной способности аскорбиновой кислоты с использованием иода, гексацианоферрата (III) калия, метиленового синиго, хлораимина и многих других окислителей.Однако все эти методы требуют специальной предварительной подготовки образца. Поэтому до сих пор существует наобходимость в создании недорогой и чувствительной методики количественного определения витамина С при массовых анализах фармакологических образцов.
В данной работе предложен спектрофотометрический метод количественного определения аскорбиновой кислоты в фармакологических прапаратах с использованием меди (II) и диметилглиоксима. Полученные результаты хорошо согласуются с данными иодометрического определения аскорбиновой кислоты.
Аскорбиновая кислота кроме своих ярко выраженных восстановительных свойств способна образовывать с ионами Cu2+ комплексное соединение.
Так, например, в работе А.Е.Мартеля показано, что взаимодействие в системе содержащей медь(II), аскорбиновую кислоту и кислород, протекает в несколько стадий. Одна из которых приводит к образованию комплекса аскорбиновой кислоты с Cu2+
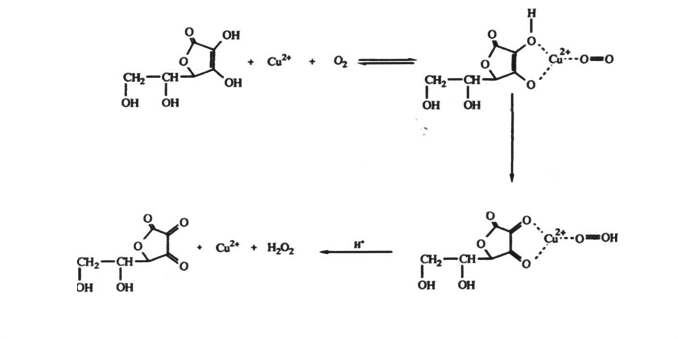
В работе Д.Н.Евтушенко, Н.А. Скорика и В.М.Плотникова[11] представлены данные по образованию комплекса медь-аскорбиновая кислота-1,10-фенантролин (Phen). Данный комплекс подает надежду в качестве противоопухлевого препарата. Авторами было высказано мнение, что образование комплекса идет с переносом заряда, при этом максимум поглощения претерпевает небольшой батохромный сдвиг. [19] Полосы поглощения в области 490 нм авторы относят к межлигандному переносу заряда в котором учавствуют d-орбитали металла. [15] В работе указывается [2] на способность лигандов типа Phen вызывать перенос электрона в результате наличия благоприятного пути для электрона через ненасыщенный лиганд или стабилизации более низкого валентного состояния центрального иона. [11]
Нами в качестве второго компонента был выбран диметилглиоксим:
СН3 С = N OH
CH3 C = N OH
Диметилглиоксим широко применяемый органический реагент, образующий с ионами многих металлов интенсивно окрашенные комплексы, его присутствие повышает селективность и чувствительность фотометрического определения элементов.[41]
Так, например его комплекс с никелем активно используется в количественных методах анализа:
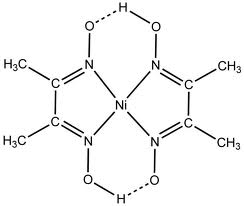
Авторы работы [4] указывают, что ДМГ образует устойчивые комплексные соединения с ионами меди.
Медь-элемент побочной подгруппы I группы периодической системы. Особенностью этого элемента является завершенность (у изолированных атомов) электронного d- подуровня с главным квантовым, числом, равным номеру предыдущего периода. Такая завершенность электронного подуровня 3d10 у меди, достигается за счет «перескока» на (n-l)d- подуровень одного из двух электронов ns-подуровня, заполненного еще у элементов подгруппы кальция.[8] Учитывая особенность электронного строения ионов меди можно объяснить особую склонность меди к реакциям комплексообразования с органическими реагентами, в состав которых входит азот- и кислородсодержащие функциональные группы.[54]
В качестве третьего реагента была выбрана аскорбиновая кислота, так как она может образовывать с медью комплексные соединения. Интересно было исследовать проявление восстановительных свойств аскорбиновой кислоты при взаимодействии медь(II) в присутствии диметилглиоксима.
Так как при фотометрировании раствора содержащего медь (I) , диметилглиоксим и аскорбиновую кислоту и предварительного встряхивании его на воздухе в течение некоторого времени наблюдали увеличение оптической плотности и поглощение при длине волны 360 нм, можно сделать вывод, то медь (I) в условиях эксперимента окисляется кислородом воздуха до меди (II), которая взаимодействует с диметилглиоксимом и аскорбиновой кислотой и приводит к поглощению при 360 нм. Проявление восстановительных свойств аскорбиновой кислоты при рн=6 менее выражено, поэтому и преобладает процесс окисления меди (I) до меди (II).
Учитывая литературные данные, образующийся тройной комплекс содержащий медь (II), диметилглиоксим и аскорбиновую кислоту может быть представлен следующим образом:
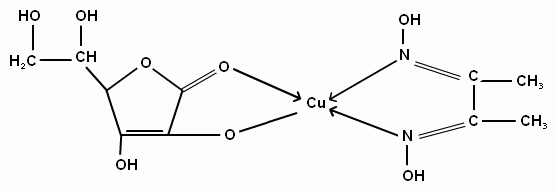
В полученном комплексе медь образует три координационные связи: с двумя атомами азота диметилглиоксима и кислородом аскорбиновой кислоты и одну ионную связь с кислородом гидроксильной группы аскорбиновой кислоты. Образующиеся пятичленные циклы достаточно устойчивые и позволяют использовать окрашенный комплекс Cu2+-ДМГ-АК для создания методики определения содержания аскорбиновой кислоты в различных фармпрепаратах. Предлагаемую методику можно рассматривать как альтернативную стандартному йодометрическому методу определения аскорбиновой кислоты.
ВЫВОДЫ
1.Спектрофотометрическим методом изучены условия комплексообразования в системе медь (II) - диметилглиоксим - аскорбиновая кислота. Показано, что комплексообразование идет в пределах рН=6–8, но оптимальным является рН=6, Максимум поглощения трехкомпонентной системы λ=360 нм.
2.Методом изомолярных серий установлен состав комплекса Сu - ДМГ - АК =1:1:1 при оптимальном рН раствора равным 6 и длине волны 360 нм.
3.Методом Н.П. Комаря для трехкомпонентной системы рассчитан молярный коэффициент поглощения - 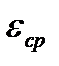 = (4,27۰103) и константа устойчивости: βобр.= (2,75۰1010).
= (4,27۰103) и константа устойчивости: βобр.= (2,75۰1010).
4.Было показано, что медь(I) не образует достаточно окрашенного комплекса с диметилглиоксимом и аскорбиновой кислотой. Со временем при контакте с кислородом происходит окисление меди(I) до двухвалентной, которая с диметилглиоксимом и аскорбиновой кислотой образует комплекс при длине волны 360 нм.
5.Закон Бэра соблюдается в интервале концентраций аскорбиновой кислоты от 18 до 160 мкг/см3 Уравнение градуировочной прямой: y =0,12 +0,15xi.
6.Исследована возможность применения реакции Сu - ДМГ - АК для определения содержания аскорбиновой кислоты методом «введено – найдено».
7.На основании полученных экспериментальных данных и с учетом сведений из литературных источников нами было сделано предположение о структуре образующегося комплексного соединения.
СПИСОК ЛИТЕРАТУРЫ
1. Алиева Р.А., Чырагов Ф.М., Махмудов К.Т. и др. Химия комплексных соединений: Тезисы докл. II Респ. конф. Баку, 202. -95 с.
2. Арзамасцев А.П. Фармацевтическая химия. – М.: ГЭОТАР – МЕД, 2004. – 307-315с.
3. Басоло Ф., Прирсон Р. Механизмы неорганических реакций. М.: Мир, 1971. -212-214 с.
4. Бек М., Надьпал И. Исследование комплексообразования новейшими методами. – М.: Мир, 1989 – 413с.
5. Березов Т.Т. Биологическая химия/Т.Т. Березов, Б.Ф. Коровкин.-М.: Медицина,1982.-147-160с.
6. Булатов М.И., Калинкин И.П. Практическое руководство по фотометрическим и спектрофотометрическим методам анализа. Л.: Химия, 1972. 407 с.
7. Бургер К. Органические реагенты в неорганическом анализе. Пер. с англ. 2 - ое изд. – М.: Химия, 1975. –453-462 с.
8. Вайнштейн Ю.А., Желиговская Н.Н., Галин А.М. // Журн. неогр. химии. 1998. Т.43. №9. -1425-1435 с.
9. Гавриленко Н.А, Мокроусов Г.М., Джиганская О.В. Оптический сенсор для определения аскорбиновой кислоты. // Журнал аналитической химии. 2004. Т. 59 № 9. -967-973 с.
10. Гликина Ф. Б., Ключнеков И. Г. Химия комплексных соединений. ИЗД. 2-е. Учебн. Пособие.- М.: Просвещение, 1973.- 168 с.
11. Глущенко Н.Н. Фармацевтическая химия / Глущенко Н.Н., Плетенева Г.В., Попков В.Н. - М.: Изд. центр «Академия», 2004. – 15-17с.
12. Гринберг А.А. Введение в химию комплексных соединений. - М.: Госхимизд., 1951. – 56-60с.
13. Девис М., Остин ДЖ., Патридж Д. Витамин С. Химия и биохимия. – М., «Мир», 1999. -25-43с.
14. Добаркина В. А., Скорик Н. А. // Журн. неорган. химии. 2001. Т. 46. № 12. -1981-1995с.
15. Евтушенко Д.Н., Скорик Н.А., Плотников В.М. Изучение взаимодействия европия, самария и платины (II) c аскорбиновой кислотой и 1,10-фенантролином // Журн. неорган. химии.2002. Т.47. №11. - 1877-1882с.
16. Инцеди Я. Применение комплексов в аналитической химии. -М.: Мир,1979.-64-98с.
17. Коростелев П.П. Приготовление растворов для химико-аналитических работ. -М.: Наука,1964.– 141-143с.
18. Коростелев П.П. Приготовление растворов для химико-аналитических работ. М. : Химия, 1994. 386 с.
19. Коростелев П.П. Титриметрический и гравиметрический анализ в металлургии. –М.,:Металлургия, 1985. – 314-316с.
20. Кулиев Р.И., Теймуров Э.Ф. Химия комплексных соединений: Тезисы докл. II Респ. конф. Баку, 1999. 155 с.
21. Кульберг Л.М. Органические реактивы в аналитической химии. – М.: Госхимиздат., 1950. - 52-65 с.
22. Машковский М.Д. Лекарственные средства. – 15-е изд., перераб., испр. и доп. – М.: ООО «Издательство Новая Волна», 2005. – 556с.
23. Орехов Ю.Ф. Витамин С. Химия и жизнь. 2001. №3. -12-15с.
24. Перрин Д. Органические аналитические реагенты – М.: Мир, 1967. - 407 c.
25. Пилипенко А.Т., Тананайко М.М. Разнолигандные и разнометалловые комплексы и их применение в аналитической химии.- М.: Химия, 1983. - 103-116с.
26. Подчайнова В.Н., Симонова Л.Н. Аналитическая химия элементов. Медь.- М.: Наука, 1990. - 279 с.
27. Робертс ДЖ., Касерио М. Основы органической химии. М.: Мир, Т.2. 1988. 888 с.
28. Скорик Н.А., Плотников В.М., Козик В.В // Журн. неорг.химии. 1996. Т.41.№7. – 1125-1128 с.
29. Соколовский В.В., ЛебедевЛ.В. О методе раздельного определения аскорбиновой кислоты, дегидроаскорбиновой кислоты, и декитогулоновой кислоты в биологических тканях.//Лабораторное дело №3, 1974. – 23-26с.
30. Сонгина О.А., Захаров В.А. Амперометрическое титрование – 3-е издание, изд. Химия, Москва 1979 - 256;
31. Сорокина Т.С. История медицины и некоторых лекарственных препаратов.- М.: Издательство РУДН, 1992. 89-123с.
32. Спицын В.И., Мартыненко Л.И. Неорганическая химия. - М.: МГУ, 1994. – 546-600с.
33. Угай Я.А. Общая и неорганическая химия. - М.: Высшая школа, 2000. – 222-241с.
34. Умланд Ф., Янсен А., Тиринг Д., Вюнш Г. Комплексные соединения в аналитической химии. М.: Мир, 1995. 531 с.
35. Фарайзаде М.А, Нагизаде С. Простой и надежный спектрофотометрический метод определения аскорбиновой кислоты в фармацевтических прапаратах.// Журнал аналитической химии.2003. Т. 58. №10.-1037-1043 с.
36. Чупахина Г.Н. Колориметрическое определение аскорбиновой кислоты//Специальный практикум по биохимии и физиологии растений/ Под редакцией М.М. Окунцова. Калининград,1981.-10-16с.
37. Ю.А. Золотова. Основы аналитической химии. Кн. 1, изд. Высшая школа , Москва 2002 г. -325-327 с.
38. Яцимирский К. Б. // Журн. неорган. химии. 1971. Т. 24. № 3. -528-530с.
39. Faraizadeh M.A., Nagizasdeh S. // J. Chin. Chem Soc. 2002 V. 49. P. 619
40. Herrero M.J., Simo A.E., Ramis R.G. et al. // Environ. Sci. and Technol. 200. V. 34. P. 1331.
41. http://ascorbinka.x51.ru/index.php?mod=text&uitxt=343
42. http://health.mail.ru/drug/acc_2. html
43. http://him.1september.ru/article.php. html
44. http://ru.wikipedia.org/wiki/Аскорбиновая_кислота
45. http://vitamin-online.ru/20.html
46. http://www.alhimikov.net/element/Cu.html
47. http://www.himikatus.ru/art/demo-exp/0047.php. html
48. http://www.ngpedia.ru/id105483p1.html
49. http://www.pandia.ru/text/77/337/67124.php. html
50. http://www.refstar.ru/data/r/id.22584_1.html
51. http://www.terramedica.spb.ru/2_2008/gromova.html
52. http://www.u-center.info/libraryschoolboy/researchfoodstuff/vitaminc2.html
53. http://www.ximia.org/spravochnik/311.html
54. http://www.xumuk.ru/encyklopedia/1343.html
55. Zhang G., Wang X., Shi X., Sun T. // Talanta. 200. V. 51. P. 1019
МИНОБРНАУКИ РОССИИ
Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования
«Астраханский государственный университет»
Кафедра неорганической и биоорганической химии
На правах рукописи
Сивущина Екатерина Вячеславовна
Дата: 2016-10-02, просмотров: 308.