Диметилглиоксим, диоксимдиацетила – органическое соединение, оксим:

Диметилглиоксим(2,3-бутандиондиоксим), молекулярная масса равна 116,12 г/моль; бесцветные кристаллы; температура плавления равна 238 °С; плохо растворим в воде, хорошо - в этаноле и диэтиловом эфире. Образует устойчивые внутрикомплексные соединения с переходными металлами, например, с никелем (II). Диметилглиоксим- реагент для гравиметрического, спектрофотометрического и экстракционно-фотометрического определения никеля (II) и палладия (II). Особенно широко он применяется для спектрофотометрического определения никеля в присутствии окислителей (I2, Вr2) в щелочной среде. Метод используется при анализе чистых веществ, природных вод, сталей. Использование диметилглиоксима позволяет определять палладий в присутствии множества других элементов, в том числе родия и иридия. [31]
Как селективный реагент на никель диметилглиоксим предложен в 1905 Л. А. Чугаевым, поэтому диметилглиоксим иногда называют «реактив Чугаева».
При взаимодействии с ионами никеля диметилглиоксим образует красный комплекс, который может быть легко осажден и определен гравиметрически.[38]
Однако было бы неправильным считать, что диметилглиоксим реагирует исключительно с перечисленными металлами. Имеется много наблюдений, что диметилглиоксим образует очень прочные комплексы со всеми Зd5—Зd10-переходными металлами. Например, его комплексы с медью имеют коричневато-красный цвет, с железом (II) — красноватый, а с кобальтом (II)—коричневатый. Однако эти хелаты более растворимы в воде, и поэтому присутствие указанных металлов не мешает весовому определению никеля.[49]
Строение комплексов диметилглиоксима устанавливали методом дифракции рентгеновских лучей и ИК-спектрометрией. В комплексах оба лиганда диметилглиоксима находятся в плоской квадратной конфигурации. Оба лиганда связаны между собой прочными внутримолекулярными водородными связями, стабилизирующими хелат, в котором соотношение металл:лиганд равно 1:2. Это вызывает аномальное соотношение констант устойчивости на различных стадиях, поэтому даже при небольшом избытке реагента может количественно образоваться комплекс. Данные исследования дифракции рентгеновских лучей показывают, что в случае комплексов меди молекулы комплексов в твердом состоянии связаны между собой они связаны связью металл— кислород. [22]
Глава II.Экспериментальная часть
2.1. Материалы и аппаратура
В работе использовали раствор хлорида меди (10-2моль/л), приготовленный по точной навеске CuCl2. Для этого 0,269 г растворили в 200 мл дистиллированной воды [13]. Стандартизацию раствора соли меди проводили йодометрическим методом. Раствор CuCl (10-2моль/л) готовили по точной навеске. Фотометрируемые растворы с концентрацией 10-4 моль/л получали разбавлением исходных растворов непосредственно перед измерением оптической плотности. 10-4 моль/л раствор диметилглиоксима (ДМГ) приготовляли по точной навеске реагента. Раствор аскорбиновой кислоты (АК) 10-2 моль/л, был приготовлен разбавлением водой исходной лекарственной формы - раствора для инъекций.
В работе применяли буферные растворы в интервале pH от 2 до 8, составленные из смеси CH3COOH и NH4OH.
Оптические плотности растворов реагента и его комплексов с медью и аскорбиновой кислотой снимали на спектрофотометре ПЭ-5400В с применением кюветы 1 см.
2.2. Исследование условий реакций комплексообразования меди (II) с аскорбиновой кислотой в присутствии диметилглиоксима
2.2.1.Влияние рН на процесс комплексообразования системы
В данной работе было проведено исследование системы, состоящей из меди-диметилглиоксима-аскорбиновой кислоты. В растворе, содержащем медь и диметилгоиоксим на фоне ацетатно-аммонийного буферного раствора не происходит образование окрашенного соединения. Добавление аскорбиновой кислоты ведет к появлению зеленой окраски.
Как известно из литературных данных, комплекс меди с диметилглиоксимом образуется в кислых растворах на фоне соляной кислоты (2н), при этом получается двухкомпонентное соединение красного цвета. Поэтому были проведены исследования влияния аскорбиновой кислоты на этот комплекс в присутствии соляной кислоты. Спектр поглощения раствора, содержащего медь и диметилглиоксим, представлен на рисунке 1.
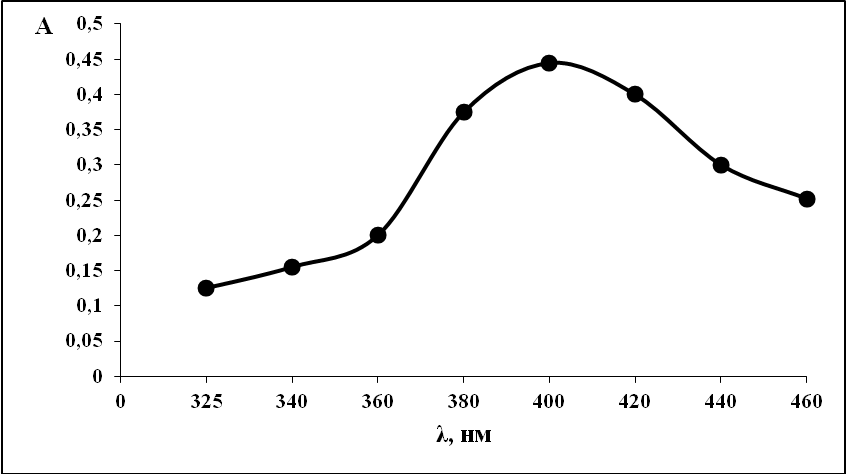
Рис. 1. Спектр поглощения: медь-диметилглиоксим.
С (Cu2+) =10-4 моль/л, С (ДМГ) = 10-4 моль/л, С (НСl)=2н, l=1 см, спектрофотометр ПЭ-5400В.
Добавление аскорбиновой кислоты к системе медь-диметилглиоксим не ведет к значительному увеличению оптической плотности на фоне соляной кислоты. Максимальное поглощение наблюдается при той же длине волны (рис. 2).
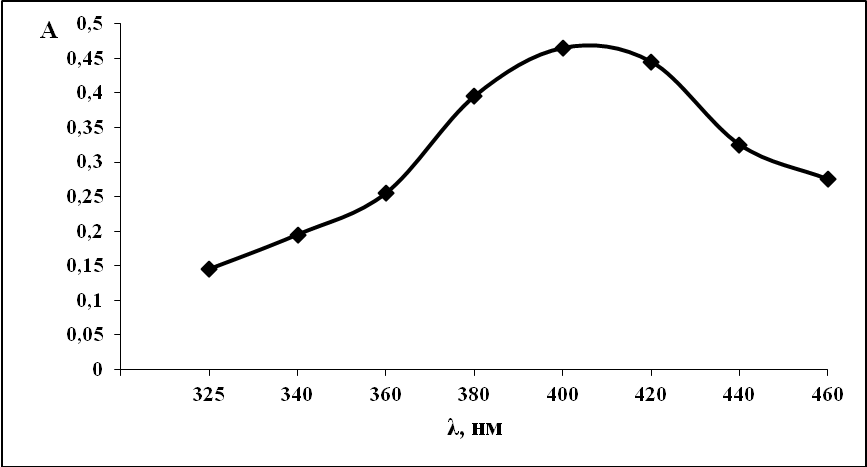
Рис. 2. Спектр поглощения медь-диметилглиоксим-аскорбиновая кислота.
С (Cu2+) =10-4 моль/л, С (ДМГ) = 10-4 моль/л, С (АК)=10-4 НСl=2н, l=1 см, спектрофотометр ПЭ-5400В.
Дальнейшие исследования процесса комплексообразования медь-диметилглиоксим – аскорбиновая кислота проводили на фоне ацетатно-аммиачных буферных растворов.
При исследовании порядка сливания растворов реактивов было установлено, что порядок сливания растворов на значение оптической плотности не влияет. Но все же, на протяжении всей работы соблюдался следующий порядок сливания: диметилглиоксим–буферный раствор–медь–аскорбиновая кислота.
Растворы аскорбиновой кислоты и диметилглиоксима бесцветны, раствор соли меди при фотометрируемой концентрации имеет слабо-голубое окрашивание, близкое к бесцветному, а раствор, содержащий медь, диметилглиоксим и аскорбиновую кислоту окрашен в разные цвета, в зависимости от рН раствора.
В кислой среде (рН=2-5) трехкомпонентная система бесцветна, а при рН=6-8 появляется зеленое окрашивание. При рН=9-10 наблюдали со временем появление желтого окрашивания. В щелочной среде не происходило значительного увеличения оптической плотности. Зависимость оптической плотности от рН показана на рис. 3.
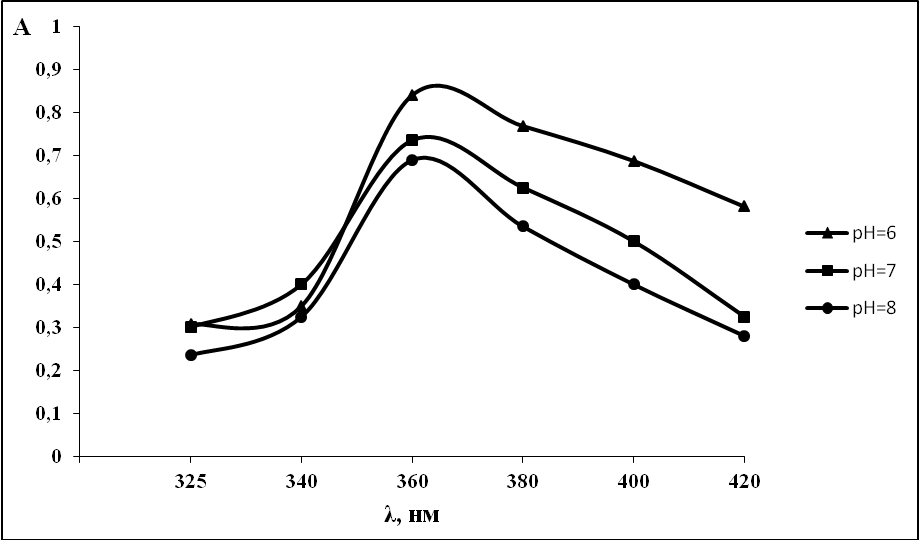
Рис. 3. Влияние рН на светопоглощение в растворе, содержащим медь-диметилглиоксим-аскорбиновая кислота.
С (Cu2+) =10-4 моль/л, С (ДМГ) = 10-4 моль/л, С (АК) =10-4 моль/л ,
l=1 см., спектрофотометр ПЭ-5400В.
Таким образом, нами установлено, что оптимальной средой для образования трехкомпонентного соединения медь-диметилглиоксим-аскорбиновая кислота является рН=6, так как светопоглощение при этой кислотности происходит максимальное.
2.2.2. Исследование влияние аскорбиновой кислоты на комплексообразования меди с диметилглиоксимом
Раствор двухкомпонентной системы медь-диметилглиоксим поглощает при длине волны 340 нм. При добавлении аскорбиновой кислоты к двухкомпонентной системе наблюдается увеличение интенсивности окраски и смещение максимума поглощения на 20 нм.
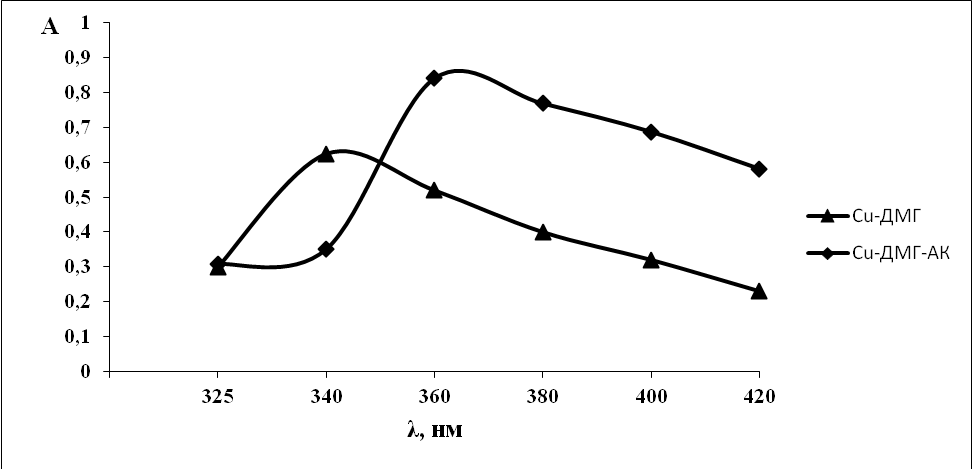
Рис. 4. Спектры поглощения: Сu-ДМГ, Сu-ДМГ-АК.
С(Сu2+) = 10-4 моль/л, С(ДМГ) =10-4 моль/л, С(АК) = 10-4 моль/л ,
l=1 см., спектрофотометр ПЭ-5400В.
Изменение оптических характеристик при добавлении аскорбиновой кислоты может указывать на образование комплексного соединения в системе медь-диметилглиоксим-аскорбиновая кислота.
Дата: 2016-10-02, просмотров: 525.