Молекула гемоглобина может находиться в двух формах — напряженной и расслабленной. Расслабленная форма гемоглобина имеет свойство насыщаться кислородом в 70 раз быстрее, чем напряженная. Изменение фракций напряженной и расслабленной формы в общем количестве гемоглобина в крови обусловливает S-образный вид кривой диссоциации оксигемоглобина, а следовательно, так называемое сродство гемоглобина к кислороду. Если вероятность перехода от напряженной формы гемоглобина к расслабленной больше, то возрастает сродство гемоглобина к кислороду, и наоборот. Вероятность образования указанных фракций гемоглобина изменяется в большую или меньшую сторону под влиянием нескольких факторов.
Основной фактор — это связывание кислорода с геминовой фуппой молекулы гемоглобина. При этом чем больше геминовых фупп гемоглобина связывают кислород в эритроцитах, тем более легким становится переход молекулы гемоглобина к расслабленной форме и тем выше их сродство к кислороду. Поэтому при низком Р02, что имеет место в метаболически активных тканях, сродство гемоглобина к кислороду ниже, а при высоком Р02 — выше. Как только гемоглобин захватывает кислород, повышается его сродство к кислороду и молекула гемоглобина становится насыщенной при связывании с четырьмя молекулами кислорода
Эффект рН и температуры на сродство гемоглобина к кислороду. Молекулы гемоглобина способны реагировать с ионами водорода, в результате этой реакции происходит снижение сродства гемоглобина к кислороду. При насыщении гемоглобина менее 100 % низкое рН понижает связывание кислорода с гемоглобином — кривая диссоциации оксигемоглобина смещается вправо по оси х. Это изменение свойства гемоглобина под влиянием ионов водорода называется эффектом Бора. Метаболически активные ткани продуцируют кислоты, такую как молочная, и С02. Если рН плазмы крови снижается от 7,4 в норме до 7,2, что имеет место при сокращении мыщц, то концентрация кислорода в ней будет возрастать вследствие эффекта Бора. Например, при постоянном рН 7,4 кровь отдавала бы порядка 45 % кислорода, т. е. насыщение гемоглобина кислородом снижалось до 55 %. Однако когда рН снижается до 7,2, кривая диссоциации смещается по оси х вправо. В результате насыщение гемоглобина кислородом падает до 40 %, т. е. кровь может отдавать в тканях до 60 % кислорода, что на 1/з больше, чем при постоянном рН.
Эффект 2,3-дифосфоглицерата (2,3-ДФГ) на сродство гемоглобина к кислороду. При некоторых физиологических состояниях, например при понижении Р02 в крови ниже нормы (гипоксия) в результате пребывания человека на большой высоте над уровнем моря, снабжение тканей кислородом становится недостаточным. При гипоксии может понижаться сродство гемоглобина к кислороду вследствие увеличения содержания в эритроцитах 2,3-ДФГ. В отличие от эффекта Бора, уменьшение сродства гемоглобина к кислороду под влиянием 2,3-ДФГ не является обратимым в капиллярах легких. Однако при движении крови через капилляры легких эффект 2,3-ДФГ на снижение образования оксигемоглобина в эритроцитах (плоская часть кривой диссоциации оксигемоглобина) выражен в меньшей степени, чем отдача кислорода под влиянием 2,3-ДФГ в тканях (наклонная часть кривой), что обусловливает нормальное кислородное снабжение тканей.
Вопрос 49.
 Большую роль печень играет в обмене углеводов. Глюкоза, приносимая из кишечника по воротной вене, в печени превращается в гликоген. Благодаря высоким запасам гликогена печень служит основным углеводным депо организма. Гликогенная функция печени обеспечивается действием ряда ферментов и регулируется центральной нервной системой и 1 гормонами — адреналином, инсулином, глюкагоном. В случае повышенной потребности организма в сахаре, например, во время усиленной мышечной работы или при голодании гликоген под действием фермента фосфорилазы превращается в глюкозу и поступает в кровь. Таким образом, печень регулирует постоянство глюкозы в крови и нормальное обеспечение ею органов и тканей.
Большую роль печень играет в обмене углеводов. Глюкоза, приносимая из кишечника по воротной вене, в печени превращается в гликоген. Благодаря высоким запасам гликогена печень служит основным углеводным депо организма. Гликогенная функция печени обеспечивается действием ряда ферментов и регулируется центральной нервной системой и 1 гормонами — адреналином, инсулином, глюкагоном. В случае повышенной потребности организма в сахаре, например, во время усиленной мышечной работы или при голодании гликоген под действием фермента фосфорилазы превращается в глюкозу и поступает в кровь. Таким образом, печень регулирует постоянство глюкозы в крови и нормальное обеспечение ею органов и тканей.
Фруктоза включается в путь распада глюкозы на стадии триозофосфатов (см. рис. 9.32, а). С наследственной недостаточностью фруктозо- 1-фосфатальдола-зы (фермент 2 на схеме) связана врожденная непереносимость фруктозы. В этом случае при наличии в пище фруктозы в тканях накапливается фруктозо-1-фосфат (вследствие блока реакции 2), который ингибирует альдолазу фруктозо-1,6-бис-фосфата — фермент гликолиза и глюконеогенеза.
В результате нарушается и распад, и синтез глюкозы. Кроме того, фруктозо-1-фосфат ингибирует фосфорилазу гликогена. Эти причины приводят к появлению гипоглюкоземии после приема пищи, содержащей фруктозу. Болезнь обычно обнаруживается после перехода с грудного кормления на пищу, содержащую сахарозу, и проявляется приступами рвоты и судорог после еды. При устранении фруктозы из рациона дети развиваются нормально.Известно также наследственное нарушение обмена фруктоземия, вызываемое недостаточностью фруктокиназы. Поступающая в организм фруктоза не подвергается никаким изменениям, обнаруживается в крови и выводится с мочой. Каких-либо других симптомов при фруктоземии не наблюдали.
Включается в метаболизм путем превращения в глюкозо-1-фосфат.
На рис. 9.32, б"представлены пути превращений галактозы. Реакция, катализируемая УДФ-глюкозо-4-эпимеразой обратима, и используется как для синтеза УДФ-галактозы (и затем лактозы), так и для катаболизма галактозы. Лактоза синтезируется только в молочной железе женщин и только в период лактации.
Вопрос 50.
В печени происходит важнейшее превращение жирных кислот, из которых синтезируются жиры, свойственные для данного вида животного. Под действием фермента липазы жиры расщепляются на жирные кислоты и глицерин. Дальнейшая судьба глицерина похожа на судьбу глюкозы. Его превращение начинается с участием АТФ и заканчивается распадом до молочной кислоты с последующим окислением до углекислого газа и воды. Иногда при необходимости печень может синтезировать гликоген из молочной кислоты.
основным местом образования плазменных пре-β-липопротеинов (липопротеины очень низкой плотности – ЛПОНП) и α-липопротеинов (липопротеины высокой плотности – ЛПВП) является печень.
Рассмотрим образование ЛПОНП. Согласно данным литературы, основной белок апопротеин В-100 (апо Б-100) липопротеинов синтезируется в рибосомах шероховатого эндоплазматического ретикулума гепатоцитов. В гладком эндоплазматическом ретикулуме, где синтезируются и липидные компоненты, происходит сборка ЛПОНП. Одним из основных стимулов образования ЛПОНП является повышение концентрации неэстерифици-рованных жирных кислот (НЭЖК). Последние либо поступают в печень с током крови, будучи связанными с альбумином, либо синтезируются непосредственно в печени. НЭЖК служат главным источником образования триглицеридов (ТГ). Информация о наличии НЭЖК и ТГ передается на мембранно-связанные рибосомы шероховатого эндоплазматического ретикулума, что в свою очередь является сигналом для синтеза белка (апо В-100). Синтезированный белок внедряется в мембрану шероховатого ретикулума, и после взаимодействия с фосфолипидным бислоем от мембраны отделяется участок, состоящий из фосфолипидов (ФЛ) и белка, который и является предшественником ЛП-частицы. Далее белокфосфо-липидный комплекс поступает в гладкий эндоплазматический ретикулум, где взаимодействует с ТГ и эстерифицированным холестерином (ЭХС), в результате чего после соответствующих структурных перестроек формируются насцентные, т.е. незавершенные, частицы (н-ЛПОНП). Последние поступают через тубулярную сеть аппарата Гольджи в секреторные везикулы и в их составе доставляются к поверхности клетки, после чего очень низкой плотности (ЛПОНП) в печеночной клетке.
Вопрос 51.
Рассмотрим роль печени в обмене стероидов, в частности холестерина. Часть холестерина поступает в организм с пищей, но значительно большее количество его синтезируется в печени из ацетил-КоА. Биосинтез холестерина в печени подавляется экзогенным холестерином, т.е. получаемым с пищей.
Таким образом, биосинтез холестерина в печени регулируется по принципу отрицательной обратной связи. Чем больше холестерина поступает с пищей, тем меньше его синтезируется в печени, и наоборот. Принято считать, что действие экзогенного холестерина на биосинтез его в печени связано с торможением β-гидрокси-β-метилглутарил-КоА-редуктазной реакции:

Часть синтезированного в печени холестерина выделяется из организма вместе с желчью, другая часть превращается в желчные кислоты и используется в других органах для синтеза стероидных гормонов и иных соединений.
В печени холестерин может взаимодействовать с жирными кислотами (в виде ацил-КоА) с образованием эфиров холестерина. Синтезированные в печени эфиры холестерина поступают в кровь, в которой содержится также определенное количество свободного холестерина.
Метаболизм билирубина представлен на рисунке.
• Высвобождение гема. Более 80% гема образуется в результате разрушения эритроцитов и около 20% — миоглобина и цитохромов.
• Протопорфирин -> биливердин. Трансформация протопорфирина гема в биливердин происходит под влиянием микросомальных оксидаз гепатоцитов.
• Биливердин -> билирубин. Окисление биливердина (катализируемое цито-зольной биливердинредуктазой) с образованием непрямого билирубина. Непрямой билирубин, циркулирующий в крови, связан с альбуминами и поэтому не фильтруется в почках и отсутствует в моче.
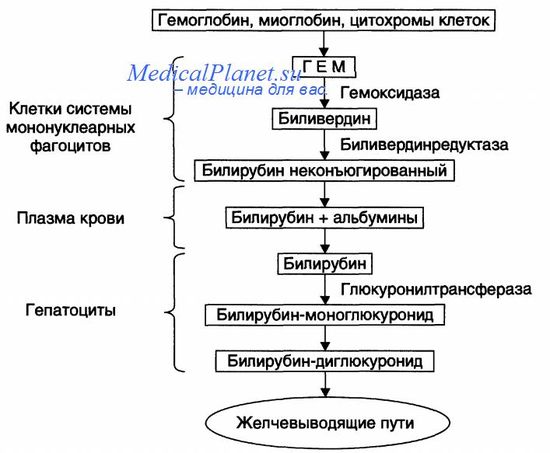
Основные этапы метаболизма билирубина
• Диссоциация комплекса «неконъюгированный билирубин—альбумин» и транспорт билирубина в гепатоциты. В их цитозоле билирубин образует комплекс с белками и глутатион-8-трансферазами.
• Диглюкуронизация билирубина в гепатоцитах с образованием растворимого в воде конъюгированного билирубина. Прямой билирубин не связан с альбумином. В связи с этим он активно («прямо») взаимодействует с диазореактивом Эрлиха, выявляющим этот пигмент.
• Экскреция конъюгированного билирубина в желчевыводящие пути.
• Трансформация конъюгированного билирубина:
+ в уробилиноген (в верхнем отделе тонкой кишки), всасывающийся в тонкой кишке и попадающий по системе воротной вены в печень, где разрушается в гепатоцитах.
+ в стеркобилиноген (в основном в толстой кишке).
- Часть стеркобилиногена всасывается в нижнем отделе толстой кишки и с кровью геморроидальных вен попадает в общий кровоток. Стеркобилиноген хорошо растворим в воде, не связан с белками и поэтому фильтруется в почках в мочу (придавая ей в норме соломенно-жёлтый цвет).
- Другая часть стеркобилиногена выделяется с экскрементами, окрашивая их.
Вопрос 54.
У большинства людей в течение жизни бывают нарушения пигментации. К счастью, в основном они доброкачественные, ограничены и обратимы. Например, наиболее часто нарушения пигментации встречаются при разрешении воспалительных дерматозов в виде гипер- или гипопигментации и существуют в течение нескольких месяцев.
2 основных типа нарушения пигментации.
Лейкодерма и меланодерма. При лейкодермеотмечаются более светлые участки по сравнению с нормальной кожей, при меланодерме— более темные. Кроме того, нарушения пигментации подразделяются с учетом механизма их образования — повреждения меланоцитов или изменения содержания пигмента в коже.
Желтуха (болезнь Госпела) (лат. icterus) — желтушное окрашивание кожи и видимых слизистых оболочек, обусловленное повышенным содержанием в крови и тканях билирубина.
Классификация желтух
В зависимости от вида нарушений метаболизма билирубина и причин гипербилирубинемии можно выделить три типа желтух: желтуху гемолитическую (надпеченочную), желтуху паренхиматозную (печёночную) и желтуху механическую (подпечёночную).
- Надпечёночные желтухи — возникают в связи с усилением процесса образования билирубина. При этом повышается его непрямая (неконъюгированная) фракция.
- Печёночные желтухи. Развитие печеночных желтух связано с нарушением потребления (захвата) билирубина гепатоцитами. При этом повышается непрямая (неконъюгированная) фракция билирубина.
- Подпечёночные желтухи — возникают при нарушении оттока желчи по внепеченочным желчным протокам (обтурационная желтуха).
Клиника желтух
Желтуха — симптомокомплекс, представляющий собой окрашивание в жёлтый цвет кожи, склер, слизистых оболочек. Интенсивность окрашивания может быть совершенно разной — от бледно-жёлтого цвета до шафраново-оранжевого. Умеренно выраженная желтуха без изменения цвета мочи характерна для неконъюгированной гипербилирубинемии (при гемолизе или синдроме Жильбера). Более выраженная желтуха или желтуха с изменением цвета мочи свидетельствует о гепатобилиарной патологии. Моча у пациентов с желтухами приобретает тёмный цвет вследствие гипербилирубинемии. Иногда изменение окраски мочи предшествует возникновению желтухи.
Лабораторные тесты
Ни один тест не может отдифференцировать каждый из вариантов желтухи, но есть общие комбинации печеночных тестов, которые помогают определить локализацию.
| Надпеченочная желтуха | Печеночная желтуха | Подпеченочная желтуха | |
| Общий билирубин | Норма / Увеличен | Увеличен | Увеличен |
| Неконьюгированный билирубин | Увеличен | Норма / Увеличен | Норма |
| Коньюгированный билирубин | Норма | Увеличен | Увеличен |
| Уробилиноген | Увеличен | Норма / Увеличен | Снижен / Отрицательный |
| Цвет мочи | Норма | Тёмный | Тёмный |
| Цвет стула | Норма | Обесцвеченный | Обесцвеченный |
| Щелочная фосфатаза | Норма | Норма | Увеличен |
| АЛТ и АСТ | Норма | Увеличен | Норма |
Вопрос 55.
Детоксикационная функция печени состоит в обезвреживании в результате происходящих в печени процессов биосинтеза ядовитых для человеческого организма веществ. Иногда они становятся безвредными или даже нейтральными органическими соединениями, чаще всего – белковыми
Как осуществляется обезвреживающая функция печени
1. путем включения токсических веществ в синтез безвредных для организма соединений (например, аммиак — в мочевину или нуклеиновые кислоты),
2. окислительными процессами (дегидрирование этанола под действием алкогольдегидрогеназы);
3. восстановительными процессами (нитросоединения превращаются в аминосоединения);
4. путем гидролиза (лекарственные вещества);
5. путем конъюгации с различными обезвреживающими веществами:
глюкуроновой кислотой;
серной кислотой;
глицином;
таурином;
цистеином;
уксусной кислотой;
6. путем метилирования (производные пурина).
Микросомальное окисление
Микросомальные оксидазы - ферменты, локализованные в мембранах гладкого ЭР, функционирующие в комплексе с двумя внемитохондриальными ЦПЭ. Ферменты, катализирующие восстановление одного атома молекулы О2 с образованием воды и включение другого атома кислорода в окисляемое вещество, получили название микросомальных оксидаз со смешанной функцией или микросомальных монооксигеназ. Окисление с участием монооксигеназ обычно изучают, используя препараты микросом.
Реакции конъюгации составляют вторую фазу метаболизма жирорастворимых ксенобиотиков, которые в первой фазе гидроксилировались или получили иные нуклеофильные группы при помощи микросомных монооксигеназ. Химические же соединения, которые уже имеют в своем составе реакционноспособные группы (ОН, СООН, NH2, SH), сразу вступают в реакции конъюгации без предварительных превращений с участием оксидаз со смешанными функциями. У млекопитающих наиболее распространены следующие реакции конъюгации: глюкуронидная, сульфатная, с глутатионом, с глутамином, с аминокислотами, метилирование, ацетилирование, гликозидирование. При этом чаще всего и не только у млекопитающих встречается конъюгация с глюкуроновой кислотой.
Дата: 2016-10-02, просмотров: 329.