Эквивалент соли AL2(SO4)3 равен : 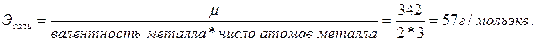
Масса 1л раствора равна mр-ра=ρр-ра·Vр-ра ; m р-ра = 1,105 · 1000 = 1105г/л.
Составим пропорцию:
ω=10% это значит, в 100 г раствора содержится 10 г растворенного вещества AL2(SO4)3 ,
в 1105 г/л раствора содержится Х г растворенного вещества
Х = (1105 . 10)/100 = 110,5г/л. (масса растворенного вещества в литре раствора)
µ(AL2(SO4)3) = 342 г/моль.
Сэ = Х/Э = 110,5г/л /57г/мольэкв = 1,92 г-экв/л
Пример: Определите осмотическое давление водного раствора глюкозы (массовая доля С6Н12О6 2,5%) при 270 С. Плотность раствора 1000 кг/м3.
Решение:
Осмотическое давление находим по формуле: П = i *С * R *Т, где
П – осмотическое давление, Па; i - изотонический коэффициент, определяемый по формуле i = 1+(n – 1)* a, в которой n – число ионов, на которые распадается электролит.
Например АlCl3 Û Аl3+ + 3Cl-, n = 4.
a - степень электролитической диссоциации. Глюкоза – неэлектролит, a= 0, i = 1.
С – молярная концентрация, кмоль/м3.
Определим массу раствора по формуле 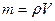 = 1000кг/м3 * 1м3=1000кг.
= 1000кг/м3 * 1м3=1000кг.
Составим пропорцию
В 100 кг раствора – 2,5 кг глюкозы
В 1000 кг раствора – х кг глюкозы
х кг = 1000кг * 2,5 кг/100 кг = 25 кг/м3 (25 кг глюкозы в одном кубическом метре)
Молярная масса глюкозы 180 кг/кмоль 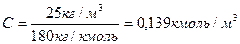
П = 0,139 кмоль/м3 * 8,314 * 103 Дж/кмольК * 300 К= 0,35 МПа.
Пример: Определите давление пара раствора, содержащего 5 г камфары С10Н16О в 200 г ацетона С3Н6О, при 200 С, если давление пара чистого ацетона при этой температуре 23940 Па.
Решение:
Расчет производим по формуле закона Рауля: РА = РА0 * NА, где РА0 – давление пара чистого растворителя, равное 23940 Па, nA – количество молей растворителя, моль. Молярная масса ацетона 58 г/моль, значит, 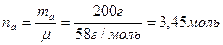
nВ – количество молей растворенного вещества, моль. Молярная масса растворенного вещества (камфары) 152 г/моль, значит, 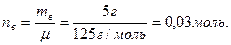
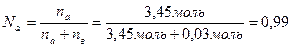
РА – давление пара раствора, Па.
РА= 23940 Па * 0,99 = 23700 Па = 23,7 кПа.
Пример: Определите температуры замерзания и кипения водного раствора NаСl (массовая доля хлорида натрия 2%), если степень диссоциации равна 1.
Решение:
Расчет производим по общей формуле:
DТ = i*Е*m * 1000/G*М, где i – изотонический коэффициент находим по формуле: i = 1+(n – 1)a, в которой n – число ионов, на которое распадается электролит.
NaClÛNa+ + Cl-, поэтому n = 2.
a - степень электролитической диссоциации, a= 1.
i = 1 + (2-1)* 1 =2
Е – постоянная, называемая эбулиоскопической (Ек) для процесса кипения и криоскопической (Ез) для замерзания. Если растворитель – вода, то Ек = 0,250 С, Ез = 1,860С.
m – масса растворенного вещества, m = 2кг;
М – молярная масса растворенного вещества, для хлорида натрия равна 58,5 г/моль = 58,5 кг/ кмоль.
G – масса растворителя, G = 100 - 2=98 г.
DТ – изменение температуры.
Определим моляльную концентрацию раствора.
2% это в 100кг раствора содержится
98кг растворителя и 2 кг растворенного вещества, а в
1000кг растворителя – х кг в-ва.
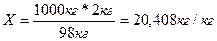 .
.
Моляльная концентрация С= 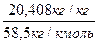 =0,349 кмоль/кг
=0,349 кмоль/кг
DТк = 2* 0,52 * 0,349 = 0,360К= 0,360С. Следовательно, температура кипения водного раствора хлорида натрия равна tк = 1000С + 0,360С = 100,360 С
DТз = 2 * 1,86 * 0,349 = 1,30С. Следовательно температура замерзания водного раствора хлорида натрия равна
tз = 00С – 1,30С = -1,30 С.
Пример: Рассчитать при 300 С общее давление пара над смесью состава 30% бензола и 70% толуола (%, масс) смесь считать идеальной. Давление пара чистого бензола при этой температуре 15760 Па, толуола – 4890 Па.
Решение:
Согласно процентному составу, в 100 гр жидкой смеси 30 г бензола С6Н6 и 70 г толуола С7Н8.
Определяем количество вещества каждого компонента и его молярную долю.
Молярная масса бензола – 78 г/моль, толуола – 92 г/моль.
nб = 30/78 = 0,38 моль, nт = 70/92 = 0,76 моль.
Nб = 0,38/(0,38+0,76) = 0,33
Nт = 0,76/(0,38 +0,76) = 0,67
По закону Рауля находим парциальные давления бензола и толуола в парах:
Рб = Nб * Рб0 = 0,33 * 15760 = 5200 Па = 5,2 кПа.
Рт = Nт * Рт0 = 0,67 * 4890 = 3276 Па = 3,276 кПа.
Общее давление пара Робщ = Рб + Рт = 8,476 кПа.
Пример: При 800С давление пара над бензолом равно 106Па, а над метилбензолом 4·104 Па. Найдите молярную долю метилбензола в паре, над жидкой смесью бензола и метилбензола, при 800С при условии, что молярная доля метилбензола в жидкой смеси равна 0,60.
Решение: Молярная (мольная) доля бензола в жидкой смеси составляет
NжБ = 1 - NжМ = 1 – 0,60 = 0,40
Давление насыщенного пара над раствором Р равно сумме парциальных давлений
РБензол и РМетилбензол: Р = РБ + РМ.
По закону Рауля РБ = Р0Б · NЖБ и PМ = P0М · NЖМ
Соотношение между составом пара и жидкости системе может быть выражено через давление насыщенных паров чистых компонентов и общее давление Робщ.
Парциальное давление, согласно закону Дальтона: РБ=Робщ· NГБ ; РМ=Робщ · NГМ ,
Приравняем левые части парциального давления бензола и метилбензола и получим закон Рауля – Дальтона: Р0Б · NЖБ = Pобщ · NГБ ; Р0М NЖМ = Pобщ · NГМ,
тогда 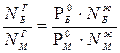 . Молярная доля бензола в паре равна NГБ = 1 – NГМ , следовательно
. Молярная доля бензола в паре равна NГБ = 1 – NГМ , следовательно 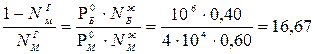 отсюда
отсюда
1 – NГМ = 16,67· NГМ
молярная доля метилбензола в паре, равновесном с жидкой смесью бензола и метилбензола составляет NГМ = 1 / 17,67 = 0,057.
Пример: Азеотропная смесь с минимумом температуры кипения имеет состав 59% пиридина и 41% воды. Как перегоняются 40% и 80% растворы пиридина?
Решение:
Так как смесь обладает минимумом температуры кипения, то сначала преимущественно отгоняется азеотропная смесь, т.е. 59% пиридина и 41% воды. Если перегонке подвергается 40% раствор с содержанием воды 60%, то в нем в избытке по сравнению с азеотропом-вода (60%>41%), она и накопится в остатке. Если перегонке подвергается 80-й раствор с избытком пиридина по сравнению с азеотропом (80%>59%), то в остатке будет накапливаться чистый 100% пиридин.
Если бы смесь обладала максимумом температуры кипения, то вначале в первом случае отгоняется вода, во втором –пиридин, а затем в обоих случаях - азеотропная смесь.
Экстракция из растворов
Экстракцию из растворов применяют для разделения близко кипящих жидкостей; жидкостей с малой летучестью паров и высокой температурой кипения; веществ, разлагающихся при нагревании, т.е. в тех случаях, когда разделение перегонкой невозможно.
Извлечение какого-либо вещества из смеси соответствующим растворителем называется экстракцией.
Пусть g0 – масса растворенного вещества (г), в исходном растворе;
V0 – объем раствора (мл); V- Объем растворителя (вещества, при помощи которого производится экстрагирование); n - число экстрагирований; g1, g2, .. gn – масса растворенного вещества, оставшееся в первоначальном растворе после 1-го. 2-го….n-го экстрагирования.
.
После первого экстрагирования в исходном растворе остается g1(г) растворенного вещества 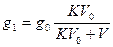 (грамм)
(грамм)
После второго экстрагирования 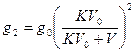
после n –го экстрагирования в исходном растворе останется gn количество растворенного вещества: 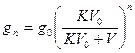 (грамм)
(грамм)
Пример: В 1 л. водного раствора содержится 10 г. иода. Какова степень извлечения иода из данного раствора 100 мл. четыреххлористого углерода: а) при однократном извлечении всем объемом растворителя; б) при четырехкратном извлечении порциями по 25 мл? Коэффициент распределения иода между водой и четыреххлористым углеродом 0,0117.
Решение:
Используем формулу:
gn = go [KV0/ (KV0 + V]n, где gn – масса вещества (иода), оставшегося в растворе после «n» экстракции, в г.
gо – масса вещества (иода) в исходном растворе, г.
V0 – объем раствора, мл.
V – объем растворителя, которым обрабатывался раствор при экстрагировании, мл.
После однократного извлечения осталось иода:
g1 = gо (KV0/ KV0+ V) = 10*(0,017*1000 / 0,0117*1000+100) = 1,047 г.
После четырехкратного извлечения осталось иода:
g4= gо(KV0/ KV0 + V)4 = 10*(0,0117*1000 /0,0117*1000+25)4 =0,1033г.
Эффективность четырехкратной экстракции примерно в 10 раз (1,047/0,1033) больше.
Пример:Коэффициент растворимости диоксида углерода в воде при 00С равен 1,713. Какой объем СО2 растворится в 10 м3 воды при давлении 3 МПа? (t = const).
Решение:
Коэффициент растворимости – объем газа, растворившегося в I объеме растворителя при нормальном давлении (Ро = 101325 Па). Следовательно, в 10 м3 воды при нормальном давлении растворится 17,13 м3 СО2. При давлении 3 МПа в 10 м3 воды растворителя
17,13*3*106/101325 = 506 м3 СО2.
Пример: Найти концентрацию эфирного раствора янтарной кислоты, находящегося в равновесии с водным раствором, содержащим 0, 24г кислоты в 100 мл, если при 150 С .водный раствор янтарной кислоты, содержащий 0,7 г кислоты в 100мл, находится в равновесии с эфирным раствором, содержащим 0,13 г кислоты в 100 мл.
Решение. Найдем коэффициент распределения янтарной кислоты между водой и эфиром: 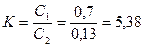
Вычислим концентрацию эфирного раствора янтарной кислоты, находящегося в равновесии с водным раствором, содержащим 0,23 г в 100 мл, из соотношения:
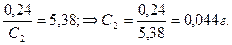 в 100 мл.
в 100 мл.
Пример: 1 л водного раствора содержит 0,3 г йода. Определить, какое количество йода останется в водном растворе, если: 1) экстракцию производить однократно 50 мл амилового спирта и 2) экстракцию производить пятикратно порциями по 10 мл амилового спирта. Коэффициент распределения йода между водой и амиловым спиртом равен 0,0043.
Решение. 1 л = 1000мл.
Определим, сколько останется йода после однократной экстракции 50 мл амилового спирта в воде по формуле: 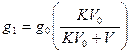
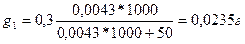
Что составляет 7,8%от первоначального его количества.
Определим, сколько останется иода после пятикратного извлечения порциями по 10 мл амилового спирта в воде по формуле:
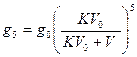
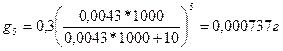
это составляет около 0,25% от первоначального количества, т.е. в 31 раз меньше, чем в первом случае.
Пример: 1л амилового спирта содержит 10г йода. Определить, какое количество йода будет содержаться в воде, если 0,5 л амилового спирта, содержащего йод, взболтать с 2 л воды. Коэффициент распределения между амиловым спиртом и водой при 250С равен 230.
Решение: По формуле 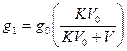 определяем количество граммов йода в 0,5 л амилового спирта после взбалтывания с 2 л воды:
определяем количество граммов йода в 0,5 л амилового спирта после взбалтывания с 2 л воды: 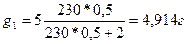
Количество йода в 2 л воды равно: g = 5 – 4,914 = 0,086 г
Тема 1.6. Электрохимия
Пример: Какие процессы протекают на электродах при электролизе раствора сульфата кальция? Какие вещества и в каком количестве выделяются на электродах при прохождении через раствор тока 3,6 А в течении 42 минут?
Решение:
При электролизе раствора СаSO4 в растворе присутствуют ионы:
Са2+; SO42-; Н+; ОН-.
На катоде происходит восстановление в порядке, обратном ряду напряжений, следовательно, восстанавливается водород по уравнению:
2Н+ + 2е ® Н2
При электролизе без кислородных кислот и их солей (например, НJ, NaJ) на аноде окисляется кислотный остаток (например, 2J – 2е- = J2), при электролизе высших кислородосодержащих кислот – гидроксид-ион.
4ОН- - 4е- ® 2Н2О + О2
Расчет массы выделившегося вещества ведем по формуле:
m =Э/96500Jt, где
m-масса вещества, г;
Э -химический эквивалент вещества, г;
Э = А/n, где А – атомная масса, n- валентность элемента; J – сила тока, А;
t- время электролиза, с.
Н2 = 2/2/96500*3,6*42*60 = 0,09 г.
О2 = 32/4*3,6*42*60/96500 = 0,75 г.
Пример: Удельная электропроводность водного раствора CaCl2 (массовая доля хлорида кальция 10%) при 250С равна х = 11,4*10-2 ом-1см-1. Плотность раствора 1080 кг/м3. Определить кажущуюся степень электролитической диссоциации СаCl2 в растворе.
Решение:
Рассчитываем эквивалентную молярную концентрацию 10-% раствора СаСl2. Масса раствора объемом 1 л. 1080 г. В нем 1080*10/100=108 г СаСl2. Эквивалент СаСl2
40+71/2 = 55,5г.,
так как степень окисления кальция равна 2.
Эквивалентная молярная концентрация:
Сeq = 108/55 = 1,96 г-экв/л
Эквивалентную электропроводность находим по формуле:
l v = х*1000/Сeq = 11,4*10-2*1000/1,96 = 58,16 ом-1 см2 г-экв-1.
Значение эквивалентной электропроводности при бесконечном разбавлении l¥ находим как сумму подвижностей ионов по таблице приложения.
l¥ = l1/2 cd2 + la- = 59,5 + 76,4 = 135,9 ом-1см2 г-экв-1.
Степень диссоциации определяем по формуле:
a = l v|l¥ = 58,16/135,9 = 0,43.
Пример №3
Вычислить при 180С величину диффузионного потенциала на границе двух растворов НСl, из которых один 0,05н.,а второй 0,001н. Эквивалентная электропроводность первого раствора НСl равна
360 ом-1см2, а второго 377 ом-1см2. Подвижность ионов Н+ и Cl- при бесконечном разбавлении соответственно равны 315 ом-1см2 и 66,3 ом-1см2. Определить знак более концентрированного раствора HCl. Учитывая найденную величину диффузионного потенциала, вычислить э.д.с. элемента:
Рt, H2 |0,05н. HCl || 0,001н HCl | H2, Pt.
Решение. Величину диффузионного потенциала вычисляем по уравнению 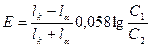 , где С1 и С2 концентрация ионов металла в растворе.
, где С1 и С2 концентрация ионов металла в растворе.
С1 = Сн a1, С2 = Сн a2 . Приняв lk = 315, lа =66,3 ; l∞ = 315 + 66,3 = 381,3
C1 = 0,05*360/381,3= 0,0472, а С2 =0,001*377/381,3 = 0,00099;
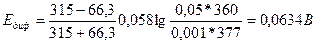
Э.д.с. концентрационного элемента, не принимая во внимание диффузионного потенциала, вычисляется по уравнению:
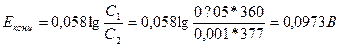
Вследствие того, что диффузионный потенциал направлен против э.д.с. концентрационного гальванического элемента, действительная э.д.с. равна:
Е = Еконц – Едиф = 0,0973 – 0,0634 = 0,0339В.
Так как кислота будет диффундировать из более концентрированного раствора в более разбавленный и первыми проникать в него будут ионы Н+, , подвижность которых значительно больше подвижности ионов Cl-, то концентрированный раствор заряжен отрицательно по отношению к разбавленному раствору.
Дата: 2019-11-01, просмотров: 786.