Зная объемную долю можно определить парциальный объем 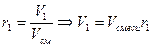
Закон Дальтона через долю определяется по уравнению 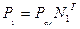 , где Р1- парциальное давление газа.
, где Р1- парциальное давление газа.
Например, для кислорода и водорода парциальное давление через долю вычисляется:
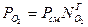
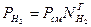
Правило смещения для определения молекулярной массы смеси: μсмеси = μ1 r1 + r2 μ2+ ….
Молярную массу смеси можно определить и через весовую долю: 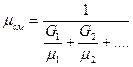
Формула связи весовой и килломольной долей: 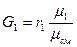
Пример: Определить плотность метана при нормальных условиях и при 3000 С, если давление постоянно.
Решение: Так как по закону Авогадро киломоль любого газа в нормальных условиях занимает объем 22,4 м3, плотность метана составит: 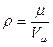
rо = 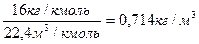 , где 𝝁 = 16,0 кг/кмоль -– молярная масса метана
, где 𝝁 = 16,0 кг/кмоль -– молярная масса метана
Для определения плотности метана при t = 3000 С воспользуемся следствием из закона Гей-Люссака: 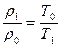 , откуда r1=
, откуда r1= 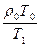
То = 0 + 273 = 273 К; Т1 = 300 + 273 = 573 К. то r1 = 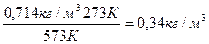
Пример: Определите плотность ацетилена при нормальных условиях, относительную плотность его по воздуху, плотность при 00 С и 1,6 МПа.
Решение:
Так как при нормальных условиях киломоль любого газа занимает объем 22,4 м3, плотность ацетилена
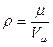 rо =
rо = 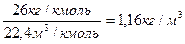 , где 𝝁 = 26 кг/кмоль-– молярная масса ацетилена.
, где 𝝁 = 26 кг/кмоль-– молярная масса ацетилена. 
Учитывая, что молярная масса воздуха 𝝁 - 29 кг/кмоль, а плотность rв = 1,29 кг/м3, относительная плотность ацетилена по воздуху составит:
D= 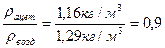
Для определения плотности ацетилена при Р = 1,6 МПа воспользуемся следствием из закона Бойля-Мариотта: r1/rо = Р1/Ро, откуда r1 = rо * Р1/Ро.
Так как Ро = 101325 Па, а Р1 = 1,6 * 106 Па, то r1 = 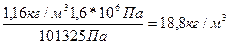
Пример: Определите объем, занимаемый водородом массой 20 кг при температуре минус 1000 С и давлении 19,44 МПа.
Решение:
При указанных параметрах (высоком давлении и низкой температуре) расчет следует вести по уравнению Менделеева - Клапейрона с введением коэффициента сжимаемости Z.
РV = Z *n RT, откуда V = 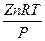
Вначале находим по таблице приложения критические параметры для водорода
Ткр = 33,1 К; Ркр = 1296 кПа.
Затем определяем приведенное давление
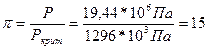
И приведенную температуру
t = 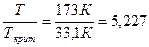
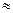 5
5
По таблице коэффициента активности (сжимаемости) реальных газов находим Z для приведенных параметров, как пересечение t и π:
t = 5 и π = 15 Z = 1,237
Так как m = 20 кг Т = 273 – 1000С = 173 К; 𝝁 = 2 кг/кмоль; Р = 19,44 МПа =19,44*106 Па
R = 8,314*103 Дж/кмоль*К
V = 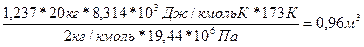
Пример: Сосуд объемом 7 л содержит водорода 0,4г и 3,15г азота при 00С. Определить парциальные давления газов и общее давление газовой смеси.
Решение:
Парциальное давление водорода определим по формуле 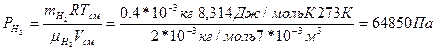
Парциальное давление азота определим по формуле
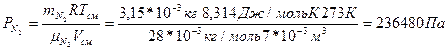
Общее давление газовой смеси вычисляется по закону Дальтона: Робщ = РН2 + РN2
Робщ = 64850 + 36480 = 101330 Па
Пример 5: Атмосферный воздух содержит (в % объемных): N2 -78; О2 -21;
Aч -1,0. Воздух сжат до 15 МПа. Определить: парциальные давления компонентов; среднюю молярную массу воздуха; плотность воздуха.
Решение:
Парциальные давления находим по формуле:
Рпарц = Р общ * N, где N – киломольная или объемная доля газа в смеси.
РN2 = 15МПа * 0,78 = 11,70 МПа
Ро2 = 15МПа * 0,21 = 3,15 МПа
РАч = 15МПа * 0,01 = 0,15 МПа
Среднюю молярную массу находим по правилу смещения:
µ смеси= µ N2 * N N2 + µ О2 * N О2 + µАч * N Ач
µсмеси = 28 * 0,78 + 32*0,21 + 40*0,01 = 21,84 + 6,72 + 0,40 = 28,96 кг/кмоль
Плотность воздуха определяем по формуле: 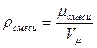 ;
;
r = 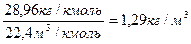
Пример 6: Газовая смесь состоит из 3м3 двуокиси углерода при давлении 95940 Па, 4м3 кислорода при давлении 106600Па, 6м3 азота при давлении 93280 Па. Объем смеси 10 м3. Определить парциальные давления газов в смеси и общее давление смеси (температура постоянна).
Решение.
Парциальные давления каждого из газов вычисляют, пользуясь законом Бойля – Мариотта:
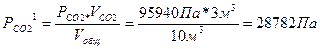
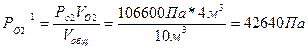
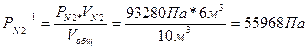
Робщ = 28782 + 42640 + 55968 = 127390Па.
4. Жидкость и ее свойства
Дата: 2019-11-01, просмотров: 633.