1.Закон Рауля для не летучего растворенного вещества
В случае нелетучего растворенного вещества с поверхности раствора испаряются только молекулы растворителя, поэтому давление пара растворителя над раствором всегда ниже, чем над чистым растворителем.
Зависимость понижения давления насыщенного пара от концентрации была установлена французским ученым Раулем.
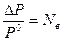 - Относительное понижение давления пара растворителя над раствором равно мольной доле растворенного вещества в растворе – закон Рауля;
- Относительное понижение давления пара растворителя над раствором равно мольной доле растворенного вещества в растворе – закон Рауля;
- Р0- давление пара молекул растворителя над растворителем;
- Р - давление пара молекул растворителя над раствором.
- △Р = Р0- Р – абсолютное понижение давления пара над раствором
- 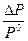 -относительное понижение давление пара над раствором
-относительное понижение давление пара над раствором
- Nв – мольная доля растворенного вещества в растворе 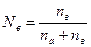 .
.
Если раствором является электролит, то в формулу закона Рауля вводится изотонический коэффициент. Для электролитов 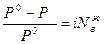
2. Закон Рауля для летучего растворенного вещества
Если оба компонента летучи, то закон Рауля выполняется для каждого из компонентов.
Р1 = 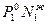 Р2 =
Р2 = 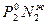 где Р1 и Р2 –парциальные давления компонентов.
где Р1 и Р2 –парциальные давления компонентов.
Парциальное давление компонента равно произведению давления паров чистых компонентов на его мольную долю в жидкости - закон Рауля.
Из закона Дальтона общее давление пара над раствором равно сумме парциальных давлений
Р = Р1+Р2 = 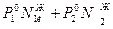 - закон Рауля – Дальтона.
- закон Рауля – Дальтона.
Для определения состава пара в газовой фазе объединяют закон Дальтона и Рауля
По закону Дальтона парциальное давление равно Р1 = 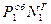 , тоже парциальное давление по закону равно Р1 =
, тоже парциальное давление по закону равно Р1 = 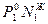 . Приравняем эти давления и найдем долю вещества в газовой фазе
. Приравняем эти давления и найдем долю вещества в газовой фазе
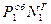 =
= 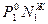 - закон Рауля – Дальтона.
- закон Рауля – Дальтона.
Доля вещества в газовой фазе равна 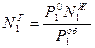
Повышение температуры кипения раствора
Условие кипения:
1.Раствор кипит при равенстве давлений внешнего давления и давления насыщенного пара над раствором Рвнешн. = Р;
2.Растворитель кипит при равенстве давлений внешнего давления и давления насыщенного пара над растворителем Рвнешн. = Р0;
Температура кипения раствора выше, чем температура кипения чистого растворителя, так как давление пара над раствором будет ниже, чем над растворителем.
Тк р-ра- Тк р-ля = DТк, где DТк – абсолютное повышение температуры кипения раствора. Чем выше концентрация раствора, тем давление пара над раствором ниже, поэтому температура кипения раствора выше
DТк = Ек С, где С- моляльная концентрация равная;
Ек- эбулиоскопическая постоянная зависит только от природы растворителя, не зависит от природы растворенного вещества и даны в таблице (для воды Ек = 0,56).
Понижение температуры замерзания раствора
Условия кристаллизации.
1.раствор замерзает когда давление пара над кристаллами растворителя равно давлению пара над раствором Рт= Р;
2. растворитель замерзает когда давление пара над кристаллами растворителя равно давлению пара над растворителем Рт = Р0.
Температура замерзания раствора ниже, чем температура замерзания чистого растворителя, так как давление пара над раствором ниже, чем давление пара над чистым растворителем,.
Тз р-ля -Tз р-ра = DТз, где DТз абсолютное понижение температуры замерзания раствора или депрессией.
Чем выше концентрация раствора, тем давление пара над раствором ниже, тем ниже температура замерзания раствора по сравнению с чистым растворителем
DТз = Ез C, где С- моляльная концентрация равная;
Ез - криоскопическая постоянная зависит от природы растворителя, не зависит от природы растворенного вещества. (для воды равна 1,86)
Пример: Имеется раствор сульфата алюминия с массовой долей ω=10% и плотностью ρ= 1,105 г/см3. Каковы молярная концентрация, молярная концентрация эквивалента, титр, моляльность и молярная доля вещества этого раствора?
Решение:
Дата: 2019-11-01, просмотров: 344.