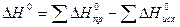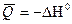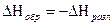Количество теплоты, выделяющееся или поглотившее при реакции, называется тепловым эффектом - 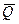 измеряется
измеряется 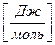
Тепловые эффекты рассчитываются, используя величины теплоты образования (разложения) и сгорания.
Теплота образования – количество выделившейся или поглотившейся теплоты при образовании 1 моль его из простых веществ в кДж.
Теплота сгорания – количество теплоты, выделяющейся при сгорании 1 моля вещества в токе кислорода.
Теплота сгорания при постоянном объеме определяется по формуле Коновалова.
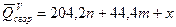 - формула Коновалова, где n – количество атомов кислорода; m – число молей воды; x – термическая характеристика, определяется по таблице.
- формула Коновалова, где n – количество атомов кислорода; m – число молей воды; x – термическая характеристика, определяется по таблице.
Следствия Гесса:
1 следствие. Тепловой эффект (энтальпия) реакции равен сумме теплот (энтальпий) образования продуктов реакции минус сумму теплот (энтальпий) образования исходных веществ с учетом их стехиометрических коэффициентов.
|
Для реакции общего вида: n1А + n2 В = n3С + n4Д + 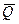
Изменение энтальпии равно: 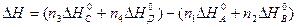
|
4 следствие. Тепловой эффект (энтальпия) реакции образования равен тепловому эффекту (энтальпии) реакции разложения с обратным знаком.
|
Тепловой эффект одной и той же реакции с участием газообразных веществ различен в зависимости от того проходит реакция при постоянном давлении (Р) или объеме (V)
Связь тепловых эффектов: 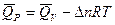
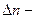 изменение числа молей газообразных веществ.
изменение числа молей газообразных веществ. 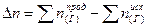
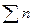 =0 - для жидкого и твердого состояния
=0 - для жидкого и твердого состояния
Пример: Пользуясь табличными значениями энтальпий образования, определите изменение энтальпии и тепловой эффект реакции в стандартных условиях.
СН4 + Н2О(г) = СО + 3Н2
Решение:
Используем следствие из закона Гесса:
DН0 реакц = SDНпродобр - SDНисхобр
Используем данные таблицы изменения энтальпии при стандартных условиях.
| вещество | DН0обр, КДж/ моль |
| СО | -110,53 |
| Н2 | 0 |
| СН4 | -74,85 |
| Н2О(г) | -241,81 |
DН0реакц = (DН0СО + 3DН0Н2 ) – (DН0СН4 + DН0Н2О(г)) = (-110,53) + 0 – (-74,85) – (-241,81) = - 110,53 + 74,85 + 241,81 = 206,13 кДж/моль
Тепловой эффект реакции равен изменению энтальпии с обратным знаком 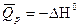
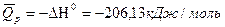
Пример: Вычислите теплоту сгорания пентана С5Н12 Qр при 250 С по формуле Д.П. Коновалова.
Решение:
Горение пентана протекает по уравнению:
С5Н12 + 8О2 = 5СО2 + 6Н2О(ж)
По формуле Д.П.Коновалова тепловой эффект равен Qv = 204,2 n = 44,4 m + х, где
n – число атомов кислорода, требующихся для полного сгорания 1 моля данного вещества;
m – число молей воды, образующихся при сгорании;
х – термическая характеристика, определяется по таблице 5.
Для предельных углеводородов х = 0.
Для данной реакции n = 16; m = 6.
Qv = 204,2 * 16 + 44,4 * 6 = 3267,2 = 266,4 = 3533,6 кДж/моль
Теплоту сгорания Qр рассчитываем по формуле Qp = Qv - Dn RT
При подсчете изменения числа молей Dn учитываем только газообразные вещества: 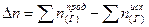 Dn = 5моль – 9моль = - 4моль
Dn = 5моль – 9моль = - 4моль
Qр = 3533,6 кДж/моль + 4моль*8,31 *10-3кДж/мольК * 298К = 3533,6 + 9,9 = 3543,5 кДж/моль.
Пример: По формуле Коновалова
Вычислить теплоту сгорания пентана 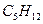 при постоянном давлении по формуле Коновалова при 25°С, если горение протекает по уравнению:
при постоянном давлении по формуле Коновалова при 25°С, если горение протекает по уравнению:
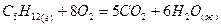 ;
;
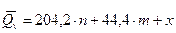 ,
,
где  - число молей воды – 6;
- число молей воды – 6;  - число атомов кислорода – 16;
- число атомов кислорода – 16; 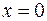 (одинарная связь);
(одинарная связь);
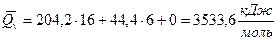 ;
;
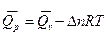 ;
;
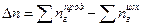 ;
;
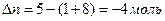 ;
;
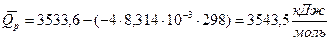 ;
;
Дата: 2019-11-01, просмотров: 345.