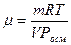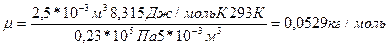УЧЕБНО-МЕТОДИЧЕСКОЕ ПОСОБИЕ
по учебной дисциплине «Физическая и коллоидная химия»
для студентов заочного отделения
2016
Методические указания разработаны для студентов заочного отделения в соответствии с требованиями ФГОС по специальности 18.02.03 Химическая технология неорганических веществ.
Организация разработчик: ГБПОУ «Березниковский политехнический техникум»
Разработчик: Смирнова Людмила Григорьевна, преподаватель дисциплины «Физическая и коллоидная химия»
Рецензенты:
_________________________________________________
Ф.И.О., квалификация, должность,
_________________________________________________
Ф.И.О., квалификация должность,
Рекомендована (одобрена) цикловой методической комиссией «Математических и естественно - научных дисциплин»
Протокол №_____ от «____»____20_____ г.
Утверждена на заседании Методического совета
Протокол №_______ от « » ______ 20___г.
М.П.
ПОЯСНИТЕЛЬНАЯ ЗАПИСКА
Учебная дисциплина «Физическая и коллоидная химия» является общепрофессиональной дисциплиной, формирующей базовые знания, необходимые для освоения специальных дисциплин.
Методическое пособие составлено в соответствии с рабочей программой дисциплины «Физическая и коллоидная химия» по специальности 18.02.03 «Химическая технология неорганических веществ».
Материал пособия включает основные разделы дисциплины: физическая и химическая термодинамика, фазовое равновесие, растворы, электрохимия, кинетика и катализ. Пособие построено по классическому принципу: каждый раздел начинается с краткого теоретического введения, по ходу которого рассматриваются примеры решения типовых задач. Затем следуют варианты выполнения и задания для выполнения контрольных работ.
Учебное пособие дисциплины: «Физическая и коллоидная химия» предназначено для студентов заочной форм обучения, которая предусматривает самостоятельное изучение студентом теоретических основ и выполнение 2 контрольных работ.
СОДЕРЖАНИЕ
Пояснительная записка…………………………………………………………………. 2
Введение …………………………………………………………………………………. 3
1 Теоретическая часть……………………………………………………………………. 4
2 Общие методические указания…………………………………………………………27
3Методические указания к заданиям контрольной работы…………..………………..28
Заключение………………………………………………………………………………. 31
Литература…………………………………………………………………………………32
Общие указания к оформлению контрольной работы.
1. Контрольную работу следует выполнять в школьной тетради с полями для замечаний преподавателя; в конце работы оставить 1-2 страницы для рецензии.
2. В контрольную работу надо обязательно переписывать условия задач и исходные данные.
3. Решение задач необходимо сопровождать пояснениями. При выполнении расчетов сначала надо записать формулу, а затем делать вычисления. Необходимо указывать размерность всех величин, входящих в формулу.
4. В конце работы следует привести список использованной литературы, указав ее полное название, автор и год издания.
5. Работу необходимо подписать и указать дату выполнения работы.
После изучения зачтенной работы необходимо внимательно изучить рецензию и все замечания преподавателя.
Если в рецензии содержатся указания на доработку материала, то ее следует выполнять после рецензии под заголовком « Работа над ошибками» с подзаголовками типа « К задаче…..».
Не зачтенная работа выполняется заново ( старая тетрадь вкладывается в новую) и передается в техникум для повторного рецензирования.
Зачтенные контрольные работы с выполненной при необходимости работой над ошибками является необходимым условием допуска к экзамену.
Контрольная работа, выполненная не по своему варианту, или не в полном объеме, а также неразборчиво, без рисунков или обозначений на них, без доведения решения до числовых ответов к рецензированию не принимаются и возвращаются без зачета.
Методика решения задач.
1. Внимательно прочтите текст задачи, уясните ее физический смысл.
2. Выпишите столбиком данные задачи (в тех единицах, что даны в условии задачи).
3. Дополните данные задачи необходимыми табличными данными и константами.
4. Переведите все данные в систему СИ.
5. Напишите формулу, по которой (или из которой) можно найти истинную величину, т.е. решить задачу в общем виде с пояснениями.
6. Подставьте в формулу числовые значения величин вместе с наименованиями, произведите необходимые действия, найдите ответ.
7. Напишите текстом ответ на вопрос задачи.
Пример: Рассчитайте молекулярную массу не электролита, если в 5л раствора содержится 2,5г не электролита. Осмотическое давление этого раствора равно 0,23*105 Па при 200С.
| Дано V = 5л m = 2,5г Росм = 0,23*105Па t = 200С | СИ 5*10-3 м3
2,5*10-3 кг
273 К
| Решение Осмотическое давление раствора определяется с помощью закона Вант- Гоффа: Заменим число молей n выражением m/m, где m –масса растворенного вещества, а m -его молекулярная масса, получим:
|
| m - ? |
Раздел 1. Физическая химия.
Тема 1.1. Молекулярно-кинетическая теория агрегатных состояний веществ.
Реальный газ
Вязкость жижкости
Вязкость, или внутреннее трение - это сопротивление, возникающее при движении одних ее слоев относительно других
Вязкость – способность жидкости препятствовать своему же движению.
Вязкость жидкости зависит:
- От температуры. При повышении температуры вязкость уменьшается, (жидкость расширяется, расстояние между молекулами увеличивается, и притяжение уменьшается), а текучесть увеличивается. При повышении температуры на 10С вязкость уменьшается примерно на 2%.
- От внешнего давления. C повышением давления вязкость жидкости возрастает.
- От концентрации раствора. При повышении концентрации вязкость увеличивается.
- От молекулярной массы. Вязкость увеличивается с увеличением молекулярной массы.
Количественно вязкость характеризуется коэффициентом (динамической) вязкости 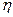 (эта).
(эта).
Способы определения коэффициента (динамической) вязкости 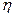 (эта):
(эта):
1. С помощью капиллярного вискозиметра:
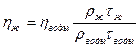
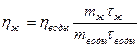
2. Методом приближенного вычисления (методом интерполяции) 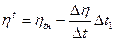
- 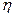 t – вязкость жидкости при измеряемой температуре;
t – вязкость жидкости при измеряемой температуре;
- 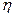 нt – вязкость жидкости при наименьшей температуре;
нt – вязкость жидкости при наименьшей температуре;
- D 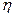 - разность между вязкостью жидкости при наибольшей и наименьшей температуре.
- разность между вязкостью жидкости при наибольшей и наименьшей температуре.
- Dt1- разность между наименьшей и измеряемой температурой;
- Dt –разность между наибольшей и наименьшей температурой.
3. По номограмме.
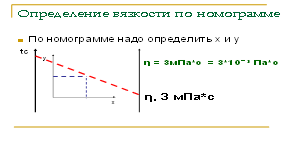
Пример: По формуле Коновалова
Вычислить теплоту сгорания пентана 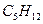 при постоянном давлении по формуле Коновалова при 25°С, если горение протекает по уравнению:
при постоянном давлении по формуле Коновалова при 25°С, если горение протекает по уравнению:
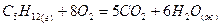 ;
;
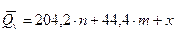 ,
,
где 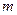 - число молей воды – 6;
- число молей воды – 6; 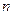 - число атомов кислорода – 16;
- число атомов кислорода – 16; 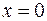 (одинарная связь);
(одинарная связь);
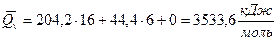 ;
;
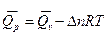 ;
;
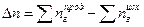 ;
;
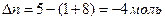 ;
;
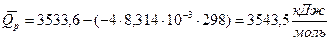 ;
;
Энтропия
Контрольная работа №1
Варианты заданий
| № варианта | Теоретический вопрос | задача | задача | задача | задача |
| 1 | 1 | 1 | 60 | 61 | 91 |
| 2 | 2 | 2 | 59 | 62 | 92 |
| 3 | 3 | 3 | 58 | 63 | 93 |
| 4 | 4 | 4 | 57 | 64 | 94 |
| 5 | 5 | 5 | 56 | 65 | 95 |
| 6 | 6 | 6 | 55 | 66 | 96 |
| 7 | 7 | 7 | 54 | 67 | 97 |
| 8 | 8 | 8 | 53 | 68 | 98 |
| 9 | 9 | 9 | 52 | 69 | 99 |
| 10 | 10 | 10 | 51 | 70 | 100 |
| 11 | 11 | 11 | 50 | 71 | 101 |
| 12 | 12 | 12 | 49 | 72 | 102 |
| 13 | 13 | 13 | 47 | 73 | 103 |
| 14 | 14 | 14 | 47 | 74 | 104 |
| 15 | 15 | 15 | 46 | 75 | 105 |
| 16 | 16 | 16 | 45 | 76 | 106 |
| 17 | 17 | 17 | 44 | 77 | 107 |
| 18 | 18 | 18 | 43 | 78 | 108 |
| 19 | 19 | 19 | 42 | 79 | 109 |
| 20 | 20 | 20 | 41 | 80 | 110 |
| 21 | 21 | 21 | 40 | 81 | 111 |
| 22 | 22 | 22 | 39 | 82 | 112 |
| 23 | 23 | 23 | 38 | 83 | 113 |
| 24 | 24 | 24 | 37 | 84 | 114 |
| 25 | 1 | 25 | 36 | 85 | 115 |
| 26 | 2 | 26 | 35 | 86 | 116 |
| 27 | 3 | 27 | 34 | 87 | 117 |
| 28 | 4 | 28 | 33 | 88 | 118 |
| 29 | 5 | 29 | 32 | 89 | 119 |
| 30 | 6 | 30 | 31 | 90 | 120 |
Теоретические вопросы к 1 контрольной работе
1. Уравнение состояния идеального газа – уравнение Менделеева-Клапейрона, физический смысл газовой постоянной. Основные законы идеальных газов и их вывод из уравнения молекулярно-кинетической теории.
2. Реальные газы. Уравнение Ван-дер-Ваальса, физический смысл поправок. Изотерма реального газа. Понятие о критических параметрах, коэффициент сжимаемости.
3. Характеристика газовых смесей. Закон Дальтона и следствия из него.
4. Характеристика жидкого состояния вещества. Физические причины возникновения сил поверхностного натяжения; зависимость поверхностного натяжения от различных факторов. Опишите способ определения величины поверхностного натяжения с помощью сталагмометра.
5. Характеристика жидкого состояния вещества. Вязкость жидкостей, виды вязкости. Зависимость вязкости жидкостей и газов от температуры и давления. Опишите способы измерения вязкости с помощью вискозиметра.
6. Свойства жидкости. Испарение и кипение жидкостей. Правило Трутона.
7. Характеристика твердого состояния вещества. Плавление и отвердевание веществ. Основные типы кристаллических решеток. Давление пара над твердыми веществами.
8. Теплоемкость веществ, виды теплоемкости, формула пересчета. Средняя и истинная теплоемкости и способы их определения. Теплоемкость смесей и растворов.
9. Предмет термодинамики. Основные понятия термодинамики (система, виды систем, функции состояния, процесс, цикл). Первое начало термодинамики для различных (изохорного, изобарного, изотермического, адиабатного) термодинамических процессов. Понятие об энтальпии системы.
10. Термохимия. Тепловые эффекты химических реакций, термохимические уравнения. Закон Гесса. Следствия из него. Зависимость величины тепловых эффектов химических реакций от природы и агрегатного состояния реагирующих веществ. Вывод зависимости между тепловыми эффектами при постоянном давлении и объеме.
11. Обратимые и необратимые термодинамические процессы. Самовольно протекающие необратимые процессы, предел протекания. Понятие о круговом процессе-цикле. Принцип действия тепловых машин. Второй закон в термодинамике.
12. Прямой цикл Карно, формула для определения коэффициента полезного действия цикла Карно и следствия из нее. Зависит ли КПД цикла Карно от вида рабочего тела? Сущность и формулировка второго начала термодинамики.
13. Связанная и свободная энергия системы, принцип минимума свободной энергии. Энтропия - функция состояния рабочего тела. Расчетные формулы, дающие рассчитать изменение энтропии при различных термодинамических процессах. Применение второго начала термодинамики к химическим процессам, определение направленности процесса по изменению свободной энергии.
14. Термодинамические потенциалы. Применение второго начала термодинамики к химическим процессам, определение направленности процесса по изменению термодинамических потенциалов.
15. Характеристика насыщенного пара. Процесс парообразования на Т –S диаграмме. Расчеты по T – S диаграмме.
16. Характеристика насыщенного пара. Процесс парообразования в Р – V координатах.
17. Построение I- S диаграммы водяного пара. Термодинамические процессы пара на I – S диаграмме.
18. Влажный газ и воздух, основные понятия, характеристики влажного воздуха. I – Х диаграмма влажного газа. Термодинамические процессы влажного газа. Объяснения процесса сушки.
19. Понятие о катализе, виды катализа. Особенности каталитических реакций. Гомогенный катализ. Автокатализ. Теория промежуточных соединений.
20. Цепные реакции, их механизмы и особенности. Теория теплового взрыва. Понятие об ингибиторах.
21. Особенности гетерогенного катализа, механизм действия катализаторов. Адсорбционно-деформационная теория катализа Менделеева-Зелинского.
22. Теория активных центров и активного комплекса, мультиплетная и кислотно-основная теория гетерогенного катализа. Стадии гетерогенного катализа. Влияние температуры на скорость гетерогенной каталитической реакции.
23. Понятие адсорбции, особенности адсорбции. Адсорбция твердыми адсорбентами Изотерма адсорбции. Уравнения Фрейндлиха и Ленгмюра.
24. Ионная и ионообменная адсорбция. Практическое использование процесса адсорбции. Хроматографический анализ.
КОНТРОЛЬНАЯ РАБОТА №2
Варианты заданий 2 контрольной работы
| Варианты | Теоретический вопрос | |||
Задачи к контрольной работе
Теоретические вопросы к контрольной работе №2
- Растворимость жидкости в жидкости. Системы с неограниченной растворимостью. Первый закон Коновалова. Диаграмма давление – состав. Растворимость жидкости в жидкости. Системы с неограниченной растворимостью. Первый закон Коновалова. Диаграммы температура – состав жидкости и пара (t-х-у, х-у)
- Простая перегонка идеальной смеси. Начертить схему простой перегонки и объяснить. Устройство и работа дефлегматоров.
- Ректификация, устройство и работа ректификационной колонны непрерывного и периодического действия.
- Реальные смеси жидкости. Смеси с положительным отклонением от закона Рауля. Второй закон Коновалова. Общие принципы перегонки жидких бинарных систем. Развитие производств с азеотропной перегонкой.
- Реальные смеси жидкости. Смеси с отрицательным отклонением от закона Рауля. Второй закон Коновалова. Общие принципы перегонки жидких бинарных систем. Развитие производств с азеотропной перегонкой.
- Системы из двух несмешивающихся жидкостей. Перегонка с водяным паром. Начертить схему перегонки с водяным паром и объяснить.
- Закон распределения и его значение в лабораторной практике и технологии. Экстрагирование.
- Растворимость газов в жидкости, зависимость ее от температуры и давления. Закон Генри, Генри – Дальтона
- Понятие адсорбции, особенности адсорбции. Адсорбция твердыми адсорбентами Изотерма адсорбции. Уравнения Фрейндлиха и Ленгрюма.
- Ионная и ионообменная адсорбция. Практическое использование процесса адсорбции. Хроматографический анализ.
- Влажный газ и воздух, основные понятия, характеристики влажного воздуха. I – Х диаграмма влажного газа. Термодинамические процессы влажного газа. Объяснения процесса сушки.
- Понятие о катализе, виды катализа. Особенности каталитических реакций. Гомогенный катализ. Автокатализ. Теория промежуточных соединений.
- Особенности гетерогенного катализа, механизм действия катализаторов. Адсорбционно-деформационная теория катализа Менделеева-Зелинского.
- Теория активных центров и активного комплекса, мультиплетная и кислотно-основная теория гетерогенного катализа. Стадии гетерогенного катализа. Влияние температуры на скорость гетерогенной каталитической реакции.
- Построение I- S диаграммы водяного пара. Термодинамические процессы пара на I – S диаграмме.
- Влажный газ и воздух, основные понятия, характеристики влажного воздуха. I – Х диаграмма влажного газа. Термодинамические процессы влажного газа. Объяснения процесса сушки.
- Характеристика насыщенного пара. Процесс парообразования на Т –S диаграмме.
- Понятие адсорбции, особенности адсорбции. Адсорбция твердыми адсорбентами Изотерма адсорбции. Уравнения Фрейндлиха и Ленгмюра.
- Ионная и ионообменная адсорбция. Практическое использование процесса адсорбции. Хроматографический анализ
- Ректификация, устройство и работа ректификационной колонны непрерывного и периодического действия.
- Характеристика жидкого состояния вещества. Физические причины возникновения сил поверхностного натяжения; зависимость поверхностного натяжения от различных факторов. Опишите способ определения величины поверхностного натяжения с помощью сталагмометра.
- Характеристика жидкого состояния вещества. Вязкость жидкостей, виды вязкости. Зависимость вязкости жидкостей и газов от температуры и давления. Опишите способы измерения вязкости с помощью вискозиметра.
- Предмет термодинамики. Значение химической термодинамики для химической технологии. Основные понятия термодинамики (система, виды систем, функции состояния, процесс, цикл). Первое начало термодинамики для различных (изохорного, изобарного, изотермического, адиабатного) термодинамических процессов. Понятие об энтальпии системы.
- Обратимые и необратимые термодинамические процессы. Самовольно протекающие необратимые процессы, предел протекания. Понятие о круговом процессе-цикле. Принцип действия тепловых машин. Второй закон в термодинамике.
- Прямой цикл Карно, формула для определения коэффициента полезного действия цикла Карно и следствия из нее. Зависит ли КПД цикла Карно от вида рабочего тела? Сущность и формулировка второго начала термодинамики.
- Термодинамические потенциалы. Применение второго начала термодинамики к химическим процессам, определение направленности процесса по изменению термодинамических потенциалов.
- Равновесие в двухкомпонентных системах. Термический анализ и его использование при изучении фазовой диаграммы системы Bi – Cd.
- Двухкомпонентные системы с образованием химических соединений (на примере диаграммы состояния системы Mg – Ca). Применение диаграмм состояния. Н.С. Курнаков – основоположник физико-химического анализа.
- Электрохимия. Проводники первого и второго рода. Удельная электропроводимость растворов и ее измерение.
- Эквивалентная электропроводность растворов. Зависимость от температуры и разбавления. Скорость и подвижность ионов. Закон Кольрауша.
Литература
Основная
- Гамеева О.С. Физическая и коллоидная химия. Учебник для техникумов хим. технол. спец.- М.: Высш.шк., 1977.
- Гамеева О.С. Сборник задач и упражнений по физической и коллоидной химии.-М.:Высш. Шк., 1980.
- Ахметов Б.В., Новиченко Ю.П., Чапурин В.И. Физическая и коллоидная химия: Учебник для техникумов. – М.: Химия, 1986.
- Балезин С.А. Практикум по физической и коллоидной химии. – М.: Просвещение, 1972.
Дополнительная
- Кузнецов В.В. Физическая и коллоидная химия. – М.: Высш. шк., 1968.
- Лукъянов А.Б. Физическая и коллоидная химия. – М.: Химия, 1980.
- Малахова А.Я. Практикум по физической и коллоидной химии. – Мн.: Выш. Шк., 1974.
УЧЕБНО-МЕТОДИЧЕСКОЕ ПОСОБИЕ
по учебной дисциплине «Физическая и коллоидная химия»
для студентов заочного отделения
2016
Методические указания разработаны для студентов заочного отделения в соответствии с требованиями ФГОС по специальности 18.02.03 Химическая технология неорганических веществ.
Организация разработчик: ГБПОУ «Березниковский политехнический техникум»
Разработчик: Смирнова Людмила Григорьевна, преподаватель дисциплины «Физическая и коллоидная химия»
Рецензенты:
_________________________________________________
Ф.И.О., квалификация, должность,
_________________________________________________
Ф.И.О., квалификация должность,
Рекомендована (одобрена) цикловой методической комиссией «Математических и естественно - научных дисциплин»
Протокол №_____ от «____»____20_____ г.
Утверждена на заседании Методического совета
Протокол №_______ от « » ______ 20___г.
М.П.
ПОЯСНИТЕЛЬНАЯ ЗАПИСКА
Учебная дисциплина «Физическая и коллоидная химия» является общепрофессиональной дисциплиной, формирующей базовые знания, необходимые для освоения специальных дисциплин.
Методическое пособие составлено в соответствии с рабочей программой дисциплины «Физическая и коллоидная химия» по специальности 18.02.03 «Химическая технология неорганических веществ».
Материал пособия включает основные разделы дисциплины: физическая и химическая термодинамика, фазовое равновесие, растворы, электрохимия, кинетика и катализ. Пособие построено по классическому принципу: каждый раздел начинается с краткого теоретического введения, по ходу которого рассматриваются примеры решения типовых задач. Затем следуют варианты выполнения и задания для выполнения контрольных работ.
Учебное пособие дисциплины: «Физическая и коллоидная химия» предназначено для студентов заочной форм обучения, которая предусматривает самостоятельное изучение студентом теоретических основ и выполнение 2 контрольных работ.
СОДЕРЖАНИЕ
Пояснительная записка…………………………………………………………………. 2
Введение …………………………………………………………………………………. 3
1 Теоретическая часть……………………………………………………………………. 4
2 Общие методические указания…………………………………………………………27
3Методические указания к заданиям контрольной работы…………..………………..28
Заключение………………………………………………………………………………. 31
Литература…………………………………………………………………………………32
Общие указания к оформлению контрольной работы.
1. Контрольную работу следует выполнять в школьной тетради с полями для замечаний преподавателя; в конце работы оставить 1-2 страницы для рецензии.
2. В контрольную работу надо обязательно переписывать условия задач и исходные данные.
3. Решение задач необходимо сопровождать пояснениями. При выполнении расчетов сначала надо записать формулу, а затем делать вычисления. Необходимо указывать размерность всех величин, входящих в формулу.
4. В конце работы следует привести список использованной литературы, указав ее полное название, автор и год издания.
5. Работу необходимо подписать и указать дату выполнения работы.
После изучения зачтенной работы необходимо внимательно изучить рецензию и все замечания преподавателя.
Если в рецензии содержатся указания на доработку материала, то ее следует выполнять после рецензии под заголовком « Работа над ошибками» с подзаголовками типа « К задаче…..».
Не зачтенная работа выполняется заново ( старая тетрадь вкладывается в новую) и передается в техникум для повторного рецензирования.
Зачтенные контрольные работы с выполненной при необходимости работой над ошибками является необходимым условием допуска к экзамену.
Контрольная работа, выполненная не по своему варианту, или не в полном объеме, а также неразборчиво, без рисунков или обозначений на них, без доведения решения до числовых ответов к рецензированию не принимаются и возвращаются без зачета.
Методика решения задач.
1. Внимательно прочтите текст задачи, уясните ее физический смысл.
2. Выпишите столбиком данные задачи (в тех единицах, что даны в условии задачи).
3. Дополните данные задачи необходимыми табличными данными и константами.
4. Переведите все данные в систему СИ.
5. Напишите формулу, по которой (или из которой) можно найти истинную величину, т.е. решить задачу в общем виде с пояснениями.
6. Подставьте в формулу числовые значения величин вместе с наименованиями, произведите необходимые действия, найдите ответ.
7. Напишите текстом ответ на вопрос задачи.
Пример: Рассчитайте молекулярную массу не электролита, если в 5л раствора содержится 2,5г не электролита. Осмотическое давление этого раствора равно 0,23*105 Па при 200С.
| Дано V = 5л m = 2,5г Росм = 0,23*105Па t = 200С | СИ 5*10-3 м3
2,5*10-3 кг
273 К
| Решение Осмотическое давление раствора определяется с помощью закона Вант- Гоффа: Заменим число молей n выражением m/m, где m –масса растворенного вещества, а m -его молекулярная масса, получим:
|
| m - ? |
Раздел 1. Физическая химия.
Тема 1.1. Молекулярно-кинетическая теория агрегатных состояний веществ.
Методические указания к теме
Необходимо помнить следующие постоянные:
1.Нормальные условия: температура 00 С или 273 К, давление 1 атм. или 101325 Па.
2.Молярный объем: V= 22,4 л/ моль = 22,4 м3/кмоль = 22,4*10-3 м3/моль.
3. 1 кал = 4,187 Дж. 1 ккал = 4187 Дж.
1. Идеальный газ – это воображаемый газ, в котором отсутствует взаимодействие между молекулами, а сами молекулы представляют собой материальные точки.
Уравнение состояния идеального газа - уравнение Менделеева–Клапейрона PV = nRT ,
- n - количество молей в веществе;
- Р - давление газа, обусловленное ударами молекул о стенки сосуда.
- R – универсальная газовая постоянная, показывающая работу, совершаемую 1 моль идеального газа при изобарическом нагревании на 1 Кельвин.
Численное значение универсальной газовой постоянной зависит от выбора единиц:
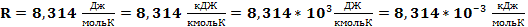
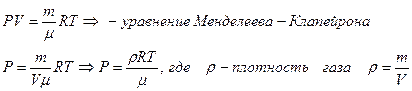 ,
,
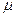 - молярная масса – масса 1 моль вещества.
- молярная масса – масса 1 моль вещества. 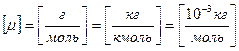
Вычисление плотности газа:
1.Плотность при нормальных условиях: 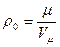 ,
,
V𝝁 – молярный объем – объем одного моля газа при нормальных условиях.
[V𝝻] = [22, 4 л/ моль] = [22,4 м3/кмоль ] = [22,4*10-3 м3/моль]
2. Плотность газа в зависимости от температуры:
- из уравнения Менделеева-Клапейрона 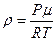
- из закона Гей-Люссака 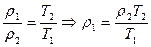
3. Относительная плотность ( D) – это плотность одного газа по другому газу. 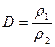
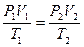 - уравнение Клапейрона - для постоянной массы
- уравнение Клапейрона - для постоянной массы
Реальный газ
Дата: 2019-11-01, просмотров: 419.
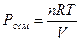
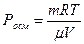 Отсюда, молекулярная масса равна
Отсюда, молекулярная масса равна