Катионы серебра с хлорид-ионами образуют белый творожистый осадок АgСl. При стоянии на свету хлорид серебра разлагается, покрываясь серо-фиолетовым налетом выделяющегося металлического серебра. Растворимость АgСl в воде чрезвычайно мала и составляет 1,33·10–5 моль/л.
Осадок АgСl полностью растворим в растворе аммиака с образованием бесцветного раствора:
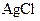 +2NH3 ® [Ag(NH3)2]+ +
+2NH3 ® [Ag(NH3)2]+ + 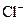 ,
,
из которого при подкислении до рН 8 вновь выделяется АgСl:
[Ag(NH3)2]+ + 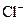 +2H+ ®
+2H+ ® 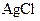 + 2NH4+
+ 2NH4+
Ионы серебра образуют также осадки с бромид– и иодид–ионами: АgВr (светло-желтый) и АgI (желтый). В отличие от АgСl осадок АgВr плохо, а АgI нерастворим в концентрированном растворе аммиака.
Выполнение реакции : Возьмите в пробирку 2-3 капли раствора АgNО3 и прибавьте столько же 2 моль/л раствора НСl. Обратите внимание на образование белого творожистого осадка АgСl. К осадку АgСl добавьте по каплям 2 моль/л раствор NН3 до растворения осадка. К полученному бесцветному раствору комплексного соединения добавьте 1-2 капли фенолфталеина и затем по каплям концентрированный (1:1) раствор HNO3 до исчезновения малиновой окраски раствора. При этом наблюдается помутнение раствора или выпадение белого осадка AgCl.
1.2. Реакция с хроматом калия, К2СrО4
Катионы серебра с хромат(VI)–ионом при рН 6,5 – 7,5 образуют осадок хромата серебра кирпично-красного цвета:
2Ag+ + CrO42– ® Ag2CrO4; KSo (Ag2CrO4) = 1,29·10–12
Осадок Аg2СrО4 нерастворим в уксусной кислоте, но растворим в концентрированном растворе аммиака. В сильнокислой среде осадок Аg2СrО4 не образуется, так как в этих условиях хромат–ион переходит в дихромат–ион:
2CrO42– + 2H+ « Cr2O72– + H2O,
а дихромат серебра хорошо растворим в воде.
Определению ионов Ag+ реакцией с К2CrO4 мешают Рb2+, Ва2+, Sr2+ и некоторые другие катионы, образующие осадки с СrО42– –ионом.
Выполнение реакции : В пробирку поместите 2-3 капли раствора АgNО3 и 1-2 капли раствора К2СrО4. Обратите внимание на цвет осадка Аg2СrО4. Проверьте его растворимость в 2 моль/л растворе СН3СООН.
2. Аналитические реакции катиона ртути( I ), Hg 2 2+
Соли ртути ядовиты! Работать осторожно! Растворы, содержащие ртуть, по завершении эксперимента сливайте в специальную склянку, а не в раковину!
2.1. Реакция образования каломели Нg2Сl2 (фармакопейная)
Катион Hg22+ с хлорид–ионами образует белый осадок каломели Нg2Сl2. Осадок нерастворим в разбавленных растворах минеральных кислот, но растворим в концентрированной азотной кислоте и в царской водке.
3Hg2Cl2 + 8HNO3(конц.) ® 3HgCl2 + 3Hg(NO3)2 + 2NO + 4H2O
3Hg2Cl2 + 2HNO3 + 18HCl ® 6H2[HgCl4] + 2NO + 4H2O
При действии раствора аммиака на осадок Нg2Сl2 происходит диспропорционирование ртути(I) на металлическую ртуть и ртуть(II), что сопровождается потемнением осадка:
Hg2Cl2 + 2NH3 ® Hg(NH2)Cl + Hg + NH4Cl
Выполнение реакции : В пробирке смешайте по 5 капель растворов Нg2(NО3)2 и НСl с концентрацией 2 моль/л. Образовавшийся осадок каломели Нg2Сl2 разделите на две части. К одной части добавьте концентрированной азотной кислоты, к другой – раствор аммиака. Запишите наблюдения.
Дата: 2019-04-23, просмотров: 297.