Высокомолекулярные вещества (полимеры) – это вещества с молекулярной массой от десяти тысяч до нескольких миллионов единиц.
По происхождению ВМВ делятся на:
1. Природные ВМВ или биополимеры (белки, нуклеиновые кислоты, полисахариды и др.) являются структурной основой всех живых организмов.
2.Синтетические (каучук, полиэтилен, синтетические смолы) ВМВ получаются в результате химического синтеза. Методы синтеза ВМВ основаны на реакциях полимеризации, поликонденсации и сополимеризации. Любой синтетический полимер состоит из макромолекул разной степени полимеризации и характеризуется полидисперсностью.
3. Искусственные ВМВ изготавливают на основе природных ВМВ с заранее заданными свойствами.
По строению полимерной цепи ВМВ бывают
- линейными,
- разветвленными,
- пространственными.
Например, целлюлоза (растительный полисахарид) – имеет линейную структуру; гликоген (животный полисахарид) – имеет разветвленную структуру; фенопласты – имеют пространственную сетчатую структуру.
В животном организме присутствуют в основном плохорастворимые полимеры разветвленной и пространственной структур.
По способности к электролитической диссоциации ВМВ делятся на
- неэлектролиты
- полиэлектролиты, которые подразделяются на поликислоты, полиоснования и полиамфолиты.
Макромолекулы могут принимать различную форму в результате конформационных изменений: линейную, клубка, глобул.
Конформации и различные состояния объясняются стремлением к самопроизвольному уменьшению энергии Гиббса (∆G< 0), которое происходит при условии T·∆S > ∆H.Таким образом, Конформация – это пространственная форма макромолекул, соответствующая максимуму энтропии. Конформационными переходами можно объяснить многие процессы, происходящие в организме, например, регуляцию активности ферментов.
Белками называют высокомолекулярные природные полимеры, молекулы которых построены из остатков аминокислот. Каждый белок обладает своей, присущей ему последовательностью расположения аминокислотных остатков.
Роль белков в организме трудно переоценить. Они выполняют следующие функции: Структурная или пластическая, каталитическая, сократительная, регуляторная, рецепторная, транспортная, защитная, энергетическая, запасная. Кроме того, среди белков встречаются антибиотики и вещества, оказывающие токсическое действие.
В среднем, суточная потребность белка составляет 100-120 г.
Молекулярная масса белков достаточно большая, поэтому они относятся к высокомолекулярным соединениям. Молекулярная масса белков колеблется от 6 000 до 1 000 000 Дальтон и выше, она зависит от количества аминокислотных остатков в полипептидной цепи, а для олигомерных белков имеющих четвертичную структуру – от количества входящих в них протомеров (субъединиц).
Макромолекулы ВМВ имеют уровни структурной организации. Для молекул белков известно 4 уровня структурной организации.
Первичная структура – это последовательность аминокислотных остатков в полипептидной цепи.
Вторичная структура – пространственная структура в виде α-спирали (фибриноген крови), либо β-структура складчатого листа (кератин волос).
Третичная структура – расположение вторичной структуры в пространстве. При этом образуются субъединицы белка или микроструктуры.
Четвертичная структура – объединение субъединиц в макроструктуры (гемоглобин крови).
Гибкость как свойство молекулы обусловливает эластичность как свойство материала (например, эластичность волос, кожи и т.п.).
Специфические свойства растворов ВМВ. Набухание. Степень набухания, факторы, влияющие на набухание. Ограниченное и неограниченное набухание. Вязкость. Удельная, приведённая и характеристическая вязкости. Осмотическое давление.
К специфическим свойствам растворов ВМВ относят: набухание, вязкость, осмотическое давление.
Набухание - это увеличение объема и массы полимера в результате избирательного поглощения низкомолекулярного вещества из жидкой или газообразной среды.
Степень набухания показывает отношение приращения объема или массы набухшего полимера к первоначальному объему или массе. Её определяют весовым и объемным методом. Весовым методом определяют массу сухого и набухшего полимера и по разности находят массу поглощенной жидкости. Объемным методом измеряют изменение объема тела при поглощении им жидкости, или объема жидкости, в котором происходит набухание. 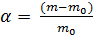 ;
; 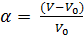
На степень набухания влияют:
1) Природа полимера и растворителя. Полярные ВМВ лучше набухают в полярных растворителях (например, белки в воде), неполярные в неполярных (например, каучук в бензоле).
2) Температура. Повышение температуры способствует более быстрому набуханию, так как усиливается движение частиц, что способствует разрыхлению внутренних структур. Для каждого высокомолекулярного вещества и растворителя должна существовать своя критическая температура, выше которой происходит их безграничное смешение.
3) Присутствие электролитов. Анионы способствуют набуханию в большей степени, чем катионы.
4) pH среды. Изменение рН среды в более кислую или щелочную сторону от изоэлектрической точки коллоида увеличивает степень набухания. Это объясняется появлением положительного и отрицательного заряда у коллоидных частиц и, следовательно, повышением степени гидратации.
Набухание называется ограниченным, если низкомолекулярная жидкость ограниченно растворима в ВМВ, и оно не заканчивается образованием текучей системы. Растянутая сетка макромолекул, стремясь сократиться, препятствует увеличению содержания растворителя.
При неограниченной растворимости низкомолекулярной жидкости в полимере его пачки после набухания продолжают раздвигаться и макромолекулы постепенно диффундируют в растворитель, образуя раствор. Такое набухание называют неограниченным.
Растворы высокомолекулярных соединений отличаются высокой вязкостью (или внутренним трением), обусловленной силами сцепления между молекулами жидкости. Количественно вязкость характеризуют коэффициентом вязкости η (этта), Па ∙ с.
Вязкое состояние обусловлено:
1) Силами сцепления гидрофильных молекул ВМВ с молекулами растворителя.
2) Образование ассоциатов при взаимодействии макромолекул между собой.
3) На аномально-высокую вязкость оказывает влияние форма и гибкость макромолекул полимера.
4) При протекании жидкости через сосуд отдельные части могут перемещаться с различными скоростями (гидродинамическая вязкость).
Удельная вязкость - увеличение вязкости, связанное с изменением концентрации при растворении полимера:
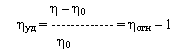 η – вязкость раствора;
η – вязкость раствора;
η0 – вязкость чистого растворителя;
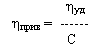 Для линейной (вытянутой) формы макромолекул удельную вязкость рассчитывают по уравнению Штаудингера: ηуд. = К· М(X) · C(X)
Для линейной (вытянутой) формы макромолекул удельную вязкость рассчитывают по уравнению Штаудингера: ηуд. = К· М(X) · C(X)
М (Х) – относительная молекулярная масса полимера [а. е. м.];
C (X) – весовая концентрация полимера [г · м-3];
К – константа, характеризующая особенности гомологического ряда полимера.
Величина ηуд/С получила название приведенной вязкости:
Предел ηуд/С при С→0 отражает гидродинамическое сопротивление движению молекул полимера и именуется характеристической вязкостью [η].
В растворах ВМВ осмотическое давление имеет ряд особенностей. Это связано с тем, что макромолекула ВМВ может рассматриваться как совокупность молекул меньшего размера.
Это учитывает уравнение Галлера: πосм = (СВМВ/МВМВ) ∙ RТ+βС2ВМВ, где
СВМВ – весовая концентрация полимера, г/м3;
β – коэффициент, учитывающий форму, гибкость, размеры макромолекулы.
Если концентрация раствора невелика, то βС2ВМВ → 0, тогда уравнение Галлера переходит в уравнение Вант-Гоффа. Измеряя осмотическое давление растворов различных концентраций и строя график зависимости πосм/ СВМВ от СВМВ, находят значение молярной массы полимера и коэффициента β.
Факторы, влияющие на осмотическое давление ВМВ:
Концентрация - с повышением концентрации ВМВ осмотическое давление возрастает.
Температура - при повышении температуры осмотическое давление возрастает.
pH - в изоэлектрической точке осмотическое давление будет минимальным, при смещении pH от изоэлектрической точки в кислую или щелочную области оно увеличивается.
Дата: 2019-04-23, просмотров: 1752.