ОВ системы – растворы, содержащие одновременно окислительные и восстановительные формы вещества.
- Простая ОВ система – система, в которой окислительно-восстановительный процесс связан с передачей только электронов.
- Сложная ОВ система – система, в которой процесс связан с передачей не только электронов, но и ионов среды.
ОВ электрод образует инертный токопроводящий Me (Pt)
ОВ потенциал – потенциал, возникающий на границе соприкосновения пластинки инертного Me с ОВ системой. 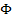 зависит от соотношения концентраций ОВ эл. Потенциала, от природы ОВ системы и от температуры. Чем больше величина стандартного ОВ потенциала, тем сильнее окислительные свойства системы. Чем меньше величина ОВ эл.п., тем сильнее восстановительные и слабее окислительные свойства вещества.
зависит от соотношения концентраций ОВ эл. Потенциала, от природы ОВ системы и от температуры. Чем больше величина стандартного ОВ потенциала, тем сильнее окислительные свойства системы. Чем меньше величина ОВ эл.п., тем сильнее восстановительные и слабее окислительные свойства вещества.
Стандартный эл. ОВ потенциал: 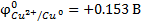
Уравнение Нернста-Петерса для простых и сложных окислительно-восстановительных систем, его анализ. Направление окислительно-восстановительных процессов.
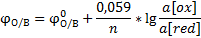
Направление ОВ процессов:
В сложной ОВ системе восстановителя протекает процесс окисления, т.е. обратная реакция.
В сложной ОВ системе окислителя протекает процесс восстановления, т.е. прямая реакция.
Межфазные явления их термодинамическая характеристика. Сорбция. Адсорбция. Абсорбция. Физическая и химическая сорбция. Понятие поверхностно активных веществ (ПАВ), их свойства и применение в медицине.
Поверхность раздела фаз – слой, возникающий на границе раздела фаз. (Т-Г, Т-Ж, T-T, Ж-Г, Ж-Ж)
Она характеризуется параметрами:
1. Удельная поверхность фазы S уд. S = 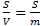 [
[ 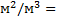 1/м или
1/м или 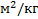 ]
]
2. Свободная поверхностная энергия Gs = σS [Дж(Н/ 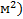 ]
]
3. Поверхностное натяжение σ = 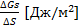
Поверхностная энергия подчиняется основным законам ТД:
Согласно первому закону ТД, поверхностная энергия может переходить в химическую, электрическую и свободную энергию Гиббса.
Согласно второму закону ТД, поверхностная энергия может быть причиной самопроизвольных процессов, определяемых уменьшением энергии Гиббса.
Сорбция – поглощение одного вещества другим. Сорбент – поглотитель. Сорбтив (сорбат) – поглощаемое вещество.
Адсорбция – поглощение поверхностью сорбента.
а = (Со – С) V / S, где
а – величина адсорбции (удельная сорбционная емкость) [ммоль м-2];
Со – начальная концентрация адсорбата [ммоль дм-3];
С – равновесная концентрация адсорбата [ммоль дм-3];
V – объем жидкой фазы [дм3];
S – площадь поверхности адсорбента [м2].
С увеличением концентрации адсорбируемого вещества величина адсорбции возрастает и достигает максимального значения при полном насыщении поверхности.
Математически эта взаимосвязь характеризуется уравнением Гиббса:
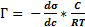 [ммоль м-2], где
[ммоль м-2], где
Г - количество адсорбированного вещества [ммоль/м2]
С – равновесная концентрация адсорбата [ммоль/л]
R – универсальная газовая постоянная
Т – абсолютная температура.
Величина адсорбции зависит от:
1. Размера поверхности адсорбента (↑ S ↑ Г).
2. Температуры (↑t ↓Г ).
3. Типа сорбента, его сродства к растворителю.
4. Заряда адсорбента и адсорбтива.
5. Концентрации адсорбтива.
Абсорбция – поглощение всем сорбентом.
Физическая сорбция происходит за счёт сил Ван-дер-Ваальса, и возникает только межмолекулярное взаимодействие
Химическая сорбция происходит за счёт химического взаимодействия и называется хемосорбцией.
Поверхностно-активные вещества (ПАВ) – вещества, обладающие низким поверхностным натяжением и вызывающие положительную адсорбцию. (Спирты, органические кислоты, сложные эфиры, белки, холестерол, жиры, липиды, мыла.)
Правило Траубе-Дюкло: При удлинении цепи на группу -СН2 - в гомологическом ряду способность к адсорбции возрастает в 3,2 раза.
Правило Ребиндера: На границе раздела полярные группы молекул ПАВ ориентируются в сторону более полярной фазы, а углеводородный радикал – в сторону менее полярной фазы.
ПАВ широко используются в фармации в качестве основы для приготовления мазей, свечей, эмульсий, а также солюбилизаторов.
Электролитная адсорбция, её закономерности. Правила электролитной адсорбции. Ионообменная адсорбция, её закономерности. Иониты, их классификация. Ионообменная ёмкость, способы её выражения. Применение ионитов в медицине.
Электролитная адсорбция – избирательная адсорбция ионов из раствора электролита на полярном адсорбенте.
Правила электролитной (избирательной) адсорбции:
1. Правило Панета-Фаянса: на поверхности кристалла преимущественно адсорбируются те ионы, которые входят в состав кристаллической решетки.
2. Правило изоморфизма: На полярном адсорбенте из раствора электролита преимущественно адсорбируются ионы, близкие по строению и размерам к одному из ионов кристаллической решетки адсорбента.
3. Если ионы-адсорбаты имеют одинаковые по знаку и разные по величине степени окисления, то в первую очередь адсорбируются ионы с большей степенью окисления: Fe 3+ > Ca 2+ > K + .
4. Если ионы-адсорбаты имеют одинаковые по величине и знаку степени окисления, то в первую очередь адсорбируются менее гидратированные ионы (с большим ионным радиусом).
Лиотропный ряд (ряд Гофмейстера) для катионов: Cs+ > Rb+ > K+ > Na+ > Li+; для анионов: SCN- > I- > Br- > Cl-.
Ионообменная адсорбция – процесс, при котором твёрдый адсорбент обменивает эквивалентное количество своих ионов на ионы того же знака из жидкого раствора.
Починяется закону эквивалентности, всем 4м правилам электронной адсорбции, принципу Ле-Шателье-Брауна, что позволяет регенерировать иониты.
Классификация ионитов:
По происхождению: природные (кристаллические силикаты, апатиты, гуминовые кислоты) и синтетические (алюмосиликаты, ионно-обменные смолы и высокомолекулярные вещества в качестве каркаса, целлюлоза)
По составу: неорганические (апатиты), органические (гуминовые кислоты, сапропель, целлюлоза)
В санитарно-гигиенической практике иониты используются для очистки воды, выделения и очистки радиоактивных изотопов, являются составной частью безотходных экологически чистых методов производства; для декальцинирования крови с целью ее консервации; для осуществления гемодиализа крови (используется ионит - алюмогель); беззондовой диагностики кислотности желудочного сока; детоксикации организма при различных отравлениях. Аниониты - антацидные средства, катиониты используются для предотвращения ацидоза, предупреждения и лечения отеков, связанных с декомпенсацией сердечной деятельности;
Дата: 2019-04-23, просмотров: 537.