Истинные растворы прозрачные и гомогенные, частицы в дисперсной фазе меньше нанометра. При фильтрации коллоидные растворы через бумажные фильтры не проходят, а истинные фильтруются с легкостью. Истинные растворы проходят через клеточные мембраны. Коллоидные растворы термодинамичны и не устойчивы, расслаиваются, а истинные растворы могут образовываться самопроизвольно, без затрат дополнительной энергии. Силы преобразования между фазой и средой для истинных растворов довольно велики, поэтому им не требуется стабилизатор. Истинные растворы более прочны, так как дисперсная фаза неподвижна, образуют структуру внутри которой заключена среда (к примеру, костная ткань). Коллоидные раствор свободнодисперсные, обладают текучестью, поэтому концентрация фазы и среды равномерно распределены (пыль, дым либо туман).
Молекулярно-кинетические свойства:
Броуновское движение – беспрерывное, хаотичное движение частиц. Его интенсивность зависит от размера частиц, вязкости среды, температуры.
Диффузия – процесс самопроизвольного выравнивания концентрации диспергированного вещества под влиянием теплового хаотичного движения частиц. Скорость диффузии коллоидных частиц (из-за больших размеров) во много раз меньше скорости диффузии молекул и ионов низкомолекулярных веществ. Поэтому по скорости диффузии можно определить радиус и степень дисперсности коллоидных частиц.
Осмос – это односторонняя диффузия молекул чистого растворителя через полупроницаемую мембрану из раствора с меньшей концентрацией в более концентрированный раствор.
Осмотическое давление определяется законом Вант-Гоффа: π = КБ · Сν · Т
π – осмотическое давление [Па]
КБ - константа Больцмана
КБ = 1,38 · 10-23 [Дж· К-1]
Сν - частичная концентрация частиц золя [м-3]
Т - абсолютная температура [К]
Осмотическое давление коллоидных растворов имеет особенности:
- является низким (из-за больших размеров частиц и низкой концентрации);
- меняется во времени (из-за агрегации коллоидных частиц).
Седиментация - оседание коллоидных частиц под действием сил разной природы (гравитационной, центростремительной и др.). Состояние системы, при котором сила тяжести и сила диффузии уравновешивают друг друга называется седиментационным равновесием.
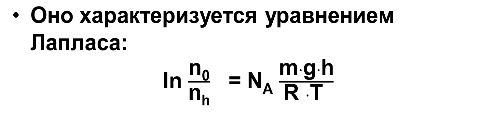
n0 – общее число коллоидных частиц; nh - число коллоидных частиц на высоте h; NA - 6,02 ·1023 моль-1; постоянная Авогадро; m - масса частиц [кг]; g - ускорение свободного падения 9,8 м · c-2; h - высота [м]; R – универсальная газовая постоянная; T - абсолютная температура [К].
Следствие: С увеличением высоты концентрация коллоидных частиц уменьшается (более выражена эта зависимость для тяжелых частиц). Способность дисперсной системы сохранять равномерное распределение частиц по всему объему называется седиментационной или кинетической устойчивостью.
Оптические свойства коллоидов:
Для коллоидных растворов диаметр частиц примерно равен длине волны падающего света. В этом случае преобладает дифракционное рассеяние света, так как каждая коллоидная частица становится вторичным источником света.
При боковом освещении коллоидного раствора образуется светящийся конус, получивший название конуса Тиндаля-Фарадея.
Математически рассеяние света выражают уравнением Рэлея: I = I0 k Сν V2 / λ4 I - интенсивность рассеяного света;
I0 - интенсивность падающего света;
Сν - частичная концентрация коллоидных частиц [м-3];
V – объем одной коллоидной частицы [м3];
λ – длина волны падающего света [м];
k – константа, зависящая от показателей преломления ДСр и ДФ.
Следствие: Интенсивность светорассеяния обратно пропорционально длине волны.
Визуально наблюдают опалесценцию, т.е. окраска коллоидных растворов в рассеянном свете (при рассмотрении сбоку) и в проходящем свете неодинакова. Конус Тиндаля при рассмотрении сбоку имеет голубой оттенок, на просвет – красный. Оптические явления лежат в основе методов изучения дисперсных систем – нефелометрии и ультрамикроскопии.
Нефелометрия – метод, используемый для изучения дисперсных систем по интенсивности рассеянного света, которая прямо пропорциональна частичной концентрации коллоидных частиц.
36. Двойной электрический слой коллоидных систем. Способы образования ДЭС. Электрокинетические явления. Электрофорез и электроосмос и их значение для медицины.
ДЭС - пространственное разделение зарядов противоположного знака в межфазном слое.
В дисперсных системах ДЭС возникает в межфазном слое на границе раздела частица дисперсной фазы – дисперсионная среда. Это прежде всего характерно для золей и суспензий, дисперсная фаза которых формируется из твердых частиц, а также возможно для эмульсий (дисперсная фаза – жидкость).
Образование ДЭС происходит самопроизвольно в результате стремления системы уменьшить энергию Гиббса поверхностного слоя. Стремление гетерогенной системы к уменьшению поверхностной энергии вызывает определенное ориентирование полярных молекул, ионов и электронов в поверхностном слое, вследствие чего соприкасающиеся фазы приобретают заряды противоположного знака, но равной величины.
Электрокинетические явления – это перемещение дисперсной фазы или дисперсионной среды под действием внешнего электрического поля. Причина этих явлений – образование ДЭС на границе раздела дисперсной фазы и дисперсионной среды и, как следствие, наличие электрического заряда у частиц дисперсной фазы и дисперсионной среды.
Электрокинетические явления делятся на: электрофорез, электроосмос, потенциал седиментации, потенциал течения.
Электрофорез - направленное движение частиц дисперсной фазы относительно неподвижной дисперсионной среды под действием внешнего электрического поля.
Электроосмос - перемещение дисперсионной среды относительно неподвижной дисперсной фазы.
Явления электрофореза и электроосмоса позволяют определять знак и величину заряда дисперсных частиц. Установлено что поверхность биомембран несет отрицательный заряд.
Значение для медицины:
Электрофорез:
- для диагностики многих заболеваний;
- разделения аминокислот;
- изучения ферментов, антибиотиков и других объектов.
Электроосмос:
- для снятия отеков;
- в технике – для осушения болотистых участков местности.
Мицелла и её строение. Электрокинетический или дзета-потенциал и его свойства. Зависимость агрегативной устойчивости мицеллы от величины дзета-потенциала и концентрации электролита. Изоэлектрические состояния мицеллы.
Мицелла – структурная единица коллоидных систем.
Пример.
AgNO3 + KI (избыток) = AgI + KNO3
Осадок AgI находится в избытке раствора KI.
Избыток электролита выполняет роль стабилизатора.
Осадок AgI яв-ся агрегатом мицеллы.
Ионы I- называются потенциалопределяющими.
Агрегат и потенциалопределяющие ионы составляют ядро мицеллы.
К отрицательному заряду будут притягиваться противоионы K+, образуя плотный слой противоионов.
Потенциалопределяющие ионы и противоионы плотного слоя вместе образуют адсорбционный слой.
Адсорбционный слой вместе с агрегатом составляют гранулу.
Часть противоионов, не вошедших в адсорбционный слой, образуют диффузный слой.
Гранула и диффузный слой составляют мицеллу.
Мицелла, таким образом, электронейтральна.
В мицелле выделяют две границы:
Граница раздела фаз - проходит между потенциалопределяющими ионами и противоионами плотного слоя.
Граница скольжения - проходит между гранулой и диффузным слоем.
На границе скольжения возникает электрокинетический потенциал или дзета (ξ) - потенциал.
Дзета-потенциал – один из основных факторов, определяющих поведение мицеллы в электрическом поле. Его рассчитывают по скорости движения частиц дисперсной фазы при электрофорезе или дисперсионной среды при электроосмосе.
Величина дзета-потенциала определяется толщиной диффузного слоя и зависит от разности между общим числом зарядов потенциалопределяющих ионов и числом зарядов противоионов, находящихся в адсорбционном слое.
Чем больше заряд гранулы и, соответственно, величина дзета-потенциала, тем устойчивее коллоидный раствор.
Наличие одноименного заряда способствует отталкиванию частиц друг от друга, препятствуя таким образом их коагуляции (укрупнению) и седиментации (осаждению).
Дата: 2019-04-23, просмотров: 1967.