Коэффициент калорийности – энтальпия сгорания 1 г вещества, взятая с обратным знаком. Выражается в кДж/г или ккал/г (1 ккал = 4,18 Дж).
Коэффициенты калорийности:
- белков 16,5 – 17,2 кДж/г;
- углеводов 16,5 – 17,2 кДж/г;
- жиров 37,7 – 39,8 кДж/г.
Для расчета калорийности порции пищи, используют формулу:
Кmin = (mб · 16,5 + mу · 16,5 + mж · 37,7) кДж
Кmax = (mб · 17,2 + mу · 17,2 + mж · 39,8) кДж
Второй закон термодинамики, его формулировки. Энтропия и энергия Гиббса как критерии возможности самопроизвольного протекания процессов.
Формулировки:
1. Теплота не может сама собой передаваться от холодного тела к горячему, не оставляя изменений в окружающей среде.
2. Различные виды энергии стремятся перейти в теплоту, а теплота рассеивается, т.е. её невозможно полностью превратить в полезную работу.
3. В изобарно-изотермических условиях самопроизвольно протекают только такие процессы, которые сопровождаются уменьшением энергии Гиббса (G<0). В состоянии равновесия энергия Гиббса не меняется, ΔG=0.
Энтропия ( S) – мера неупорядоченности в системе. Это функция состояния системы, приращение которой (ΔS) равно минимальной теплоте Q, поступившей в систему в обратимом изотермическом процессе, делённой на абсолютную температуру (T), при которой совершается этот процесс. ΔS=Qmin/T, [Дж · моль-1 · К-1].
Энергия Гиббса ( G) - это часть потенциальной энергии реагирующих веществ, которая может быть использована для осуществления полезной работы.
В изобарно-изотермических условиях ΔG = ΔH – TΔS.
Самопроизвольные процессы протекают без сообщения энергии системе извне. Протекают до установления равновесия.
Величина ΔG служит критерием возможности самопроизвольного протекания процессов.
Если ΔG<0 – процесс протекает самопроизвольно.
Если ΔG>0 – процесс самопроизвольно не протекает.
Если ΔG=0 – состояние равновесия.
Химическое равновесие, константа равновесия. Термодинамическая характеристика химического равновесия. Уравнение изотермы химической реакции, условия равновесия и направления обратимых химических реакций.
Химическое равновесие – состояние системы, когда пряма и обратная реакции имеют одинаковые скорости.
Состояние химического равновесия характеризуется константой равновесия химической реакции, которая равна отношению констант скоростей прямой и обратной реакций: Kр = kпрям / kобр.
Константа равновесия – постоянная, отражающая соотношение концентраций компонентов обратимой реакции в состоянии химического равновесия.
Кс = [Сс][Dd]/[Aa][Bb]
Уравнение изотермы: 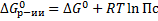
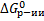 – изменение Е Гиббса
– изменение Е Гиббса
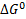 – изменение стандартной Е Гиббса
– изменение стандартной Е Гиббса
Пс – величина стехиометрического соотношения концентраций веществ, участвующих в реакции
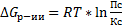
Анализ:
1) Если Пс>Кс, Пс/Кс > 1, lnПс/Кс > 0, то 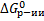 > 0 – обратная реакция.
> 0 – обратная реакция.
2) Если Пс<Кс, Пс/Кс < 1, lnПс/Кс < 0, то 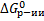 < 0 – прямая реакция.
< 0 – прямая реакция.
3) Если Пс=Кс, Пс/Кс = 1, lnПс/Кс = 0, то 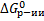 = 0 – равновесие в системе.
= 0 – равновесие в системе.
Константа равновесия реакции связана со свободной энергией Гиббса: ΔG = – RT · ln Kр. Если Kр = 1, то ΔG = 0, и протекание реакции равновероятно в обе стороны. Если Kр > 1, то ΔG < 0, и реакция смещена в сторону образования продуктов. Если Kр < 1, то ΔG > 0, реакция протекает преимущественно в сторону образования реагентов, то есть преобладает обратная реакция.
Минимальное значение энергии Гиббса является условием термодинамического равновесия в закрытой системе.
Если Кс = 0, реакция не идёт.
Если Кс = ∞, реакция идёт до конца.
Если Кс > 0, реакция прямая, равновесие смещено в образование продуктов.
Если Кс < 0, реакция обратная, равновесие смещено в образование реагентов.
Дата: 2019-04-23, просмотров: 847.