Основные положения протонной теории кислот и оснований:
1. Кислота – частица, отдающая протон в данной реакции, т.е. донор Н+.
2. Основание – частица, присоединяющая протон в данной реакции, т.е. акцептор Н+.
3. Кислота и основание связаны в сопряжённую пару протолитов, частицы которой отличаются по составу на один передаваемый передаваемый протон (Н+): кислота основание + Н+
Например:
4. Сильной сопряжённой кислоте соответствует слабое сопряжённое основание и наоборот:
сил. к-та слаб. осн. слаб. к-та. сильн. осн.
5. Кислоты-протолиты делят на 3 класса:
- нейтральные:
- катионные:
- анионные:
Основания-протолиты тоже делят на 3 класса:
- нейтральные: NH 3 + Н+ NH 4 +
- катионные: FeOH +
- анионные: С l - , CH 3 COO -, СН3СОО- + Н+ СН3СООН
6. Амфолиты – протолиты, способные как принимать, так и отдавать протоны:
к-та осн-е осн-е к-та
7. Количественно сила кислот-протолитов характеризуется вероятностью переноса протона от кислоты к воде как основанию и оценивается величиной константы кислотности (Ка).
Константа кислотности (Ка ) характеризует момент химического равновесия в процессе переноса протона и определяется на основании закона действующих масс.
Чем выше концентрация сопряженных частиц продуктов протонного переноса, тем больше значение Ка, а значит тем сильнее кислота-протолит.
На практике используют показатель константы кислотности (pKa):
Чем меньше значение pKa, тем сильнее кислота.
15. Принципы титриметрического анализа. Классификация методов титриметрического анализа. Титрование, требования к реакциям объёмного анализа. Закон эквивалентов, количественные расчёты в объёмном анализе.
Титриметрический анализ основан на измерении объема титранта – раствора с точно известной концентрации, израсходованного на реакцию с определяемым веществом, при этом вещества должны реагировать в строго эквивалентных количествах. Титриметрическое определение вещества сводится к проведению химической реакции смешиванием растворов двух реагирующих веществ – анализируемого раствора (с неизвестной концентрацией) и титранта. Эта операция проводится титрованием – добавлением небольших порций раствора одного из веществ к известному объему раствора второго вещества.
Требования к реакциям в методах титриметрии:
1) реакция должна быть практически необратимой;
2) реакция должна протекать быстро, в строгом соответствии с законом эквивалентов, без побочных процессов;
3) необходимо точно фиксировать момент эквивалентности.
Момент эквивалентности определяют:
- с помощью индикаторов;
- по изменению окраски раствора одного из реагирующих веществ;
- по прекращению выпадения осадка или изменению цвета осадка;
- с помощью приборов, например, потенциометров, кондуктометров и пр.
Закон эквивалентов: n(1/zT) = n(1/zХ)
n(1/zХ) = С(1/zХ) · Vх
n(1/zT) = С(1/zT) · Vт
С(1/zТ) – молярная концентрация эквивалента титранта, моль/дм3
V(Т) – объем титранта, см3
С(1/zХ) – молярная концентрация эквивалента исследуемого вещества, моль/дм3
V(Х) – объем раствора исследуемого вещества, см3
С(1/ zT ) ∙ V ( T ) = C (1/ zX ) ∙ V ( X )
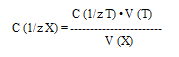
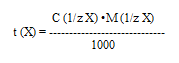
Дата: 2019-04-23, просмотров: 542.