КС – соединения, в состав которых входят сложные ионы, существующие как в кристалле, так и в растворе.
Теория Вернера:
1. В составе комплексных соединений выделяют внутреннюю и внешнюю сферы. Внутренняя включает в себя центральный атом или ион комплексообразователя, вокруг которого находятся связанные с ним лиганды.
2. Внешняя сфера образуется ионами, не связанными с комплексообразователем. Они удерживаются около внутренней сферы за счёт сил электростатического взаимодействия.
3. Типичными комплексообразователями являются атомы или ионы d-элементов, имеющие свободные орбитали. Комплексообразователи являются акцепторами электронов.
4. Лиганды – атомы, ионы, молекулы, имеющие избыток электронов или неподелённые электронные пары. Это кислотные остатки, гидроксогруппы, нейтральные молекулы. Лиганды являются донорами электронов.
5. Механизмы комплексообразования связаны возникновением межионного и межмолекулярного взаимодействия комплексообразователя с лигандами, но основной вклад в формирование внутренней сферы вносят донорно-акцепторные (координационные) взаимодействия.
6. Кол-во лигандов, связанных с комплексообразователем, определяется его координационным числом, величина которого зависит от природы комплексообразователя, лигандов и условий комплексообразования (концентрация, pH, температура и тд.)
Устойчивость КС:
1. Первичная диссоциация – это диссоциация комплексной соли на внутреннюю сферу и ионы внешней сферы. (по принципу сильных электролитов)
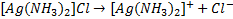
2. Вторичная диссоциация – диссоциация внутренней сферы
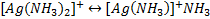
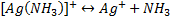
Устойчивость комплексных ионов характеризуется константой нестойкости (Кнест), которая определяется на основании закона действующих масс.
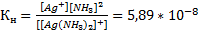
Константа нестойкости характеризует термодинамическую устойчивость комплекса, которая зависит от прочности связей между центральным атомом и лигандами. Чем меньше значение Кнест, тем более прочен комплекс, устойчивее.
Уравнение изотермы: 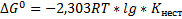 ;
;
Классификация КС по различным признакам. Заряд комплексного иона. Катионные, анионные, нейтральные КС, их номенклатура. Моно- и полидентантные лиганды. Хелаты. Комплексоны. Трилон Б. Краун-эфиры. Значение комплексных соединений в биологии и медицине.
Классификация:
1. По составу: соли, основания, кислоты.
2. По типу координируемых лигандов:
а) Аквакомплексы – это комплексные катионы, в которых лигандами являются молекулы H2O. Их образуют катионы металлов со степенью окисления +2 и больше, причем способность к образованию аквакомплексов у металлов одной группы периодической системы уменьшается сверху вниз.
Например: [Al(H2O)6]Cl3, [Cr(H2O)6](NO3)3.
б) Гидроксокомплексы – это комплексные анионы, в которых лигандами являются гидроксид-ионы OH–. Комплексообразователями являются металлы, склонные к проявлению амфотерных свойств – Be, Zn, Al, Cr.
Например: Na[Al(OH)4], Ba[Zn(OH)4].
в) Аммиакаты – это комплексные катионы, в которых лигандами являются молекулы NH3. Комплексообразователями являются d-элементы.
Например: [Cu(NH3)4]SO4, [Ag(NH3)2]Cl.
г) Ацидокомплексы – это комплексные анионы, в которых лигандами являются анионы неорганических и органических кислот.
Например: K3[Al(C2O4)3], Na2[Zn(CN)4], K4[Fe(CN)6].
3. По характеру заряда внутренней сферы различают катионные, анионные и нейтральные комплексы.
Например:
1) [Cu+( NН3)4]+ - катионный комплекс
2) [Zn2+(SCN)4]2– - анионный комплекс
3) [ Pt2+(CI)2(Н 2 О)2]0 - нейтральный комплекс
Номенклатура катионных комплексов:
1. Назвать число лигандов греческим числительным
2. Назвать лиганды: сначала нейтральные молекулы, затем лиганды-анионы
3. Назвать комплексообразователь русским наименованием
4. Отметить валентность комплексообразователя римской цифрой в скобках
Номенклатура анионных комплексов:
1. Назвать число лигандов греческим числительным
2. Назвать лиганды: сначала нейтральные молекулы, затем лиганды-анионы
3. Назвать комплексообразователь латинским наименованием с окончанием -ат
4. Отметить валентность комплексообразователя римской цифрой в скобках
Номенклатура нейтральных комплексов:
1. Назвать число лигандов греческим числительным
2. Назвать лиганды: сначала нейтральные молекулы, затем лиганды-анионы
3. Назвать комплексообразователь русским наименованием
Монодентантные лиганды присоединяются к комплексообразователю одним атомом и образуют одну координационную связь. (Например: H2O, NH3, Cl-, CN-, OH- и тд.)
Полидентантные присоединяются к комплексообразователю посредством нескольких атомов. (Например, органические соединения)
Хелаты – комплексы, содержащие полидентантные лиганды.
Комплексоны - полидентантные лиганды, содержащие несколько функциональных групп и образующие прочные комплексы практически со всеми двухзарядными ионами Me (Ca2+, Mg2+, Zn2+, Cu2+, Pt2+…)
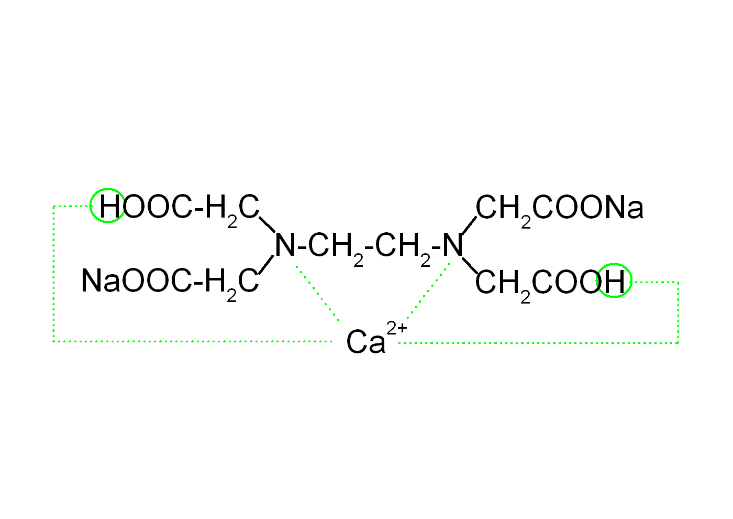 Трилон Б широко используется в клиническом анализе для титриметрического определения ионов Са2+ и Мg2+при определении жесткости воды. Максимальная дентатность такого лиганда равна 6.
Трилон Б широко используется в клиническом анализе для титриметрического определения ионов Са2+ и Мg2+при определении жесткости воды. Максимальная дентатность такого лиганда равна 6.
В краун-эфирах (особый тип полидентантных лигандов) донорные атомы кислорода заключены в плоский цикл определенного размера. Они содержат от 4 до 12 атомов кислорода (краун-4, краун-5 и т.д). Полости краун-эфиров имеют строго определенные размеры. Поэтому краун-эфиры могут избирательно связывать ионы металлов, размеры которых близки к размерам полости.
Значение:
Комплексные соединения – это ферменты, многие гормоны, лекарства, биологические-активные вещества. Комплексы белков с катионами металлов играют роль металлоферментов, катализирующих большинство химических превращений. Например, гормон инсулин, витамин B12, гемоглобин, хлорофилл. Также, КС составляют значительную часть природных материалов.
Комплексные соединения находят широкое применение:
- для выведения из организма камней, которые образуются в почках, мочевом пузыре, желчных протоках;
- для маскировки нежелательных примесных элементов в составе лекарственных препаратов;
- для очистки организма от ядов, радиоактивных элементов, тяжелых металлов;
- в аналитической химии для определения ионов, т.к. яркая окраска многих внутрикомплексных соединений позволяет использовать реакции их образования для обнаружения катионов металлов в анализируемом растворе;
- для разделения некоторых металлов и получения металлов высокой степени чистоты;
- для устранения жесткости воды;
- в качестве катализаторов важных биохимических процессов.
27. Понятие о ДЭС. Механизм образования. Термодинамика ДЭС. Уравнение Нернста, его анализ. Электродный потенциал. Стандартный электродный потенциал.
ДЭС можно разделить на 2 части: стабильную и подвижную. В стабильной части на поверхности металла возникает электрический заряд, который определяется потенциалопределяющими ионами (в рез-те электродных процессов). Подвижная часть содержит в себе 2 слоя. Адсорбционный, который состоит из противоионов, расположенных на расстоянии ионного радиуса от поверхности Me. (дейст. электростатические силы притяжения), и диффузный, который состоит из ионов, расположенных на расстоянии большем, чем ионный радиус. (свободно перемещаются в растворе, за счёт теплового движения).
ДЭС возникает в результате создания избытка носителей электричества данного знака по одну сторону и их недостатка по другую сторону границы раздела фаз, за счёт обмена заряженными частицами.
От величины электродного потенциала зависит величина работы, которая совершается системой при образовании ДЭС. Она выражается: А=n*F*Ф [кДж* 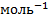 ]. В изобарно-изотермических условиях работа равна уменьшению энергии Гиббса A=-∆G.
]. В изобарно-изотермических условиях работа равна уменьшению энергии Гиббса A=-∆G.
Уравнение Нернста: 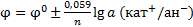 φ – электродный потенциал [В],
φ – электродный потенциал [В],
φ0 – стандартный электродный потенциал - характеризует природу электрода.
(φ = φ0, если a(п.о.и.) = 1 моль ·дм-3);
R – универсальная газовая постоянная,
n – число электронов в электродной реакции,
F – число Фарадея,
a(п.о.и.) – активная концентрация
потенциалопределяющих ионов [моль · дм-3].
Анализ: Электродный потенциал зависит от природы электрода, температуры и активной концентрации потенциалопределяющих ионов в жидкой фазе электрода.
Электродный потенциал – максимальная разность потенциалов, возникающая на границе раздела 2х фаз в момент установления равновесия.
Для измерения стандартного электродного потенциала 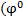 ) необходимо собрать гальваническую цепь из исследуемого электрода и стандартного водородного электрода, потенциал которого условно принят за 0В.
) необходимо собрать гальваническую цепь из исследуемого электрода и стандартного водородного электрода, потенциал которого условно принят за 0В.
28. Электроды сравнения. Стандартный водородный электрод, его устройство, электродная реакция, значение. Гальванические цепи для определения стандартных электродных потенциалов. Хлорсеребряный электрод, его электродная реакция, электродный потенциал.
Электроды сравнения – их потенциалы известны, постоянны и воспроизводимы. (Пр. хлорсеребряный)
Стандартный ВЭ состоит из черниной платиновой пластинки, насыщенной газообразным водородом при давлении 1 атм (101,3 кПа) и опущенной в раствор кислоты с активностью а( 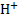 )= 1 моль*
)= 1 моль* 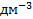 .
.
Электродная р-я: 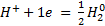 .
.
Значение возникающего электродного потенциала зависит от природы Me, концентрации ионов Me в растворе и от температуры.
Гальваническая цепь для определения стандартных электродных потенциалов состоит из исследуемого электрода и стандартного водородного электрода, потенциал которого условно принят за 0В.
ЭДС – разность потенциалов на концах гальванической цепи. ЭДС = Ф(+) – Ф(-).
Хлорсеребряный электрод представляет собой серебряную проволоку, покрытую слоем хлорида серебра и опущенную в насыщенный раствор хлорида калия.
Эл. Р.: 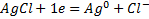
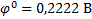
29. Электроды определения. Стеклянный электрод, его электродная реакция, электродный потенциал. Ионоселективные электроды и их применение в медико-биологических исследованиях. Потенциометрический анализ. Потенциометрическое титрование, сущность метода, значение для биологии и медицины.
Электроды определения – их потенциалы зависят от концентрации анализируемых ионов.
Стеклянный электрод состоит из стеклянной трубки, заканчивающейся шариком из специального стекла; внутрь этой системы наливают буферный раствор и для токоотвода помещают хлорсеребряный электрод. 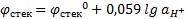 ;
; 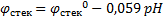 .
.
Ионоселективные электроды – это специальные электроды, равновесный потенциал которых в растворе электролита зависит от концентрации содержащихся в нём ионов. C их помощью можно наблюдать за изменением ионного состава биологических жидкостей в динамике, а также получать информацию о внутриклеточном изменении концентрации ионов Na+, К+, Сa2+, СI- и т.д.
Потенциометрический анализ – физико-химический метод, позволяющий определять концентрации ионов на основе измерения электродвижущей силы гальванической цепи, содержащей исследуемый раствор.
Потенциометрическое титрование – метод анализа, в котором точка эквивалентности определяется по изменению в ходе титрования электродвижущей силы гальванической цепи, содержащей анализируемый раствор. Методом потенциометрического титрования анализируют не только истинные растворы, но и мутные, окрашенные, коллоидные системы.
Метод потенциометрии позволяет объяснить механизм генерирования и распространения нервных импульсов, природу реакций биологического окисления и гидролиза. Метод прямой потенциометрии применяют для клинического анализа на ионы Н+, К+, Na+, Ca2+, Cl-, I-, HS- и других в биологических жидкостях, растворах лекарственных препаратов и солевых кровезаменяющих жидкостях, на молекулы глюкозы, мочевины, аминокислот, а также для контроля окружающей среды.
Дата: 2019-04-23, просмотров: 1022.