Краткие теоретические сведения
Общая информация
Диаграммы состояния конденсированных систем описывают межфазные равновесия а) между жидкостью и твердым веществом – процессы плавления, растворения, кристаллизации, образования или разрушения химических соединений; б) между разными твердыми фазами - процессы изменения кристаллической структуры вещества или полиморфные превращения, образования твердых растворов. Уравнение правила фаз Гиббса записывается в следующем виде:
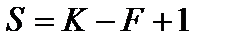 ,
,
где S – число степеней свободы; K – число компонентов; F – количество фаз.
Диаграммы состояния конденсированных систем обычно изображаются в изобарических координатах. По оси абсцисс указан состав системы в мольных или массовых долях (процентах) по компоненту В. По осям ординат указана шкала температур. По линиям А и В показаны температурные точки, характерные для чистых веществ: температуры плавления и полиморфных превращений.
Порядок рассмотрения диаграммы
1. Перечертить диаграмму, соблюдая топологию, в заданном масштабе.
2. Дать общую характеристику диаграммы. При наличии химических соединений вывести их формулу.
3. Отметить линию ликвидуса, линию солидуса, линии растворимости компонентов; написать равновесия на линиях. Составить равновесия на линиях эвтектики и перитектики.
4. Обозначить поля диаграммы греческими или римскими цифрами.
5. Указать фазовый состав полей диаграммы. Начинать следует с определения полей, содержащих одну фазу. Поля, содержащие две фазы находятся обычно между однофазными элементами диаграммы.
6. Описать значимые точки диаграммы (точки плавления компонентов, точки эвтектик, точки перитектик, точки полиморфных превращений и др.): указать температуру, состав, уравнение равновесия.
7. Рассмотреть свойства систем, заданных соответствующими фигуративными точками и заполнить таблицу
| Точка | Исходный состав, % В | Кол-во фаз в точке | Наименование фаз | Состав каждой фазы, % В | Относительное кол-во фаз, % | Температура кристаллизации | Число степеней свободы | |
| ТН | ТK | |||||||
Типовые диаграммы состояния
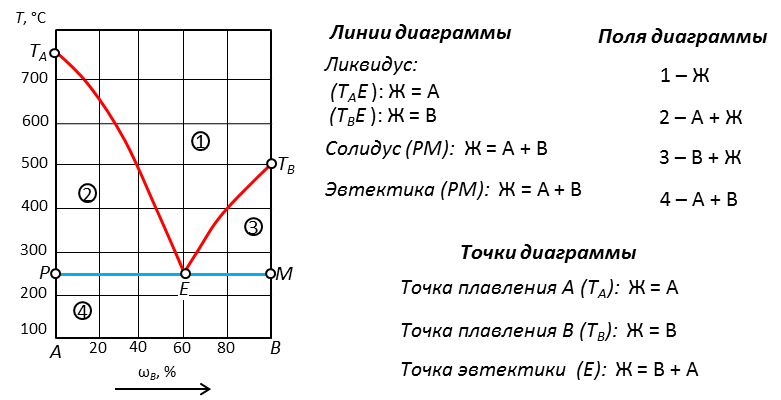
Рис. 16. Диаграмма состояния двухкомпонентной системы с одной точкой эвтектики.
Общая характеристика диаграммы. Есть: неограниченная растворимость компонентов в жидкой фазе. Нет: химических соединений, твердых растворов, полиморфных превращений.
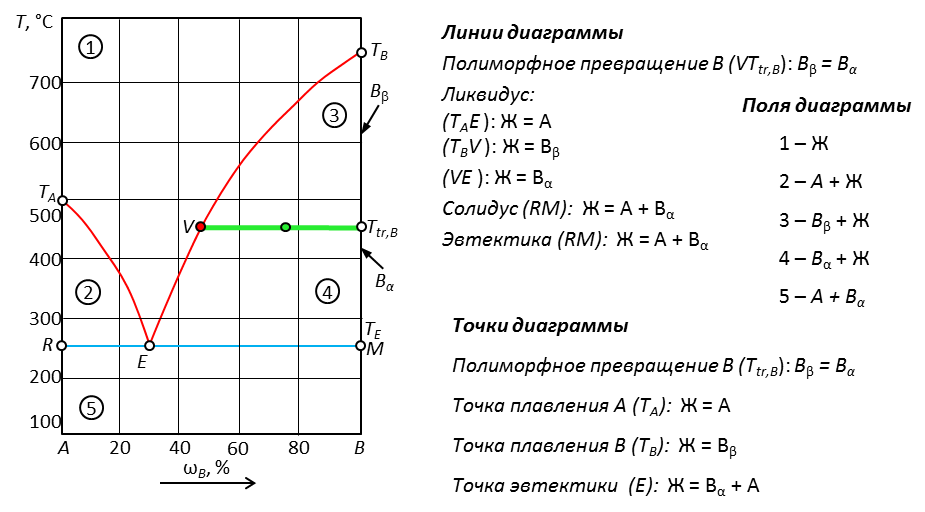
Рис. 17. Диаграмма с полиморфным превращением компонента В
Наличие полиморфного превращения обозначается горизонтальной линией (V- Ttr, B). Начало линии идет от того вещества, которое меняет кристаллическую решетку (от вещества В). Выше линии превращения – одна кристаллическая модификация, ниже – другая.
Рис. 18. Диаграмма с ограниченной растворимостью жидкостей
Наличие области ограниченной растворимости жидкостей и их расслаивания на две фазы обозначают пунктирной линией, расположенной выше ликвидуса. Изотерма (WN) показывает начало расслаивания при нагревании системы. Точка Алекссева (С) показывает условия, при которых существует одна жидкая фаза.
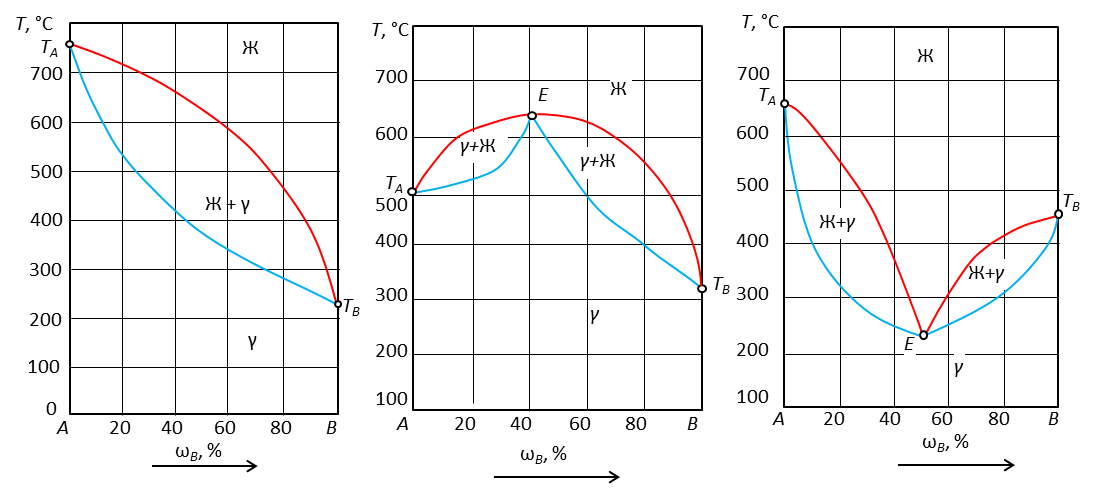
Рис. 19. Диаграммы состояния с твердыми растворами замещения.
Диаграммы просты. Состоят из линий ликвидуса и солидуса. Могут иметь экстремальные точки, а могут и не иметь.
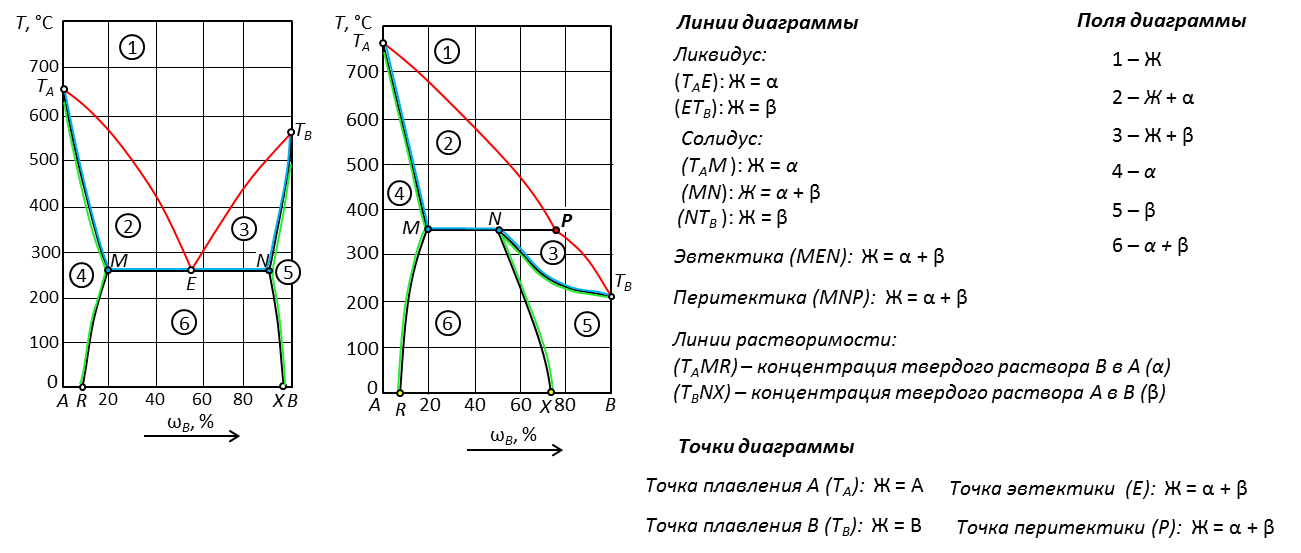
Рис. 20. Диаграммы с твердыми растворами внедрения.
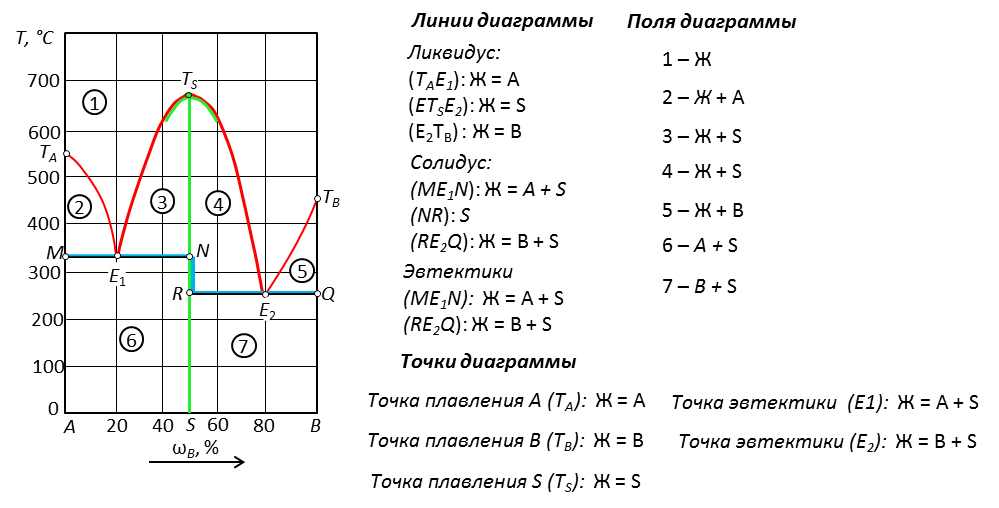
Рис. 21. Диаграмма с химическим соединением постоянного состава, которое плавится без разложения (конгруэнтно).
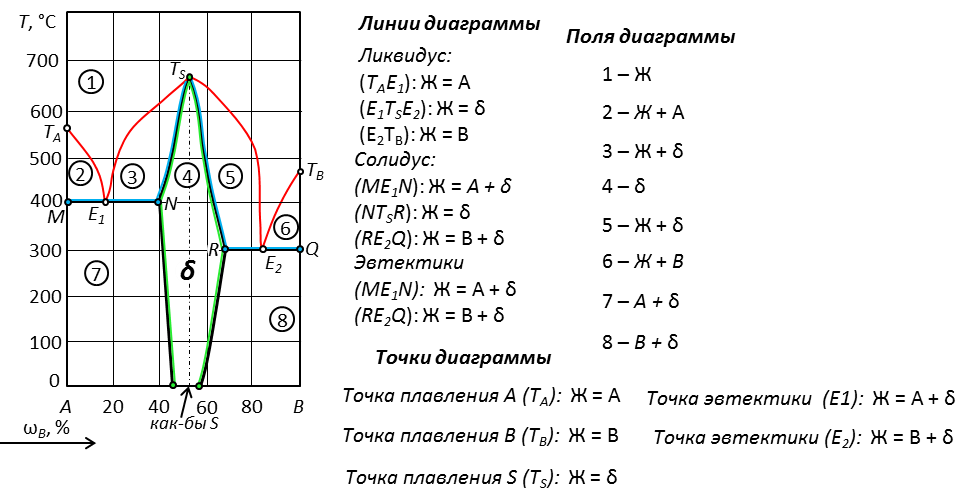
Рис. 22. Диаграмма с дальтонидом, который плавится без разложения
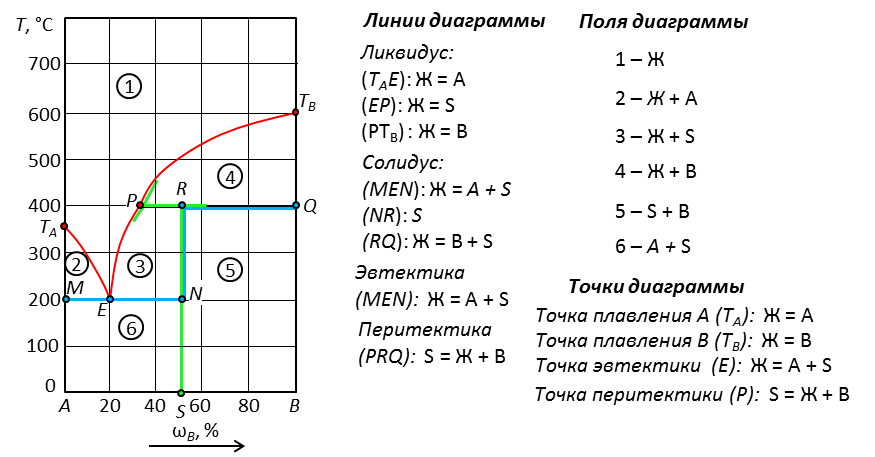
Рис. 23. Химическое соединение постоянного состава, которое плавится с разложением.
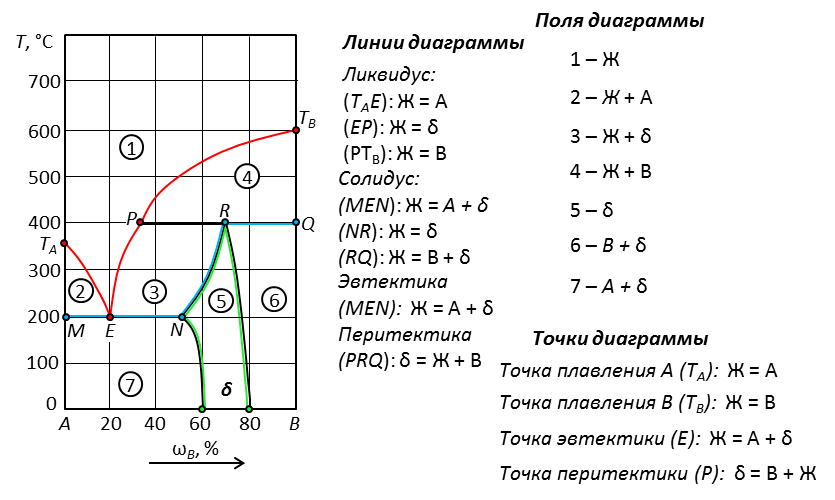
Рис. 24. Химическое соединение переменного состава, которое плавится с разложением. Обозначается на диаграммах как область состава δ, ограниченная линией перитектики.
Примеры решения задач
Пример 11. Прочесть диаграмму состояния системы «медь – магний».

Рис. 16. Диаграмма состояния медь-магний.
Решение. 1. Дать общую характеристику диаграммы состояния.
Температура плавления (кристаллизации) чистой меди ТСu = 1083°С, а магния TMg = 650°С. В расплавленном состоянии эти металлы неограниченно растворимы и образуют одну жидкую фазу. Магний кристаллизуется из двухкомпонентного расплава в чистом виде, а медь – в виде твердого раствора α, область существования которого ограничена пределами от 0 до 5 % Mg и в котором «хозяином» кристаллической решетки является медь. Кристаллические модификации компонентов не меняются.
Медь и магний образуют два химических соединения, плавящиеся без разложения (конгруэнтно). Первое из них содержит от 30 до 37 % магния, плавится при температуре 819°С. Второе химическое соединение S2 плавится при 568°С, имеет постоянный стехиометрический состав, содержит 65 % Mg.
Вывод формул химических соединений. Точке плавления соединения S1 (δ) отвечает мольная доля магния 34 %. Допускают, что количество вещества химического соединения один моль, тогда 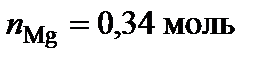 ,
, 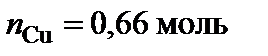 .
. 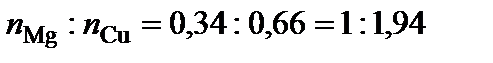 , следовательно, формула химического соединения S1 (δ) – Cu2Mg.
, следовательно, формула химического соединения S1 (δ) – Cu2Mg.
Точке плавления соединения S2 отвечает мольная доля магния 66 %. Допускают, что 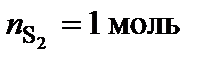 , тогда
, тогда 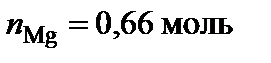 ,
, 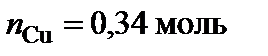 .
. 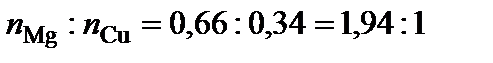 – Mg2Cu.
– Mg2Cu.
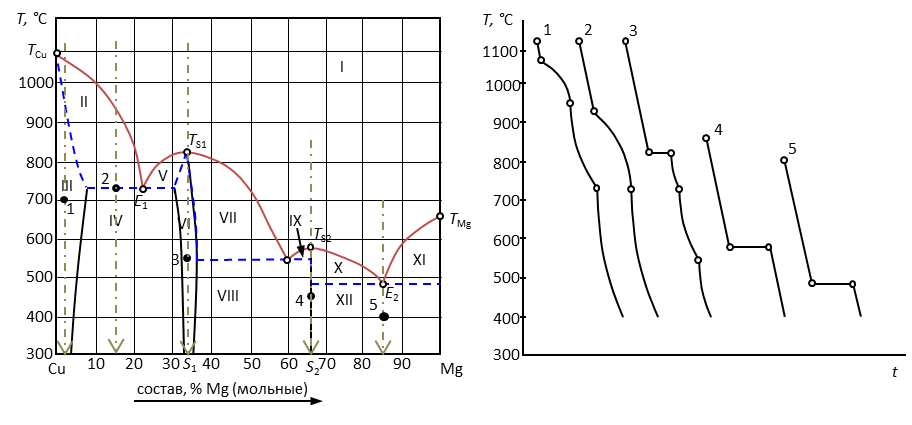
Рис. 17. Решение примера 1.
2. Пронумеровать поля диаграммы и дать их наименование.
I – расплав (Ж); II – Ж + α; III – твердый раствор внедрения магния в меди (α); IV – α + δ; V – δ + Ж; VI – δ; VII – δ + Ж; VIII – δ + S2; IX – Ж + S2; X – Ж + S2; XI – Ж + Mg; XII – Mg + S2.
3.
| № | Состав, % В | Кол-во фаз | Наименование фаз | Состав каждой фазы, %В | Относит. кол-во каждой фазы, % | Т крист. | F | |
| Тн | Тк | |||||||
| 1 | 3 | 1 | α | 3 | 100 | 1090 | 950 | 2-1+1=2 |
| 2 | 15 | 3 | α | 8 | Ж=δ=α | 930 | 730 | 2-3+1=0 |
| Ж | 21 | |||||||
| δ | 30 | |||||||
| 3 | 33 | 1 | δ | 33 | 100 | 820 | 820 | 2-1+1=2 |
| 4 | 65 | 1 | S2 | 65 | 100 | 580 | 580 | 2-1+1=2 |
| 5 | 85 | 2 | S2 | 65 | 43 | 490 | 490 | 2-2+1=1 |
| Mg | 100 | 57 | ||||||
Расчет точки 5
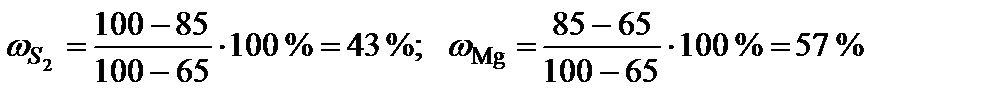
Задачи для решения
211.

212.
213.

214.

215.

216.

217.

218.

219.

220.

221.

222.

223.

224.

225.
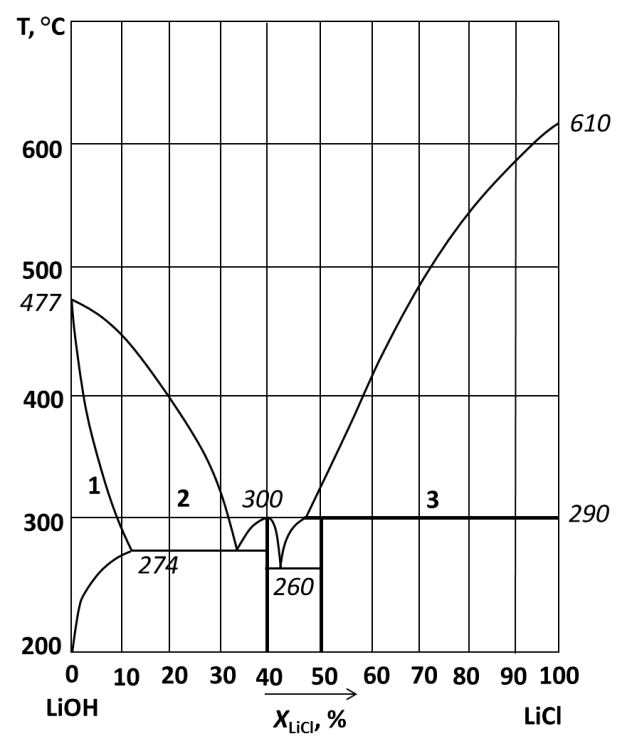
226.

227.

228.
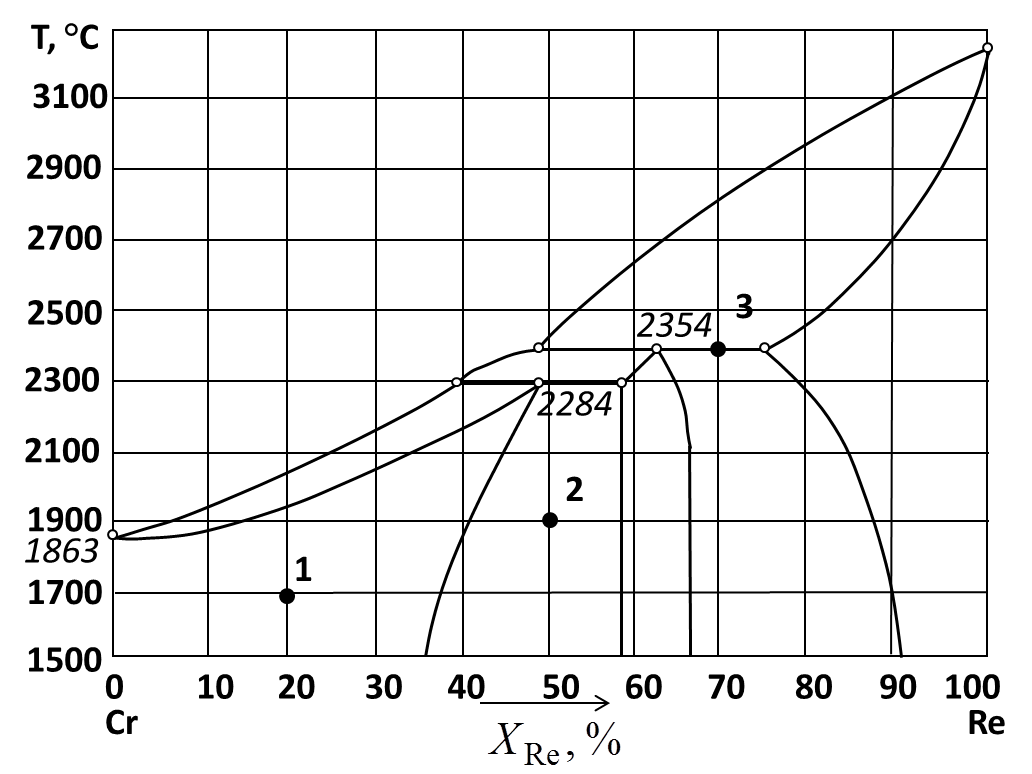
229.

230.

231.

232.

233.

234.

235.

236.

237.

238.

239.

240.

Дата: 2019-03-05, просмотров: 697.