Краткие теоретические сведения
Химическая термодинамика позволяет определить константу равновесия при какой-либо температуре, если известны константы равновесия при другой температуре и тепловой эффект реакции с применением интегральной формы уравнения изобары химической реакции

Уравнение изобары применимо для узкого температурного интервала и широко применяется для оценки констант гидролиза или диссоциации при нагревании растворов, а также для расчета изменения произведения растворимости в зависимости от температуры раствора.
Для расчета константы равновесия при заданной температуре в достаточно широком температурном интервале применяют метод Темкина-Шварцмана или метод приведенных энергий Гиббса. По методу Темкина-Шварцмана вычисляют энергию Гиббса при заданной температуре по уравнению
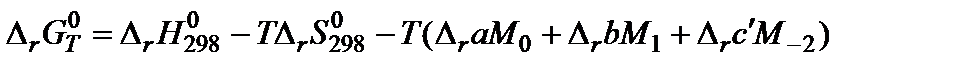
В этой формуле М0, М1, М-2 – заранее рассчитанные численные значения, являющиеся частью зависимости теплоемкости от температуры.
После расчета энергии Гиббса вычисляют константу равновесия по формуле
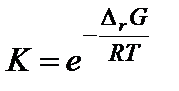 .
.
Поэтому следует обратить внимание на размерность!!! Энергия Гиббса должна быть выражена в Дж/моль!
По методу приведенных энергий Гиббса вычисляют константу равновесия по формуле
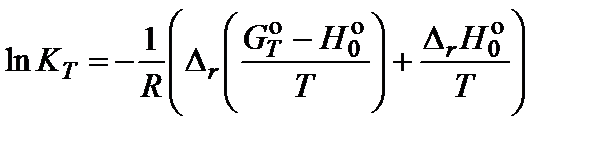
Значения 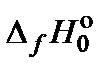 (энтальпии при абсолютном нуле) и
(энтальпии при абсолютном нуле) и 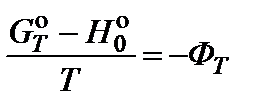 (приведенной энергии Гиббса) приводятся в справочной литературе.
(приведенной энергии Гиббса) приводятся в справочной литературе.
Примеры решения задач
Применение уравнения изобары
Пример 4. Вычислить значение константы гидролиза карбоната натрия по первой ступени при 25 и 90°С.
Решение. 1. Составить ионное уравнение первой ступени гидролиза карбонат-иона
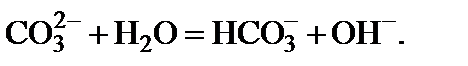
2. Составить таблицу справочных данных, необходимых для расчета:
| Компонент | 
| 
| 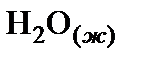
| 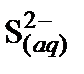
|
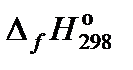 , кДж/моль , кДж/моль
| –230,02 | –17,57 | –285,83 | 32,64 |
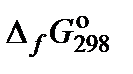 , кДж/моль , кДж/моль
|
3. Вычислить изменение энергии Гиббса реакции гидролиза при 25°С
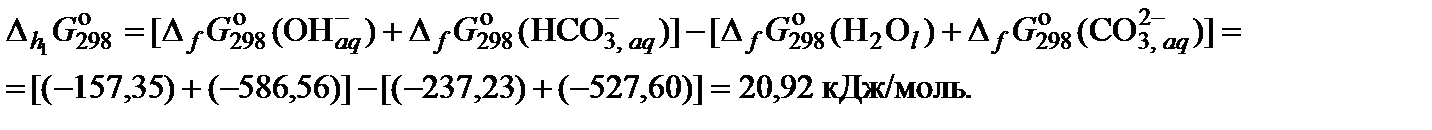
4. Вычислить значение константы гидролиза карбонат-иона по первой ступени при 25°С
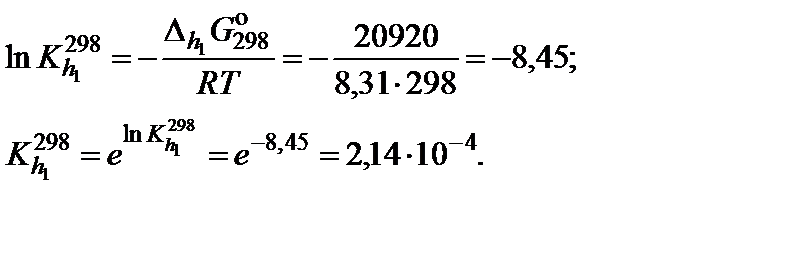
5. Вычислить тепловой эффект реакции гидролиза
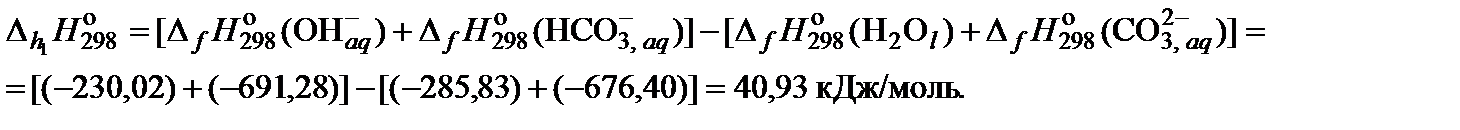
6. По уравнению изобары химической реакции вычислить константу гидролиза при 90°С
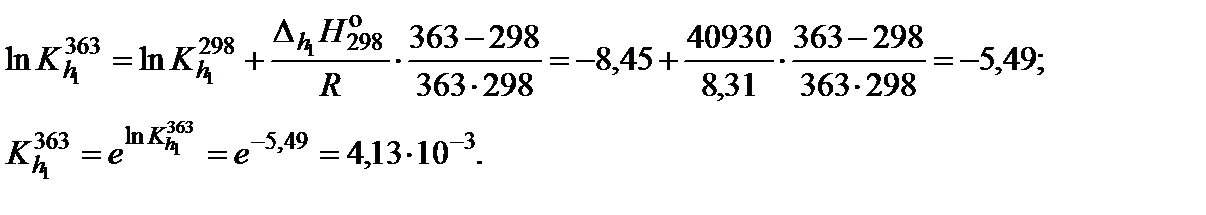
Метод Темкина-Шварцмана
Пример 5. Вычислить энергию Гиббса реакции 4NH3 (г) + 5O2 (г) = 6H2O (г) + 4NO (г) при 850 K.
Решение. 1. Составить таблицу справочных данных, необходимых для расчета:
| Компонент | NH3 (г) | O2 (г) | H2O (г) | NO (г) |
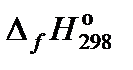 , кДж/моль , кДж/моль
| −45,94 | 0 | −241,81 | 91,26 |
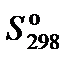 , Дж·моль−1·K−1 , Дж·моль−1·K−1
| 192,66 | 205,04 | 188,72 | 210,64 |
| a, Дж·моль−1·K−1 | 29,80 | 31,46 | 30,00 | 29,58 |
| b·103, Дж·моль−1·K−1 | 25,48 | 3,39 | 10,71 | 3,85 |
| c’·10−5, Дж·моль−1·K−1 | −1,67 | −3,77 | 0,33 | −0,59 |
2. Составить уравнение для расчета теплового эффекта реакции при 298 K и произвести необходимые вычисления:
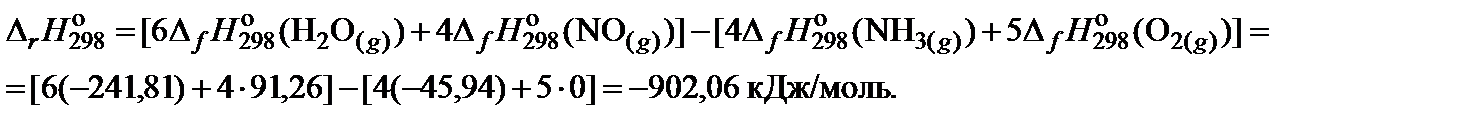
3. Составить уравнение для расчета изменения энтропии реакции в соответствии с законом Гесса и произвести необходимые вычисления:
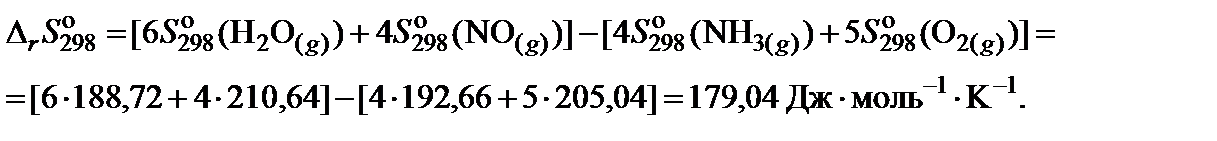
4. Пользуясь законом Гесса, найти изменение коэффициентов теплоемкости в ходе процесса:
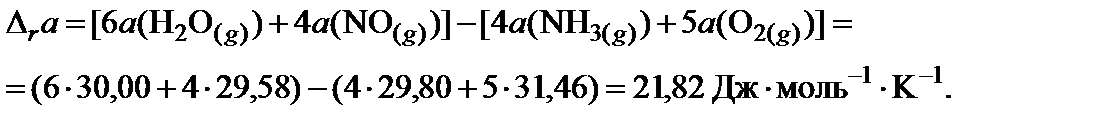
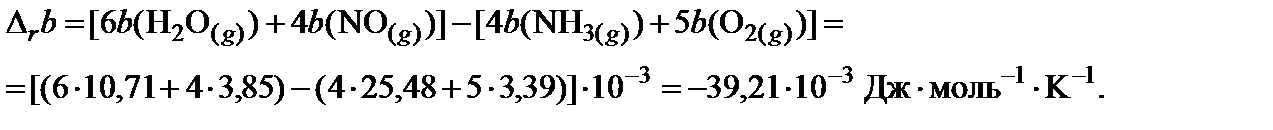
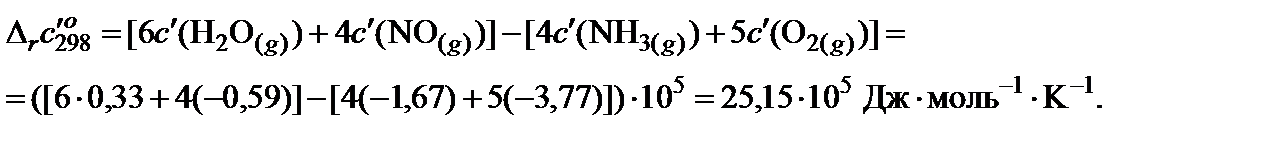
5. В таблице 45 краткого справочника физико-химических величин находят значения интегралов М0, М1 и М‒2 при температуре 800 K и 900 K. Величины для 850 K находят как среднее арифметическое для значений температуры 800 и 900 K.
| T, K | M0 | M1∙10‒3 | M2∙10‒6 | M‒2∙105 |
| 800 | 0,3597 | 0,1574 | 0,0733 | 0,2213 |
| 900 | 0,4361 | 0,2012 | 0,1004 | 0,2521 |
| 850 | 0,3979 | 0,1793 | 0,2376 |
6. Подставить данные в расчетную формулу:
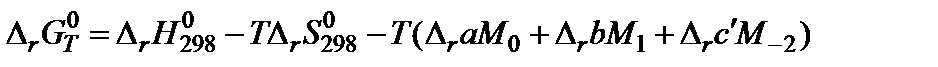 :
:
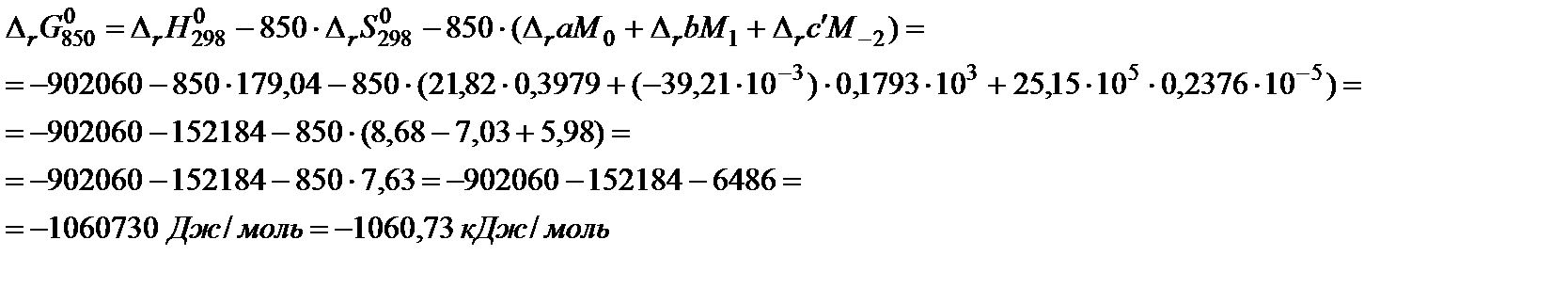
7. Вычислить константу равновесия по формуле:
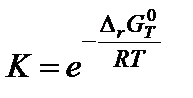 ;
; 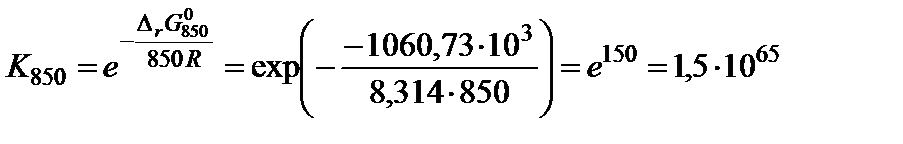
Дата: 2019-03-05, просмотров: 624.