Краткие теоретические сведения
Для определения состава системы при установившемся равновесии, а следовательно, и выхода продукта реакции необходимо знать константу равновесия и состав исходной смеси.
Примеры решения задач
Пример 7. Определить степень диссоциации иодоводорода на водород и иод
2HI(g) = I2(g) + H2(g)
при температуре 693 K и давлении 1 атм., если константа равновесия реакции в данных условиях равна 0,02.
Обозначим степень диссоциации иодоводорода через α.
1 .Баланс реакции:
2HI(g) = I2(g) + H2(g)
| Вещество | HI | I2 | H2 |
| Было: | n | 0 | 0 |
| Реакция: | –nα | nα/2 | nα/2 |
| Итого: | n – nα | nα/2 | nα/2 |
Пусть до начала реакции в системе было n моль HI.
Тогда на момент равновесия прореагировало nα моль этого вещества.
Согласно уравнению реакции, из 2 моль HI образуется по 1 моль H2 и I2.
Следовательно, если на момент равновесия в реакцию вступает nα моль HI, то образуется по 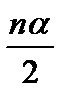 моль H2 и I2.
моль H2 и I2.
2. Определить равновесные мольные доли компонентов системы по формуле:
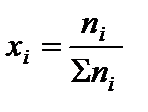 ,
,
где ni – количество вещества отдельного компонента системы; 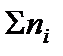 – суммарное количество вещества всех компонентов системы,
– суммарное количество вещества всех компонентов системы,
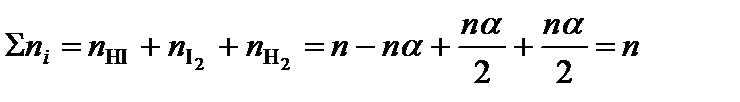 .
.
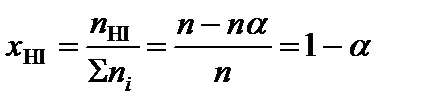 ;
;
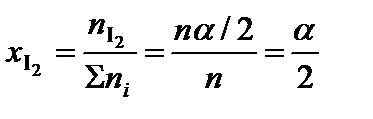 ;
;
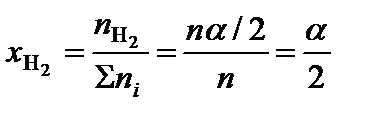 .
.
3. Определить равновесные парциальные давления компонентов системы согласно формуле:
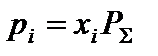 ,
,
где 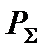 – общее давление в системе, атм.
– общее давление в системе, атм.
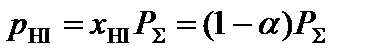 ;
;
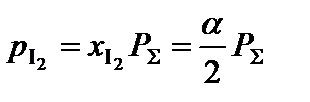 ;
;
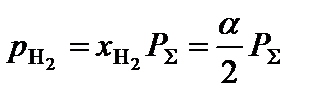 .
.
4. Составить уравнение константы равновесия процесса диссоциации иодоводорода
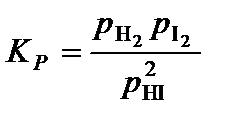 ,
,
и подставить в полученное уравнение определенные в п. 3 парциальные давления компонентов:
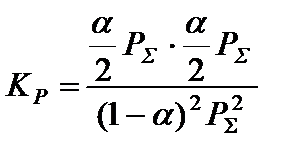 ,
,
упростить полученное уравнение:
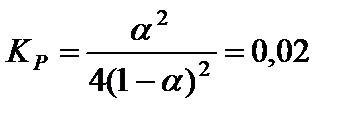
и решить его относительно α:
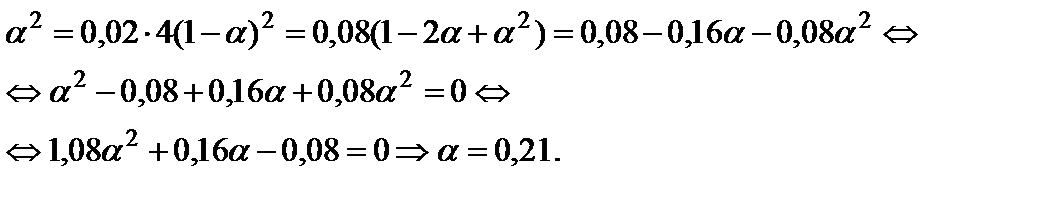
Пример 8. Вычислить состав равновесной смеси, образующейся при протекании реакции
C2H2(g) + N2(g) = 2HCN(g),
если процесс проводили при температуре 1500 K и давлении 1 атм. Константа равновесия реакции в данных условиях составляет 1,05·10−1. Для проведения реакции было взято 1 моль ацетилена и 1 моль азота.
Решение. Обозначим степень превращения реакции через α.
1.Составить баланс реакции:
С2Н2(g) + N2(g) = 2HCN(g)
| Вещество | С2Н2 | N2 | HCN |
| Было: | 1 | 1 | 0 |
| Реакция: | –α | –α | 2α |
| Итого: | 1–α | 1–α | 2α |
2. Определить равновесные мольные доли компонентов системы:
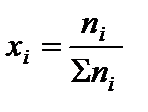 ,
,
где ni – количество вещества отдельного компонента системы; 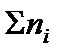 – суммарное количество вещества всех компонентов системы:
– суммарное количество вещества всех компонентов системы:
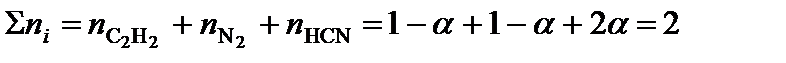 ;
;
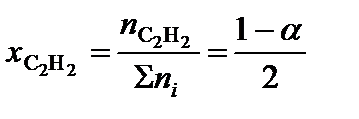 ;
;
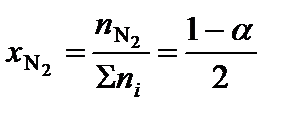 ;
;
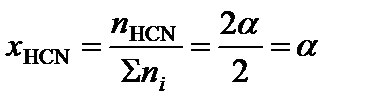 .
.
3. Определить равновесные парциальные давления компонентов системы согласно формуле:
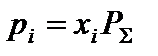 ,
,
где 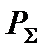 – общее давление в системе, атм.
– общее давление в системе, атм.
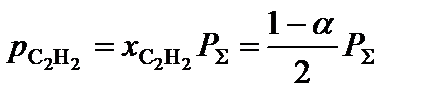 ;
;
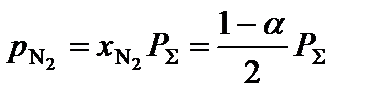 ;
;
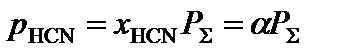 .
.
4. Составить уравнение константы равновесия процесса диссоциации иодоводорода,
 ,
,
подставить в полученное уравнение определенные в п.3 парциальные давления компонентов,
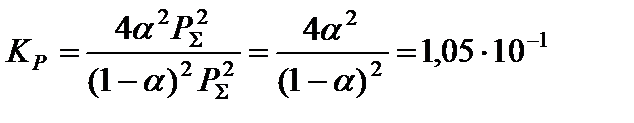
и решить его относительно α:
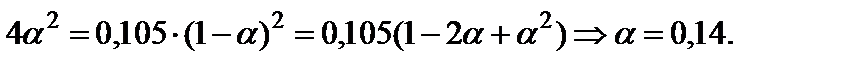
5. Вычислить равновесный состав системы:
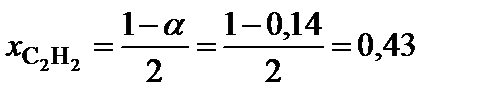 ;
;
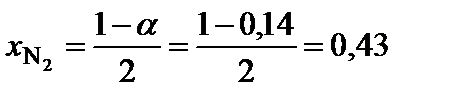 ;
;
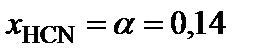 .
.
6. Выполнить проверку: сумма мольных долей компонентов системы должна быть равна единице.
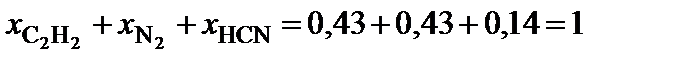 .
.
Задачи для решения
Дата: 2019-03-05, просмотров: 408.