Пример 6. Вычислить энергию Гиббса реакции 4NH3 (г) + 5O2 (г) = 6H2O (г) + 4NO (г) при 850 K.
Решение. Для вычисления константы равновесия методом приведенных энергий Гиббса следует воспользоваться данными таблицы 50 краткого справочника физико-химических величин.
Данная таблица содержит данные по приведенным энергиям Гиббса (ФТ) и изменениям энтальпии образования при 0 K, которые необходимы для данного расчета.
Значения приведенных энергий Гиббса рассчитаны для определенных температур. Для температуры 850 K берется среднее арифметическое между данными для температуры 800 и 900 K.
таблица справочных данных, необходимых для расчета:
| Компонент | NH3 (г) | O2 (г) | H2O (г) | NO (г) |
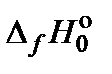 , кДж/моль , кДж/моль
| ‒39,22 | 0 | ‒238,91 | 90,15 |
|
| ||||
| 800 K | 194,46 | 205,16 | 188,84 | 210,07 |
| 900 K | 199,25 | 208,75 | 192,9 | 213,70 |
| 850 K | 196,86 | 206,96 | 190,87 | 211,90 |
2. Составить уравнение для расчета теплового эффекта реакции при 0 K и произвести необходимые вычисления:
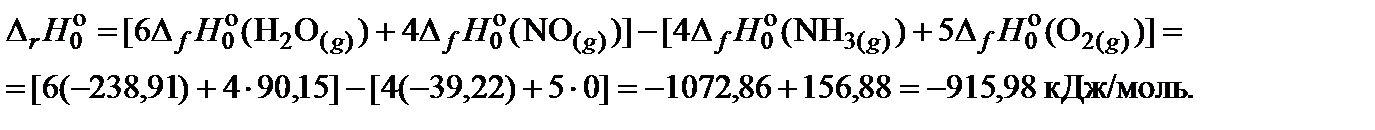
2. Составить уравнение для расчета приведенной энергии Гиббса реакции при 850 K и произвести необходимые вычисления:
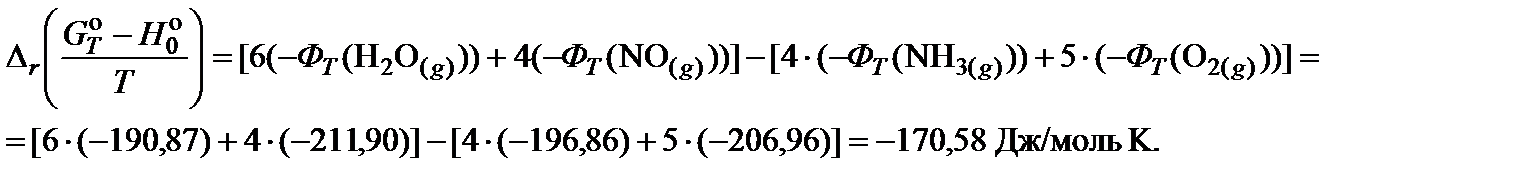
Вычислить значение логарифма константы равновесия по формуле:
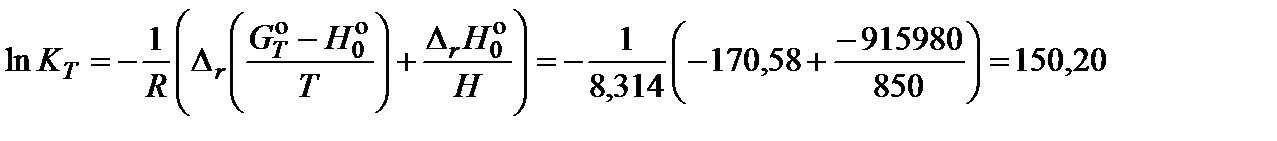
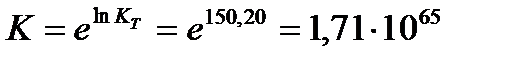
Задачи для решения
2.1. Вычислить константу равновесия реакции, протекающей в водном растворе при 25°С и заданной температуре.
| № | Вещество | Процесс | Т, °С | 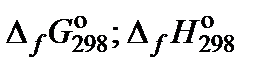 , кДж/моль , кДж/моль
|
| 61. | (СН3СOO)2Ba | гидролиз | 60 | 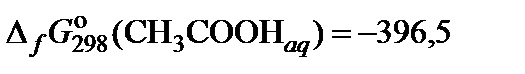
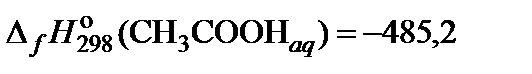
|
| 62. | Ag2CO3 | растворимость | 80 | См. краткий справочник |
| 63. | NH4NO3 | гидролиз | 80 | 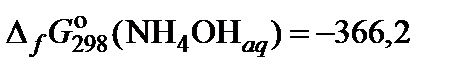
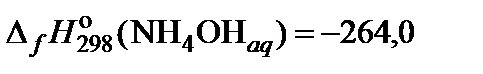
|
| 64. | Hg2CrO4 | растворимость | 90 | См. краткий справочник |
| 65. | Na3PO4 | гидролиз | 70 | См. краткий справочник |
| 66. | CaCO3 | растворимость | 60 | См. краткий справочник |
| 67. | Na2HPO3 | гидролиз | 90 | См. краткий справочник |
| 68. | CaSO4 | растворимость | 70 | См. краткий справочник |
| 69. | FeCl3 | гидролиз | 60 | 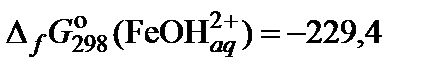
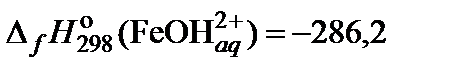
|
| 70. | PbCl2 | растворимость | 80 | 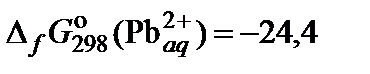
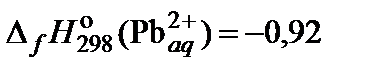
|
| 71. | MnCl2 | гидролиз | 70 | 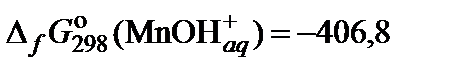
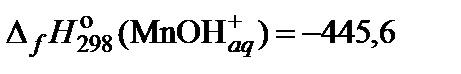
|
| 72. | Li3PO4 | растворимость | 90 | См. краткий справочник |
| 73. | Sn(NO3)2 | гидролиз | 80 | 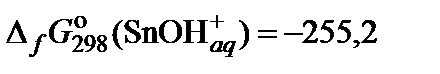
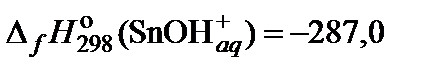
|
| 74. | PbI2 | растворимость | 80 | 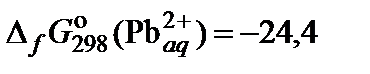
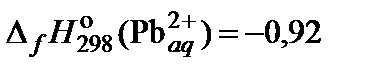
|
| 75. | Zn(NO3)2 | гидролиз | 70 | 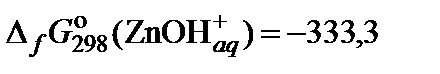
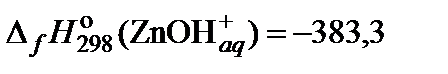
|
| 76. | HCOOK | гидролиз | 90 | 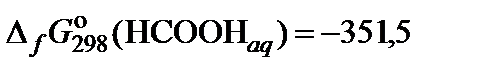
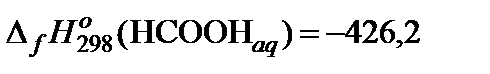
|
| 77. | K2C2O4 | гидролиз | 60 | См. краткий справочник |
| 78. | Са3(РО4)2 | растворимость | 60 | См. краткий справочник |
| 79. | Na2CO3 | гидролиз | 80 | |
| 80. | AgCN | растворимость | 80 | См. краткий справочник |
| 81. | KHCO3 | гидролиз | 70 | 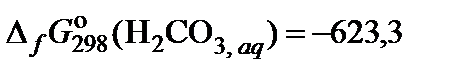
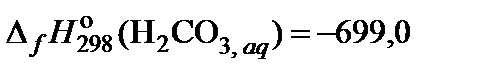
|
| 82. | BaSO3 | растворимость | 60 | См. краткий справочник |
| 83. | Na2S | гидролиз | 90 | См. краткий справочник |
| 84. | Zn(OH)2 | растворимость | 90 | См. краткий справочник |
| 85. | Na2SO3 | гидролиз | 60 | См. краткий справочник |
| 86. | CaC2O4 | растворимость | 70 | См. краткий справочник |
| 87. | NaNO2 | гидролиз | 80 | 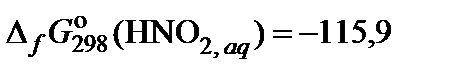
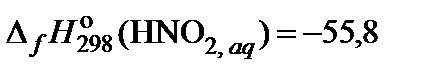
|
| 88. | BaCO3 | растворимость | 90 | См. краткий справочник |
| 89. | MgCO3 | растворимость | 70 | См. краткий справочник |
| 90. | Fe(OH)2 | растворимость | 70 | См. краткий справочник |
Вычислить константу равновесия реакции при заданной температуре методом Темкина-Шварцмана и по методу приведенных энергий Гиббса
| № | Реакция | Температура, °С |
| 91. | 2HBr (г) = H2 (г) + Br2 (г) | 827 |
| 92. | CO2 (г) + 4H2 (г) = CH4 (г) + 2H2O (г) | 402 |
| 93. | 2HCl (г) = Cl2 (г) + H2 (г) | 1227 |
| 94. | 2N2 (г) + O2 (г) = 2N2O (г) | 1227 |
| 95. | N2 (г) + O2 (г) = 2NO (г) | 1127 |
| 96. | 4HCl (г) + O2 (г) = 2H2O (г)+ 2Cl2 (г) | 430 |
| 97. | CO (г) + 3H2 (г) = CH4 (г) + H2O (г) | 427 |
| 98. | 2H2S (г) = 2H2 (г) + S2 (г) | 727 |
| 99. | H2 (г) + CO2 (г) = CO (г) + H2O (г) | 527 |
| 100. | 2H2O (г) = 2H2 (г) + O2 (г) | 1327 |
| 101. | 2CO2 (г) = 2CO (г) + O2 (г) | 1727 |
| 102. | 2SO2 (г) = 2O2 (г) + S2 (г) | 527 |
| 103. | 4HCl (г) + O2 (г) = 2H2O (г) + 2Cl2 (г) | 650 |
| 104. | C2H6 (г) = С2H4 (г) + H2 (г) | 627 |
| 105. | 3H2 (г) +N2 (г) = 2NH3 (г) | 527 |
| 106. | CH4 (г) + CO2 (г) = 2CO (г) + 2H2 (г) | 490 |
| 107. | 2CO2 (г) = 2CO (г) +O2 (г) | 1127 |
| 108. | CO (г) + H2O (г) = CO2 (г) +H2 (г) | 927 |
| 109. | 2HI (г) = H2 (г) +I2 (г) | 727 |
| 110. | 2NO2 (г) = 2NO (г) + O2 (г) | 727 |
| 111. | H2 (г) + CO (г) = HCOH (г) | 727 |
| 112. | 3CO (г) + 2H2O (г) = CH3OH (г) + 2CO2 (г) | 127 |
| 113. | CO2 (г) + 3H2 (г) = CH3OH (г) + H2O (г) | 627 |
| 114. | CO (г) + H2O (г) = CO2 (г) + H2 (г) | 727 |
| 115. | C2H5OH (г) = CH3CHO (г) + H2 (г) | 523 |
| 116. | 2SO3 (г) = 2SO2 (г) + O2 (г) | 1227 |
| 117. | 2NO2 (г) = N2 (г) + 2O2 (г) | 627 |
| 118. | 2HBr = H2 + Br2 | 727 |
| 119. | 2HI (г) = H2 (г) + I2 (г) | 927 |
| 120. | C2H6 (г) = C2H4 (г) + H2 (г) | 727 |
Дата: 2019-03-05, просмотров: 564.
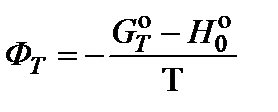 , Дж/моль∙K
, Дж/моль∙K