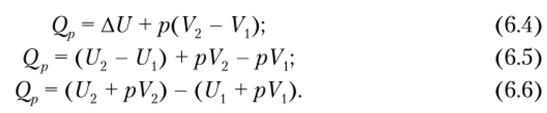В реальном газе между молекулами действуют силы притяжения и отталкивания. Силы притяжения обусловлены дипольным взаимодействием молекул. Некоторые молекулы могут представлять собой постоянные диполи. Для неполярных молекул основой притяжения является взаимодействие мгновенных осциллирующих диполей. Силы отталкивания обусловлены взаимодействием электронных оболочек молекул. Они проявляются в основном при сближении молекул и быстро убывают с увеличением расстояния между молекулами. Силы же притяжения наоборот преобладают при большом расстоянии между молекулами. Результирующая сила взаимодействия двух молекул равна сумме этих сил и имеет вид, изображенный на рис. 11.4 . При расстоянии между молекулами r = ro сила отталкивания равна силе притяжения и результирующая сила F = 0 . При расстоянии между молекулами r < ro преобладает сила отталкивания, при расстоянии r > ro преобладает сила притяжения.
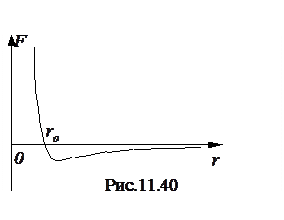
 Наличие этих сил проявляется в эффекте дросселирования газа, схема которого представлена на рис.11.5. Газ из сосуда A с высоким давлением перетекает в сосуд B с низким давлением через патрубок с пористой перегородкой 1. В патрубке помещены термометры, измеряющие температуры T1 и T2 газа до и после пористой перегородки. При таком расширении газ работу не совершает, тепло газу не передается и в согласии с первым началом термодинамики изменение внутренней энергии газа DU = 0. Следовательно, при дросселировании идеального газа его температура на должна изменяться: T1 = T2 . Внутренняя энергия реального газа складывается из кинетической энергии молекул Uк и потенциальной энергииих взаимодействия Uп ,
Наличие этих сил проявляется в эффекте дросселирования газа, схема которого представлена на рис.11.5. Газ из сосуда A с высоким давлением перетекает в сосуд B с низким давлением через патрубок с пористой перегородкой 1. В патрубке помещены термометры, измеряющие температуры T1 и T2 газа до и после пористой перегородки. При таком расширении газ работу не совершает, тепло газу не передается и в согласии с первым началом термодинамики изменение внутренней энергии газа DU = 0. Следовательно, при дросселировании идеального газа его температура на должна изменяться: T1 = T2 . Внутренняя энергия реального газа складывается из кинетической энергии молекул Uк и потенциальной энергииих взаимодействия Uп ,
т.е. U = Uк + Uп . При расширении газа межмолекулярные расстояния увеличиваются и взаимная потенциальная энергия молекул изменяется. Следовательно, должны изменяться их кинетическая энергия DUк и температура газа, причем т.к. DU = 0,то DUк = -DUп. Если при дросселировании газа преобладают силы притяжения между молекулами (r > ro) , то при этом будет совершаться работа против сил притяжения и потенциальная энергия молекул при увеличении объема газа увеличится, а значит, кинетическая энергия молекул и температура газа уменьшится. Такой эффект Джоуля-Томсона называют положительным. Если между молекулами газа преобладают силы отталкивания, то газ при дросселировании нагревается, и эффект называют отрицательным. Устройства, использующие положительный эффект Джоуля-Томсона, позволили впервые получить сжиженные газы.
Одним из основных понятий в термодинамике является система. Системой называют тело или совокупность взаимодействующих тел, фактически или мысленно выделяемых из окружающей среды. Исходя из характера взаимодействия различных систем с окружающей средой их подразделяют на открытые, закрытые и изолированные. Открытая система обменивается с окружающей средой энергией и веществом. Закрытой называют систему, в которой отсутствует обмен вещества с окружающей средой, но она может обмениваться с ней энергией. Изолированная система характеризуется отсутствием обмена энергией и веществом с окружающей средой. Понятие изолированной системы является идеальным (абстрактным), так как на практике не существует материала, который абсолютно не проводил бы теплоту. Таким образом, абсолютно изолированных систем в природе нет. Система, состоящая из нескольких фаз, называется гетерогенной, однофазная система — гомогенной. Реакции, протекающие в гомогенной системе, развиваются во всем ее объеме и называются гомогенными (например, газообразное вещество реагирует с газообразным). Реакции, происходящие на границе раздела фаз, называются гетерогенными (например, взаимодействие твердого вещества с жидким или газообразным). Состоянием системы называют совокупность свойств системы. Процесс — это переход системы из одного состояния в другое. Химические процессы сопровождаются выделением или поглощением теплоты. Различают экзотермические реакции, идущие с выделением теплоты, и эндотермические реакции, протекающие с поглощением теплоты. Количество теплоты, выделенной или поглощенной в процессе данной реакции, называется тепловым эффектом. Основной закон термохимии - закон Г. И. Гесса. Он формулируется так: тепловой эффект процесса зависит только от природы и состояния исходных веществ и конечных продуктов и не зависит от пути процесса, т.е. от числа и характера промежуточных стадий. Химические процессы обычно протекают либо изобар- но (при постоянном давлении), либо изохорпо (при постоянном объеме), либо изотермически (при постоянной температуре). Тепловой эффект химического процесса является следствием изменения в самой системе внутренней энергии U или энтальпии II. Внутренняя энергия данной системы представляет собой общий запас энергии, складывающийся из поступательного и вращательного движений молекул, энергии внутримолекулярных колебаний атомов и атомных групп, энергии движения электронов в атомах, энергии межъядерного и внутриядерного движения и т.п. Энтальпия подобно объему, давлению, температуре и внутренней энергии является функцией (характеристикой) состояния системы. Согласно первому началу термодинамики общий запас внутренней энергии системы остается постоянным до тех пор, пока отсутствует тепловой обмен с окружающей средой. Если системе извне сообщить дополнительную тепловую энергию, то за счет поглощения этой теплоты Q система из одного состояния переходит в другое. Поглощенная теплота расходуется на приращение внутренней энергии Д U и на совершение работы А против внешних сил:
Уравнение (6.1) выражает закон сохранения энергии. Допустим, что газ находится в цилиндре, закрытом поршнем, и некоторое время его нагревают. Внутренняя энергия U возрастает, газ расширяется, совершая при этом работу подъема поршня. При химических реакциях под работой против внешних сил обычно подразумевается работа против внешнего давления. Если процесс осуществляется при постоянном давлении, то совершаемая системой работа равна произведению давления р на изменение объема системы A V при переходе из одного состояния в другое: Если процесс изохорный (постоянный объем), т.е. нс происходит изменения объема, то А = 0. Здесь переход системы из одного состояния в другое выражается уравнением
Следовательно, если химическая реакция протекает при постоянном объеме, то выделение или поглощение теплоты Qv связано с изменением внутренней энергии системы. При изобарном процессе тепловой эффект Q равен
Энтальпию можно представить как энергию расширенной системы, поэтому Если давление постоянное, то подводимая к системе теплота расходуется на увеличение энтальпии системы, следовательно:
Из уравнений (6.3)—(6.8) следует, что при изохорном процессе энергетический эффект реакции равен изменению внутренней энергии системы (Qv= At/), а при изобарном процессе этот эффект равен изменению энтальпии системы (Q = АН). Так как большинство химических процессов протекает изобарно, то обычно энергетические эффекты реакций определяют по изменению величины энтальпии системы. Если реакции протекают либо с поглощением, либо с выделением теплоты, то тепловой эффект необходимо характеризовать как абсолютным значением, так и знаком. При экзотермических процессах теплота выделяется, следовательно, уменьшаются энтальпия и внутренняя энергия, поэтому значения АН и АН принято обозначать отрицательным знаком. При эндотермических реакциях теплота поглощается, следовательно, энтальпия и внутренняя энергия увеличиваются и АII и АН обозначают положительным знаком. Для сравнения энергетических эффектов реакций соответствующие термохимические расчеты принято относить к 1 молю вещества и стандартным условиям (давление 101 325 Па, температура 25°С (298,15 К)). Поэтому стандартные тепловые эффекты обозначают как АН°т и AU.m. Уравнения реакций, в которых указывается тепловой эффект, называются термохимическими уравнениями. В этих уравнениях необходимо указывать фазовое состояние и полиморфную модификацию исходных веществ и продуктов реакции, применяя следующие условные обозначения: г — газовое; ж — жидкое; к — кристаллическое; т — твердое; р — растворенное. Расчеты в термохимических уравнениях производятся на основании закона Г. И. Гесса. Зная стандартные теплоты образования, легко рассчитать тепловые эффекты для любой реакции. Из закона Гесса вытекает ряд следствий, из которых наибольшее значение имеют два следующих. o 1. Тепловой эффект реакции равен сумме теплот образования (АHlAp или Д/ /7) продуктов реакции за вычетом суммы теплот образования исходных веществ. o 2. Тепловой эффект реакции равен сумме теплот сгорания (Д//сшр) исходных веществ за вычетом суммы теплот сгорания продуктов реакции. |
Дата: 2019-03-05, просмотров: 378.