|
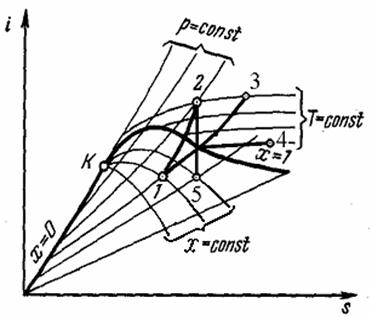
| Рис . Термодинамические процессы водяного пара на i, s-диаграмме: 1 – 2 – изохорный процесс, 1 – 3 - изобарный процесс, 1 – 4 - изотермный процесс, 2 – 5 – адиабатный процесс |
Для анализа работы паросиловых установок существенное значение имеют изохорный, изобарный, изотермический и адиабатный процессы. Политропные процессы не рассматриваются, т.к. водяной пар не соответствует свойствам идеального газа.
Термодинамические процессы водяного пара очень наглядно изображаются на i, s-диаграмме (рис ). Процесс = горизонтальная прямая. Для удобства нанесены линии равных давлений, температур и степеней сухости. На рис. показано протекание изохорного, изобарного, изотермического и адиабатного процессов на i, s-диаграмме. Следует обратить внимание, что в области влажного пара линии изобар и изотерм совпадают.
По i, s-диаграмме можно выполнить приближённые расчеты этих процессов, поскольку значения подлежащих определению параметров считываются непосредственно с диаграммы.
Общий метод расчета по i, s-диаграмме состоит в следующем. По известным параметрам наносится начальное состояние рабочего тела, затем проводится линия процесса и определяются его параметры в конечном состоянии. Далее вычисляется изменение внутренней энергии, определяются количества теплоты и работы в заданном процессе.
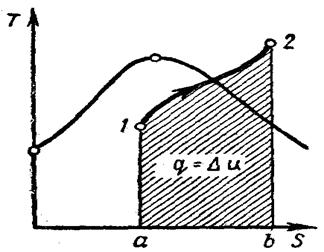
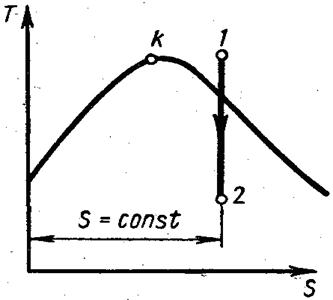
Точные расчёты проводятся с помощью таблиц воды и водяного пара. При расчётах важно знать в какой зоне находятся начальные и конечные значения параметров. Это удобно определять на Т – s диаграмме. Из диаграммы Т – s видно, что количество теплоты равно площади под кривой процесса.
Для любой точки на Т - s-диаграмме
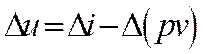 (4-32)
(4-32)
или
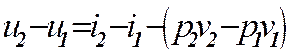 ,
,
|
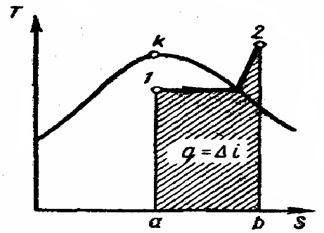
| Рис. 4.9\ Изохорный процесс водяного пара на Т – s - диаграмме |
Изохорный процесс(рис. 4.9).
Из рисунка видно, что нагреванием при постоянном объеме влажный пар можно перевести в сухой насыщенный и перегретый. Охлаждением его можно сконденсировать, но не до конца, так как при каком угодно низком давлении над жидкостью всегда находится некоторое количество насыщенного пара. Это означает, что изохора не пересекает нижнюю пограничную кривую.
В изохорном процессе работаl = 0,
поэтому подведенная теплота расходуется (в соответствии с первым законом термодинамики 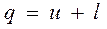 ) на увеличение внутренней энергии пара:
) на увеличение внутренней энергии пара:
q = u2-u1 (4.33)
|
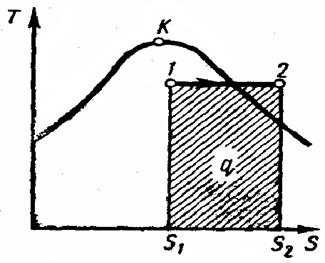
| Р»с. 4.10. Изобарный процесс водяного пара на Т – s - диаграмме |
Изобарный процесс (рис. 4.10).
При подводе теплоты к влажному насыщенномy пару его степень сухости увеличится и он (при постоянной в этой области температуре) переходит в сухой, а при дальнейшем подводе теплоты — в перегретый пар (температура пара при этом растет). При отводе теплоты влажный пар конденсируется при Ts = const. Полученная в процессе теплота рав-разности энтальпий:
q= i2-i1 (4.34)
Работа процесса подсчитывается по формуле
l= p(v2 -v1). (4.35)
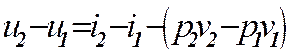 .
.
|
| Рис. 4.11. Изотермический процесс водяного пара на Т –s -диаграмме |
Изотермный процесс (рис. 4.11). Внутренняя энергия водяного пара в процессе Т = const не остается постоянной (как у идеального газа), так как изменяется ее потенциальная составляющая.
Количество полученной в изотермическом процессе теплоты равно
q = T(s2 — s1). (4.36)
Работа расширения определяется из первого закона термодинамики:
l = q — Δu (4.37)
Величина Δu находится по формуле
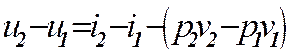 .
.
|
| Рис. 4.12. Адиабатный процесс водяного пара на Т – s - диаграмме |
Адиабатный процесс (рис. 4.12).
При адиабатном расширении давление и температура пара уменьшаются и перегретый пар становится сначала сухим, а затем влажным.
q = 0.
Работа адиабатного процесса определяется выражением
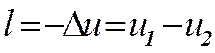
Внутренняя энергия
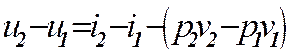 .
.
В области перегретого пара k = 1.3, в области влажного пара, включая верхнюю и нижнюю пограничные кривые k = 1,035+0,1 х.
12 влажный воздух: область применения, абсолютная и относительная влажность, влагосодержание, точки росы, id - диаграмма
Величина, характеризующая содержание водяных паров в различных частях атмосферы называется влажностью воздуха.
Абсолютная влажность измеряют плотность водяного пара Pа, находящегося в воздухе, или его давлением P (количественная оценка влажности).
Относительная влажность – выраженное в процентах отношение абсолютной влажности к давлению насыщенного пара при данной температуре.
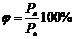
Точка росы – температура, при которой пар, находящийся в воздухе, становиться насыщенным. Точка росы определяется гигрометром, психрометром.
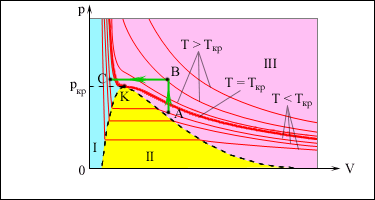
В закрытом сосуде жидкость и ее пар могут находиться в состоянии динамического равновесия, когда число молекул, вылетающих из жидкости, равно числу молекул, возвращающихся в жидкость из пара, т. е. когда скорости процессов испарения и конденсации одинаковы. Такую систему называют двухфазной. Пар, находящийся в равновесии со своей жидкостью, называют насыщенным.Число молекул, вылетающих с единицы площади поверхности жидкости за одну секунду, зависит от температуры жидкости. Число молекул, возвращающихся из пара в жидкость, зависит от концентрации молекул пара и от средней скорости их теплового движения, которая определяется температурой пара. Отсюда следует, что для данного вещества концентрация молекул пара при равновесии жидкости и ее пара определяется их равновесной температурой. Установление динамического равновесия между процессами испарения и конденсации при повышении температуры происходит при более высоких концентрациях молекул пара. Так как давление газа (пара) определяется его концентрацией и температурой, то можно сделать вывод: давление насыщенного пара p0 данного вещества зависит только от его температуры и не зависит от объема. Поэтому изотермы реальных газов на плоскости (p, V) содержат горизонтальные участки, соответствующие двухфазной системе (рис. ).
|
| . Изотермы реального газа. Область I – жидкость, область II – двухфазная система «жидкость + насыщенный пар», область III – газообразное вещество. K – критическая точка. |
При повышении температуры давление насыщенного пара и его плотность возрастают, а плотность жидкости уменьшается из-за теплового расширения. При температуре, равной критической температуре Tкр для данного вещества, плотности пара и жидкости становятся одинаковыми. При T > Tкр исчезают физические различия между жидкостью и ее насыщенным паром.
Если изотермически сжимать ненасыщенный пар при T < Tкр, то его давление будет возрастать, пока не станет равным давлению насыщенного пара. При дальнейшем уменьшении объема на дне сосуда образуется жидкость и устанавливается динамическое равновесие между жидкостью и ее насыщенным паром. С уменьшением объема все большая часть пара конденсируется, а его давление остается неизменным (горизонтальный участок на изотерме). Когда весь пар превращается в жидкость, давление резко возрастает при дальнейшем уменьшении объема вследствие малой сжимаемости жидкости.
Ненасыщенный пар можно теоретически описывать с помощью уравнения состояния идеального газа при обычных для реальных газов ограничениях: давление пара должно быть не слишком велико (практически p ≤ (106–107) Па), а его температура выше некоторого определенного для каждого вещества значения. К насыщенному пару также можно приближенно применять законы идеального газа при условии, что для каждой температуры T давление p0 насыщенного пара определяется по кривой равновесия p0(T) для данного вещества.
Давление p0 насыщенного пара очень быстро возрастает с ростом температуры T. Зависимость p0(T) нельзя получить из законов идеального газа. Давление газа при постоянной концентрации молекул растет прямо пропорционально температуре. В насыщенном паре при повышении температуры возрастает не только средняя кинетическая энергия движения молекул, но и их концентрация. Поэтому давление насыщенного пара при повышении температуры возрастает быстрее, чем давление идеального газа при постоянной концентрации молекул.
Испарение может происходить не только с поверхности, но и в объеме жидкости. В жидкости всегда имеются мельчайшие пузырьки газа. Если давление насыщенного пара жидкости равно внешнему давлению (т. е. давлению газа в пузырьках) или превышает его, жидкость будет испаряться внутрь пузырьков. Пузырьки, наполненные паром, расширяются и всплывают на поверхность. Этот процесс называется кипением. Таким образом, кипение жидкости начинается при такой температуре, при которой давление ее насыщенных паров становится равным внешнему давлению.
В частности, при нормальном атмосферном давлении вода кипит при температуре 100 °С. Это значит, что при такой температуре давление насыщенных паров воды равно 1 атм. При подъеме в горы атмосферное давление уменьшается, и поэтому температура кипения воды понижается (приблизительно на 1 °С на каждые 300 метров высоты). На высоте 7 км давление составляет примерно 0,4 атм, и температура кипения понижается до 70 °С.
В герметически закрытом сосуде жидкость кипеть не может, т. к. при каждом значении температуры устанавливается равновесие между жидкостью и ее насыщенным паром. По кривой равновесия p0(T) можно определять температуры кипения жидкости при различных давлениях.
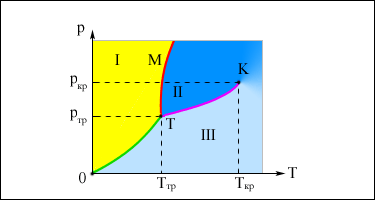
Изображенная на рис. картина изотерм реального газа описывает процессы испарения и конденсации, т. е. фазовый переход между газообразной и жидкой фазами вещества. На самом деле эта картина является неполной, т. к. из газообразного и жидкого состояний любое вещество может перейти в твердое состояние. При заданной температуре T термодинамическое равновесие между двумя фазами одного и того же вещества возможно лишь при определенном значении давления в системе. Зависимость равновесного давления от температуры называется кривой фазового равновесия. Примером может служить кривая равновесия p0(T) насыщенного пара и жидкости. Если кривые равновесия между различными фазами данного вещества построить на плоскости (p, T), то они разбивают эту плоскость на отдельные области, в которых вещество существует в однородном агрегатном состоянии – твердом, жидком или газообразном (рис. ). Изображенные в координатной системе (p, T) кривые равновесия называются фазовой диаграммой.
|
| . Типичная фазовая диаграмма вещества. K – критическая точка, T – тройная точка. Область I – твердое тело, область II – жидкость, область III – газообразное вещество. |
Кривая OT, соответствующая равновесию между твердой и газообразной фазами, называется кривой сублимации. Кривая TK равновесия между жидкостью и паром называется кривой испарения, она обрывается в критической точке K. Кривая TM равновесия между твердым телом и жидкостью называется кривой плавления.
Кривые равновесия сходятся в точке T, в которой могут сосуществовать в равновесии все три фазы. Эта точка называется тройной точкой.
Для многих веществ давление pтр в тройной точке меньше 1 атм ≈ 105 Па. Такие вещества при нагревании при атмосферном давлении плавятся. Например, тройная точка воды имеет координаты Tтр = 273,16 К, pтр = 6,02·102 Па. Эта точка используется в качестве опорной для калибровки абсолютной температурной шкалы Кельвина. Существуют, однако, и такие вещества, у которых pтр превышает 1 атм. Так для углекислоты (CO2) давление pтр = 5,11 атм и температура Tтр = 216,5 К. Поэтому при атмосферном давлении твердая углекислота может существовать только при низкой температуре, а в жидком состоянии при p = 1 атм она вообще не существует. В равновесии со своим паром при атмосферном давлении углекислота находится при температуре 173 К или –80 °С в твердом состоянии. Это широко применяемый «сухой лед», который никогда не плавится, а только испаряется (сублимирует).
Дата: 2019-03-05, просмотров: 436.