1. Определите класс ферментов, катализирующих следующие реакции: 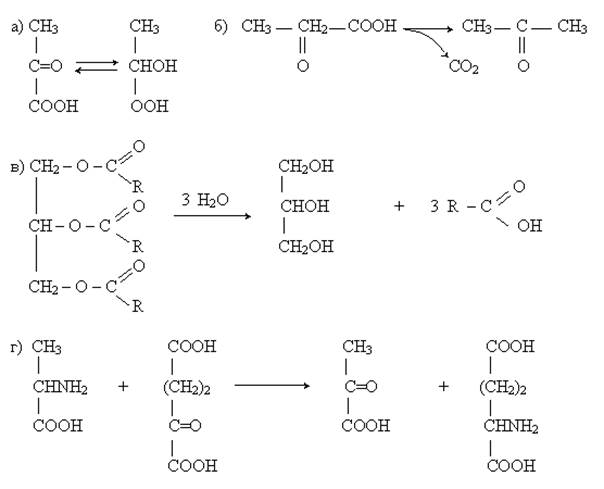
Ответ: а) класс оксидоредуктаз; б) класс лиаз; в) класс гидролаз; г) класс трансфераз.
2. Перечислите известные вам типы регуляции активности ферментов и подберите к каждому типу соответствующую схему на рисунке:
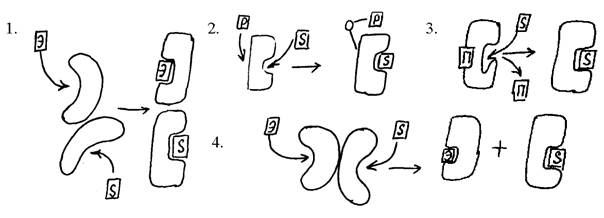
где S – субстрат, Э – эффектор, Р – донор фосфата, П – фрагмент полипептидной цепи.
Ответ: Типы регуляции: аллостерический, химическая модификация, взаимодействие белок-белок, конкурентное ингибирование. 1 –аллостерическая регуляция; 2 – химическая модификация (фосфорилирование-дефосфорилирование); 3 – ограниченный протеолиз; 4 – взаимодействие белок-белок.
3. Почему не рекомендуется применять ингибиторы пептидаз при пониженной свертываемости крови?
Ответ: ингибиторы пептидаз свертывающей системы приводят к снижению свертываемости. Так как свертываемость уже снижена, применять ингибиторы нельзя, так как их применение еще больше снизит свертываемость.
4. Один из методов лечения при отравлении метанолом состоит в том, что больному назначают этанол либо внутрь, либо внутривенно в количествах, которые у здорового человека вызывают интоксикацию. Объясните, почему такое лечение оказывается эффективным.
Ответ: метанол под действием алкогольдегидрогеназы превращается в ядовитый формальдегид. Этанол конкурирует с метанолом за активный центр данного фермента. Это позволяет использовать этанол для лечения.
5. При инкубации раствора гексокиназы в течение 12 минут при 450С фермент теряет 50% активности, но если гексокиназа инкубируется при 450С в присутствии субстрата глюкозы, то она утрачивает только 3% активности. Объясните, почему тепловая инактивация фермента замедляется в присутствии одного из субстратов?
Ответ: очевидно, субстрат является стабилизатором фермента, т.е. защищает фермент от тепловой денатурации.
Перечень практических умений по изучаемой теме
- умение работать с химической посудой и реактивами;
- умение работать с термостатом;
- умение работать с литературой (структурировать материал, выделять главное, формулировать вопросы и ответы).
Рекомендации по выполнению НИРС
Темы для рефератов
- Аллостерические ферменты;
- Химическая модификация. Значение.
- Значение ферментов в фармации.
Занятие №5
1. Тема «Значение ферментов в медицине и фармации. Контроль по теме «Ферменты»
2. Форма работы:
- подготовка к контрольному занятию;
- подготовка материалов по НИРС.
3. Перечень вопросов для самоподготовки по теме практического занятия:
- Что такое ферменты?
- В чем сходство ферментов и неорганических катализаторов?
- Чем различаются ферменты и неорганические катализаторы?
- Чем сложный фермент отличается от простого фермента?
- Что такое кофактор фермента? Химическое строение кофактора.
- Чем коферменты отличаются от простетических групп? Приведите примеры.
- Дайте понятие об активном центре фермента. Строение активного центра простых и сложных ферментов.
- Что такое специфичность ферментов? Какие виды специфичности ферментов Вы знаете? Чем обусловлена специфичность ферментов?
- Сформулируйте теории Фишера и Кошланда. Что они объясняют?
- Какова зависимость активности фермента от температуры?
- Как активность фермента зависит от рН среды?
- Дайте понятие об энергии активации. Как ферменты влияют на нее?
- Назовите факторы, влияющие на снижение энергии активации ферментативной реакции.
- Какова зависимость скорости ферментативной реакции от концентрации субстрата?
- Что такое максимальная скорость ферментативной реакции?
- Что такое константа Михаэлиса? Что она характеризует?
- Какова зависимость скорости ферментативной реакции от концентрации фермента?
- Как измерить активность фермента? В каких единицах выражается активность фермента?
- Дайте понятие об изоферментах.
- Назовите основные отличия изоферментов друг от друга.
- Какое значение имеют изоферменты в медицине?
- Дайте понятие об активаторах и ингибиторах ферментов.
- Дайте сравнительную характеристику обратимого и необратимого ингибирования.
- Приведите примеры необратимых ингибиторов. Имеют ли они физиологическое значение?
- Что такое конкурентное ингибирование?
- Дайте понятие о неконкурентных ингибиторах и механизме их действия.
- Приведите примеры конкурентных ингибиторов.
-Что такое аллостерический центр фермента. Механизм аллостерического изменения активности фермента.
- Какие вещества могут выступать в роли аллостерических регуляторов?
- Дайте понятие о химической модификации. Приведите примеры.
- Что такое ограниченный протеолиз? Чем он отличается от химической модификации?
- Расскажите об изменении активности ферментов путем взаимодействия "белок-белок".
- Дайте понятие о ключевых ферментах. Как они регулируются?
- Какова роль обратных связей в регуляции ферментативных цепей?
- По какому принципу классифицируются ферменты? Дайте характеристику каждому классу.
- Что такое энзимопатии? Виды энзимопатий.
- Назовите основные направления использования ферментов в медицине. Дайте им характеристику.
- Как в медицине используются конкурентные ингибиторы?
4. Самоконтроль по тестовым заданиям данной темы
Дата: 2019-03-05, просмотров: 593.