Пирсон ввел в рамках теории МО индекс абсолютной (химической) “жесткости” h и “мягкости” S:
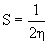 , h =
, h = 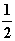 ( eНВМО – eВЗМО), (15)
( eНВМО – eВЗМО), (15)
где eНВМО, eВЗМО – энергия НВМО и ВЗМО, соответственно.
Приведенные в Таблице 3 значения абсолютной жесткости и мягкости позволяют исследовать влияние природы гетероатома и карбоксиарильного заместителя на реакционную способность и электронный спектр дианионных форм ксантеновых красителей. Моделирующие дигидроксиксантилиевый фрагмент красителя анионы IV, V являются мягкими нуклеофилами. Модели карбоксиарильных заместителей анионы VI, VII – жесткие нуклеофилы. Поэтому влияние карбоксиарильного заместителя должно сводиться к электростатическому эффекту. Поскольку оба фрагмента красителя заряжены отрицательно, их сближение должно сопровождаться сильным электростатическим отталкиванием, в результате которого энергии всех занятых и вакантных МО должны повышаться примерно на одинаковую величину. При этом существенного изменения структуры МО происходить не должно (что подтверждается данными Таблицы 2), и расстояния между энергетическими уровнями должны сохраняться. Действилельно, значения S и h красителей I, III и более простого аниона V, а также красителя II и аниона IV одинаковы. Таким образом, карбоксиарильный заместитель существенно повышая нуклеофильность красителей I-III, должен мало влиять на их спектр поглощения Действительно, батохромный (длинноволновой) сдвиг длинноволновой полосы спектра поглощения красителя I по сравнению с более простым анионом V составляет всего 0.054 эВ (5 нм). Замена гетероатома О à S приводит к небольшому уменьшению жесткости h (и увеличению мягкости S) красителя II по сравнению с красителем I., что коррелирует с наблюдаемым небольшим 0.09 эВ (18 нм) батохромным сдвигом длинноволновой полосы спектра поглощения красителя II по сравннению с I.
Таблица 5.3.
Абсолютная мягкость S и жесткость h дианионных форм некоторых ксантеновых красителей и более простых соединений соединений, эВ-1, эВ.
| Соединение a) | Качественная оценка | S | h |
| I. Дианион 9-(2-карбоксифенил)-3,6-дигидроксиксантилия | Мягкий | 0.154 | 3.248 |
| II. Дианион 9-(2-карбоксифенил)-3,6-дигидрокситиоксантилия | Мягкий | 0.160 | 3.132 |
| III. Дианион 9-(2-карбоксипиридил)-3,6-дигидроксиксантилия | Мягкий | 0.154 | 3.240 |
| IV. Анион 9Н-3,6-дигидрокситиоксантилия | Мягкий | 0.159 | 3.137 |
| V. Анион 9Н-3,6-дигидроксиксантилия | Мягкий | 0.154 | 3.241 |
| VI. Анион 2-карбоксифенила | Жесткий | 0.123 | 4.057 |
| VII. Анион 2-карбоксипиридина | Жесткий | 0.126 | 3.957 |
Примечание. a) Соединения I-VII представлены на Рис. 15.
Введение ИРС абсолютной жесткости h и мягкости S уничтожило четкую границу между жесткими и мягкими соединениями : каждой системе присущи оба эти свойства. Теперь понятие предпочтительности взаимодействий “жесткий-жесткий” и “мягкий-мягкий” заменяемся понятием предпочтительности взаимодействий соединений электрофильной и нуклеофильной природы с близкими значениями h и S.
Так, согласно значениям S и h (Таблица 4 ) в реакции электрофильного замещения у ароматического углерода :
С6Н5–X + СН3–Y à Y- С6Н4–X + С6Н4, X = H, СН3, NH2, OН; Y = NO2, F, I,
реакционная способность электрофильных молекул СН3–Y будет возрастать в ряду повышения мягкости СН3– NO2 > СН3–I > СН3–F, а нуклеофильных молекул С6Н5–X – в ряду увеличения жесткости С6Н5-СН3 > С6Н5-OН > С6Н5-NН2 > С6Н5-Н.
Таблица 4.
Абсолютная мягкость (S) и жесткость (h ) некоторых органических соединений алифатической и ароматической природы.
| Молекула | S | h |
НУКЛЕОФИЛЫ
ЭЛЕКТРОФИЛЫ
Функции Фукуи.
Абсолютные жесткость h и мягкость S связаны с локальной жесткостью h (r) и локальной мягкостью s(r) функцией Фукуи f(r) :
s(r) = f(r) * S, (16)
h = f(r) * h(r).
Согласно определению Парра и Янга функциями Фукуи называются функции, определяющие локальные изменения электронной плотности r (r) при увеличении f+(r) или уменьшении f-(r) числа электронов в системе :
f+(r) = r N0+1(r) - r N0(r), (17)
f-(r) = r N0(r) - r N0-1(r).
Использование карт функций Фукуи для определения наиболее предпочтительных мест электрофильной, нуклеофильной и радикальной атак на примере молекулы Н2СО представлено на Рис.17. Наиболее предпочтительным центром нуклеофильной атаки является атом углерода, которому соответствует глобальный максимум функции Фукуи f+(r), а электрофильной и радикальной атак - атом кислорода, которому соответствуют глобальные максимумы функции Фукуи f-(r) и функции Фукуи f0(r), соответственно.
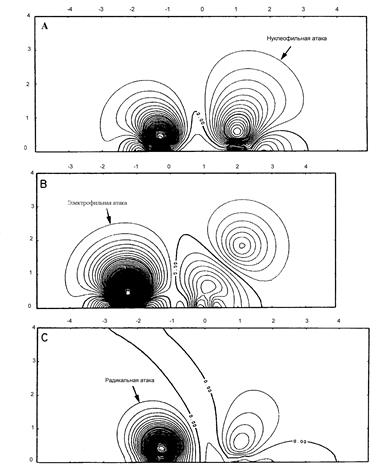
Рис. 17. Контурная карта функции Фукуи для молекулы Н2СО (интервал между контурами 0.005 а.е.) : А. f+(r) в плоскости, перпендикулярной плоскости молекулы Н2СО ; В. f-(r) в плоскости молекулы Н2СО ; С. f0(r) в плоскости, перпендикулярной плоскости молекулы Н2СО. Координата атома углерода на оси абсцис 1.015 а.е., атома кислорода –1.27 а.е.
На Рис. 18 представлены характеристики нуклеофильных свойств молекул монозамещенных бензолов на примере молекулы бензальдегида – карты функции Фукуи f-(r) и МЭП в плоскостях 1 и 2.
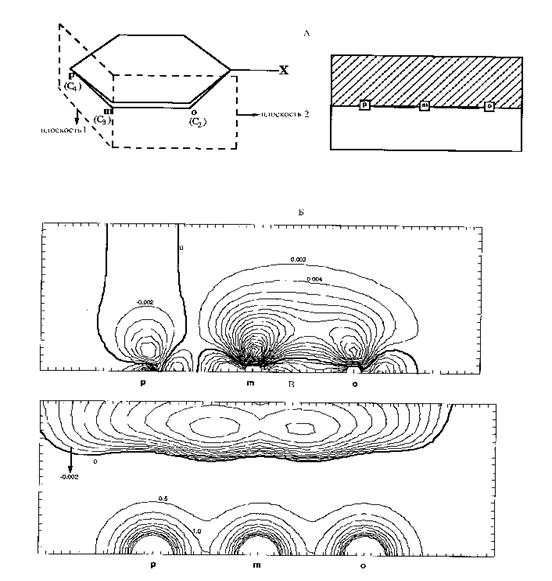
Рис. 18. Функция Фукуи и МЭП в молекулах монозамещенных бензолов: А. Схематический вид контурной карты функции Фукуи и МЭП (изображенный справа) получен совмещением сечений плоскостями 1 и 2. Плоскости 1 и 2 (изображенные слева) перпендикулярны плоскости ароматического кольца и проходят через атомы углерода в пара (р)- и мета (m)-положениях по отношению к заместителю Х (плоскость 1) и в мета (m)- и орто (о)-положениях (плоскость 2); Б. Контурная карта функции Фукуи f-(r) молекулы С6Н5-CHO в плоскостях 1 и 2. Контуры соединяют точки с одинаковыми значениями функции f-(r) : жирные линии - f-(r) = 0, отрицательные значения f-(r) уменьшаются, а положительные увеличиваются с интервалом между контурами 0.002 ; В. Контурная карта МЭП молекулы С6Н5-CHO в плоскостях 1 и 2. Контуры соединяют точки с одинаковыми значениями МЭП : жирные линии - МЭП = 0, отрицательные значения МЭП уменьшаются с интервалом между контурами 0.002, положительные - увеличиваются с интервалом между контурами 0.5.
Согласно карте функции Фукуи, электрофильная атака возможна по атомам углерода (m и о) в мета- и орто-положениях по отношению к заместителю Х = СНО, где значения функции f-(r) положительны. Мета-положение, более предпочтительно, так как здесь плотность контуров больше. Электрофильная атака по атому углерода в паро-положение положении (р) существенно затруднена : значения функции f-(r) в области атома р отрицательны. Теоретическая оценка относительной предпочтительности реакционных центров m > o >> p полностью совпадает с экспериментальной. Согласно карте МЭП относительная активность реакционных центров m >> p > o для атомов углерода в пара- и орто-положениях (р и о) противоречит эксперименту. Очевидно, молекула бензальдегида является существенно мягким соединением. Ее реакционную способность предсказывает карта функции Фукуи.
Дата: 2019-02-19, просмотров: 476.