Изложенные представления были развиты для реакций между идеальными газами. Однако они без существенных изменений могут быть перенесены на реакции в жидкой и твердой фазе: влияние среды учитывается непосредственным включением молекул растворителя или твердой матрицы в реагирующую систему. В континуальных моделях влияние окружающих молекул учитывается как внешнее поле и включается в гамильтониан системы как возмущение. В дискретных моделях уравнение Шредингера решается для, так называемой, супермолекулы, состоящей из реагирующей системы и определенного числа молекул растворителя. Последние составляют сольватные оболочки, число которых достаточно для достижения сходимости результата. В твердом теле учитывают некоторое количество частиц, достаточное для адекватного воспроизведения энергии уровня Ферми. Супермолекулярный подход с теоретической точки зрения является наиболее строгим, но с практической - малодоступным, так как требует больших затрат машинного времени.
Роль орбитальной симметрии
Часто для описания реакции достаточно сведений о ее стадиях, определяющих сбли-жение реагентов и тип переходного состояния. Метод молекулярных орбиталей (МО) играет здесь важную роль. Вудворд и Хоффман сформулировали принцип сохранения орбитальной симметрии (1965 г.), выполняющийся для реакций без промежуточных продуктов (согласованных реакций). Этот принцип позволяет в ряде случаев предсказы-вать, будет ли соединение А реагировать с соединением В, по какому пути пойдет реак-ция и каких продуктов следует ожидать. В этом подходе рассматриваются структура активных МО реагирующих веществ и знаки АО, составляющих МО.
Правило Вудворда-Хоффмана: реакция называется разрешенной по симметрии, если в ходе ее симметрия активных МО сохраняется.
К активным относятся все участвующие в реакции занятые и вакантные МО реагентов и продуктов. Деление реакций на разрешенные и запрещенные по симметрии осуществляется с помощью корреляционных диаграмм.
Правило Вудворда-Хофмана носит общий характер. Рассмотрим его применение к одной из реакций диенового синтеза (реакции Дильса-Альдера) –циклоприсоединения цис-бутадиена к этилену, в результате которой образуется циклогексен. Эта реакция относится к числу перициклических, т.е. таких согласованных реакций, которые протекают с образованием циклических (“замкнутых”) переходных состояний, играющих определяющую роль.
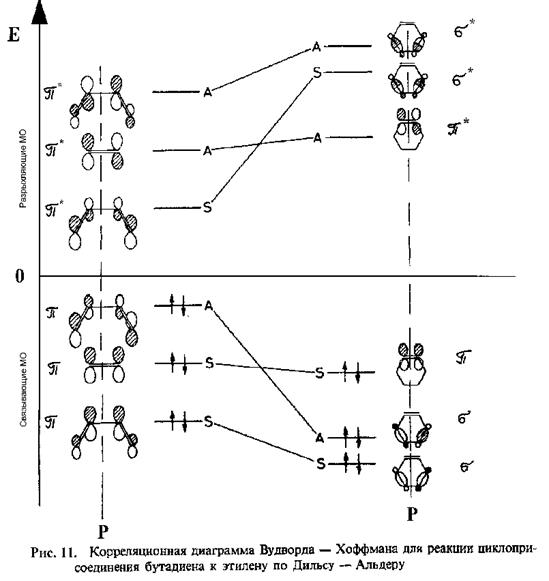
Симметрия предреакционного комплекса реакции циклоприсоединения цис-бутадиена к этилену (Рис. 10) определяется плоскостью симметрии Р. Рассмотрим верхние занятые p и нижние вакантные p * МО этого комплекса. Разделим их на симметричные (S) и антисимметричные (A) относительно плоскости Р и расположим в порядке возрастания энергии, определенном расчетом (Рис. 11). Классифицируем таким же образом активные МО продукта реакции циклогексена: верхние занятые p , s и нижние вакантные p *, s * МО вновь образованных двойной и двух ординарных СС связей (Рис. 11). Согласно Вудворду и Хофману, корреляционную диаграмму взаимодействия между реагентами и продуктом следует строить простым соединением МО с одинаковой симметрией ( S ® S и A ® A ), учитывая, что разность энергий МО должна быть минимальна. Если это возможно и ни одна из соединяющих линий не пересекает нулевого уровня (правило непересечения), то реакция “разрешена” по симметрии. В результате, получаем корреляционную диаграмму Вудворда-Хоффмана для реакции Дильса-Альдера, на которой связывающие МО реагентов взаимодействуют только со связывающими МО продукта, а разрыхляющие МО реагентов – только с разрыхляющими МО продукта – реакция разрешена.
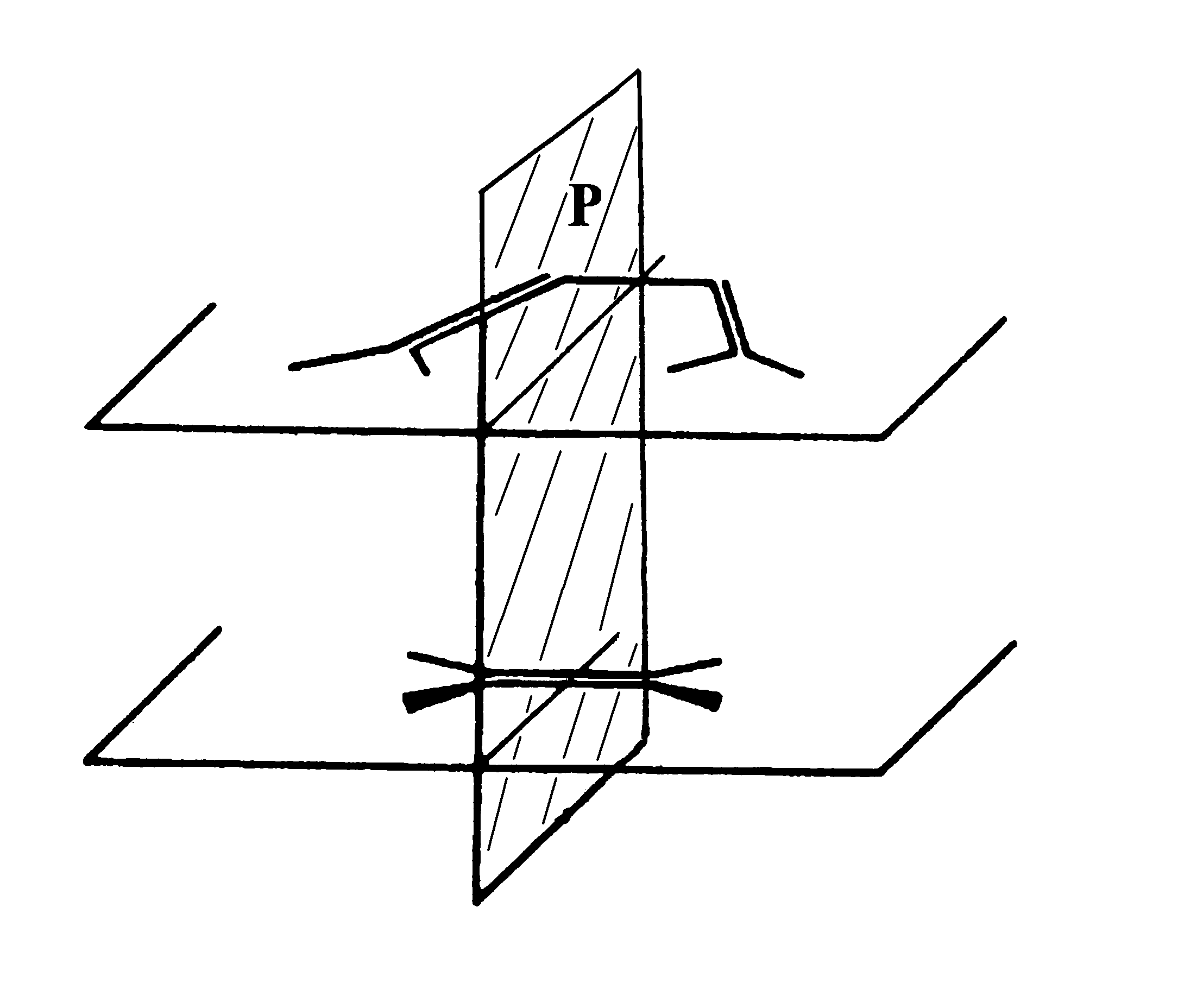
Рис. 10 Предреакционный комплекс реакции Дильса-Альдера циклоприсоединения цис-бутадиена к этилену.
Правило Вудворда-Хоффмана может быть приложено и к реакциям замещенных полиенов, когда симметрия отсутствует. В этом случае рассматриваются корреляции между МО незамещенных аналогов. Так, с точки зрения правила Вудворда-Хоффмана становится понятно, почему при термической циклизации замещенного гексатриена в циклогексадиен образуется только продукт II, а в фотохимической реакции только продукт III (Рис. 12). Рассмотрим верхнюю занятую МО незамещенного гексатриена в основном электронном состоянии. Образование связывающей МО возможно только в результате дисротаторного (в разные стороны) поворота концевых групп, что и приводит к получению при термической реакции только продукта II. В фотохимической реакции вращению концевых групп предшествует переход молекулы гексатриена в электронно-возбужденное состояние. При этом электрон переходит с верхней занятой на нижнюю вакантную МО, преобразование которой мы теперь и должны рассматривать. Образование связывающей МО возможно только в результате конротаторного (в одну сторону) поворота концевых групп (Рис.12). Поэтому при фотохимической реакции получается только продукт IV.
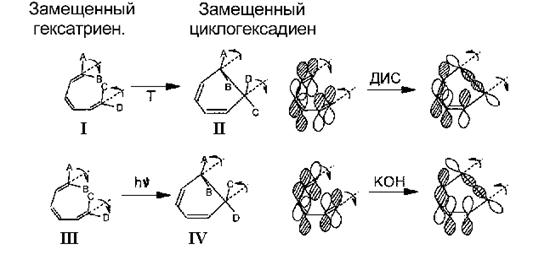
Рис. 12. Циклизация замещенного гексатриена в циклогексадиен: термическая дисротаторная I à II и фотохимическая конротаторная III à IV. Преобразование верхней занятой МО.
Запрет реакции по симметрии не обязательно означает, что реакция не может идти вообще. При отсутствии альтернативного “разрешенного” по симметрии пути, она может протекать только в жестких условиях с преодолением высокого активационного барьера. Так, энергия активации “запрещенной” реакции H2 + D2 à HD + HD составляет около 586 кДж/моль. Однако, если реакция “разрешена” по симметрии, это не обязательно означает, что ее активационный барьер низок. Например, энергия активации рассмотренной выше реакции Дильса-Альдера довольно значительна и равна 144 кДж/моль. Большие энергетические затраты на начальной стадии реакции вызваны согласованным растяжением 3 двойных связей, которые должны стать ординарными.
Эмпирически установленное правило Вудворда-Хоффмана было теоретически подтверждено впоследствии неэмпирическими расчетами по методу молекулярных орбиталей и проанализировано с помощью аппарата теории групп. При этом точкам пересечения линий на корреляционной диаграмме (смотри Рис. 11) были сопоставлены МО переходного состояния. Полученное таким образом положение переходного состояния относительно реагентов и продуктов согласуется с предсказаниями, полученными на основе постулата Хэммонда, обсуждавшимися ранее.
Дата: 2019-02-19, просмотров: 567.