МИНОБРНАУКИ РОССИИ
Государственное бюджетное образовательное учреждение
высшего профессионального образования
«ХАКАССКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ им. Н.Ф. КАТАНОВА»
МЕДИКО-ПСИХОЛОГО-СОЦИАЛЬНЫЙ ИНСТИТУТ
Кафедра Внутренних болезней
Специальность 31.05.01 Лечебное дело
ДИАГНОСТИЧЕСКОЕ ЗНАЧЕНИЕ АНТИТЕЛ К НУКЛЕОСОМАМ У БОЛЬНЫХ С СИТЕМНОЙ КРАСНОЙ ВОЛЧАНКОЙ
Курсовая работа
(по дисциплине «Госпитальная терапия и эндокринология»)
Исполнитель:
Воронкова Светлана Сергеевна
Студентка группы ЛД-51 __________
Научный руководитель:
Марковская Марина Федоровна
доцент кафедры внутренних болезней ХГУ им. Н.Ф.Катанова __________
Абакан, 2017
ОГЛАВЛЕНИЕ
| ВВЕДЕНИЕ……………………………………………………………………… | 3 | |||
| ГЛАВА 1 | СКВ: этиология, патогенез, клиническая картина, диагностика и лабораторные методы исследования…………………………... | 5 | ||
| 1.1 | Понятие о системной красной волчанке…………………… | 5 | ||
| 1.2 | Современные аспекты этиологии и патогенеза СКВ……… | 6 | ||
| 1.3 | Клиническая картина и диагностика СКВ………………… | 8 | ||
| 1.4 | Дифференциальная диагностика СКВ с другими заболеваниями………………………………………………... | 12 | ||
| 1.5 | Варианты течения СКВ……………………………………… | 13 | ||
| 1.6 | Лабораторные методы исследования при СКВ…………… | 18 | ||
| 1.7 | Лабораторные критерии при СКВ………………………….. | 21 | ||
| ГЛАВА 2 | Материалы и методы исследования……………………………… | 22 | ||
| 2.1 | Материалы и методы исследования………………………... | 22 | ||
| 2.2 | Методы исследования……………………………………….. | 22 | ||
| 2.2.1 | Антитела к нуклеосомам…………………………….. | 22 | ||
| 2.2.2 | Антитела к ds-DNK…………………………………... | 23 | ||
| 2.2.3 | LE-феномен (методика Цинкхама-Конли в модификации Е.Н. Новоселовой)…………………… | 24 | ||
| 2.2.4 | Общий анализ крови…………………………………. | 24 | ||
| 2.3 | Методы оценки чувствительности и специфичности……... | 25 | ||
| 2.4 | Методы статистической обработки………………………… | 25 | ||
| ГЛАВА 3 | Результаты исследований и их обсуждение……………………... | 27 | ||
| 3.1 | Частота встречаемости СКВ в зависимости от пола, возраста, степени активности заболевания и клиническим проявлениям………………………………………………….. | 27 | ||
| 3.2 | Частота повышения антител к нуклеосомам в сыворотках больных с СКВ и их связь с клинико - лабораторными проявлениями (эритроциты, лейкоциты, тромбоциты, гемоглобин и СОЭ)…………………………………………... | 30 | ||
| 3.3 | Оценка связи уровня антител к нуклеосомам с антителами к ds-DNK ……………………………………... | 35 | ||
| 3.4 | Оценка чувствительности и специфичности иммунологических методов исследования………………… | 36 | ||
| ВЫВОДЫ………………………………………………………………………... | 38 | |||
| СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ……………………………. | 39 | |||
ВВЕДЕНИЕ
Системная красная волчанка (СКВ) - системное аутоиммунное заболевание неизвестной этиологии, патогенетически связанное с такими нарушениями иммунорегуляции, которые являются причиной гиперпродукции широкого спектра органонеспецифическихаутоантител к различным компонентам ядра и иммунных комплексов, вызывающих иммуновоспалительное повреждение тканей и нарушения функций внутренних органов (Насонова В.А., Насонов Е.Л.,2003).
Основным компонентом лабораторной диагностики СКВ является выявление аутоантител к клеточным антигенам, преимущественно к ядерным, таких как антитела к нуклеосоме и двухспиральной ДНК. Антитела к двухспиральной ДНК (дсДНК) является наиболее распространенным диагностическим маркерам СКВ. К сожалению, он выявляется, не более чем в 50 % случаев, а уровень антител не всегда коррелирует с активностью заболевания (Симон Дж. и соавт., 2004)
Так же особое внимание при выявлении СКВ уделяется антителам к нуклеосомам. Нуклеосома состоит из двойной спирали ДНК, обмотанной вокруг специфического комплекса из восьми нуклеосомных гистонов (гистоновогооктамера). Нуклеосома представляет собой дисковидную частицу с диаметром около 11 нм, содержащую по две копии каждого из нуклеосомных гистонов (Н2А, Н2В, НЗ, Н4) (Фоумел С. и соавт., 2002).
По данным других исследований, нуклеосомы играют роль патогенетических антигенов у больных СКВ, а появление антител к нуклеосомам ассоциируется с органными поражениями (Симон Дж. и соавт, 2004).
Другой метод диагностики выявления СКВ является LE-клеточный фактор(LE-клетки или LE-феномен). Частота обнаружения LE-феномена у больных СКВ колеблется от 40 до 95%. Появление их в большом количестве — прогностически неблагоприятный признак.Поиск новых диагностических маркеров является актуальным направлением в исследованиях, посвященных системной красной волчанке.
Цель: изучить диагностическое значение антител к нуклеосомам у больных с СКВ.
Задачи:
1) Определить частоту встречаемости СКВ в зависимости от пола, возраста, степени активности и клиническим проявлениям заболевания.
2) Определить частоту повышения антител к нуклеосомам в сыворотках больных СКВи их связь с клинико - лабораторными проявлениями СКВ (эритроциты, лейкоциты, тромбоциты, гемоглобин и СОЭ).
3) Проанализировать связь уровня антител к нуклеосомам с антителами к дс-ДНК.
4) Определить чувствительность и специфичность диагностических методов.
Варианты течения СКВ
СКВ характеризуется многообразием не только клинических проявлений, но и вариантов течения. Классификация СКВ включает определение варианта течения болезни в зависимости от характера ее начала (острое, подострое или первично-хроническое)(Иванова М.М., 1994).
Острое течение заболевания характеризуется быстрым развитием мультиорганных проявлений, включая поражение почек и ЦНС, и высокой иммунологической активностью. Сочетание специфических клинических симптомов и лабораторных маркеров позволяет поставить достоверный диагноз уже на ранней стадии заболевания (Иванова М.М., 1994).
При подостром течении в дебюте наблюдаются конституциональные симптомы, неспецифическое поражение кожи и суставов, интенсивность которых то усиливается, то уменьшается. Типичная полисиндромная картина появляется через 2–3 года, поэтому на начальных этапах верификация диагноза СКВ затруднена. При данном варианте дифференциальный диагноз в дебюте, как правило, проводится с различными ревматическими (ревматоидный артрит – РА, реактивный артрит – РеА, системные болезни соединительной ткани), кожными заболеваниями и др. (Клюквина Н.Г., 2011).
Для первично-хронического варианта течения характерно длительное превалирование одного или нескольких симптомов: дискоидных высыпаний, феномена Рейно, артрита, судорожного синдрома, гематологических нарушений, синдрома Шёгрена. Множественные органные поражения появляются к 5–10-му году болезни. Такие пациенты наблюдаются врачами других специальностей – дерматологами, гематологами, нефрологами, неврологами, а в поле зрения ревматологов - при появлении развернутой картины СКВ. Окончательный диагноз ставится в процессе длительного наблюдения. Первично-хронический вариант течения наиболее часто наблюдается при сочетании СКВ и вторичного АФС (TuckerL.B., 2007)
По мнению ряда исследователей, возраст начала болезни и установления диагноза оказывает влияние на проявления СКВ (KostalaitL. T., KoimbraА.М., 1994). Распространенность СКВ у детей варьирует от 10 до 20 случаев на 100 тыс., при этом около 15% всех больных СКВ заболевают в возрасте до 18 лет (TuckerL.B., 2007). При СКВ, начавшейся в детском и подростковом возрасте, частота заболевших мальчиков и девочек примерно одинакова. Первыми симптомами болезни могут быть полиартрит, лимфаденопатия, гепато- и спленомегалия, а также не свойственный СКВ - лейкоцитоз. Редкие, чем у взрослых, начальные проявления заболевания у детей считаются кожно-слизистые поражения, алопеция, фотосенсибилизация и синдром Рейно (FontJ., CerveraR., EspinosaG., 1998). Имеются различия и в лабораторных нарушений: более высокая частота обнаружения антител к двуспиральной ДНК, анти- Sm и анти-РНП при дебюте СКВ в детском возрасте (TuckerL.B., 2007). Характерно острое течение с быстрым развитием типичной полиорганной симптоматики и частым вовлечением в патологический процесс жизненно важных органов, в первую очередь почек и ЦНС (MariniR., CostallatL.T., 1999). Детский и подростковый вариант начала заболевания считается крайне тяжелым. Некоторыми исследователями зарегистрированы более высокие показатели выживаемости у детей, заболевших в возрасте 10–13 лет. Скорее всего, благоприятный исход в этих ситуациях был обусловлен своевременной диагностикой и адекватным лечением (Иванова М.М., 1985).
Позднее начало (после 50 лет) СКВ встречается в 15–22% случаев и характеризуется более мягким течением (Балабан С.Я., Петрова В.И., 1985). В клинической картине преобладают конституциональные проявления, поражение суставов (обычно крупных), легких (пневмонит с ателектазами, легочный фиброз). Отмечена высокая частота поражения сердечно-сосудистой системы, вторичного синдрома Шёгрена. Тяжелые формы поражения почек и ЦНС встречаются редко. При лабораторном исследовании антитела к двуспиральной ДНК выявляют реже, а к Ro/SSa-антигену – чаще, чем у больных СКВ молодого возраста. К особенностям СКВ у «пожилых» также относят высокую частоту гематологических нарушений (главным образом резистентной тромбоцитопении) и сопутствующих заболеваний, сдерживающих назначение адекватного лечения, но и приводящих к летальному исходу. Низкие показатели выживаемости при данном варианте течения СКВ, по мнению ряда авторов, также обусловлены постепенным развитием заболевания, атипичной клинической картиной и поздней диагностикой (BertolliA.M., AlarconG.S., 2006).
Мужчины болеют СКВ в 10 раз реже. Существует точка зрения, что СКВ у мужчин дебютирует в более старшем возрасте (40–50 лет) (GarciaM.A., MarcosJ.C., MarcosA.I., 2005). С момента появления первых симптомов до верификации диагноза у мужчин проходит больше времени, чем у женщин (Клюквина Н.Г., Ильина А.Е., 2005). Особенностями СКВ у мужчин считаются высокая частота поражения почек и других неблагоприятных признаков (судорожные приступы, тромбоцитопения, положительные антифосфолипидные антитела), нетипичный суставной синдром с вовлечением суставов нижних конечностей и развитием сакроилиита примерно у 25% больных; высокий процент дискоидного поражения кожи и сердечно-сосудистых заболеваний (Ильина А.Е., Клюквина Н.Г., 2005). По мнению большинства авторов, мужской пол ассоциируется с быстрым развитием необратимого органного повреждения и плохим прогнозом. В качестве возможных прогностически неблагоприятных факторов у мужчин рассматриваются особенности образа жизни (злоупотребление алкоголем и курение) и низкая приверженность терапии (AndradeR.M., AlarconG.S., FernandezM.,2007).
Выделяют и некоторые клинико-иммунологические варианты СКВ:
1) Подострая кожная красная волчанка (cubacutelupuserythematosus) – особый вариант с распространенными фоточувствительными папулоскваматозными (псориазоформными) или анулярнымиполициклиническими высыпаниями, симметрично располагающимися на участках кожи, подвергшихся инсоляции. В отличие от дискоидных элементов поражение кожи при подострой кожной красной волчанке не приводит к образованию рубцов. Особенностью этой формы заключается в преобладании больных мужского пола (соотношение мужчин и женщин – 4:1), редкости тяжелого поражения почек и ЦНС, высокой частоте обнаружения анти-Ro (SS-A)-антител. При лабораторном исследовании также часто выявляются антиядерные антитела, ревматоидный фактор (РФ), лимфопения, тромбоцитопения и низкие уровни С3/С4-компонентов комплемента (ChlebusE., WolskaH., BlaszczykM., 1998).
2) У трети больных СКВ развивается вторичный АФС, характеризующийся рецидивирующими венозными и/или артериальными тромбозами, акушерской патологией, тромбоцитопений и другими (сердечно-сосудистыми, неврологическими, кожными) проявлениями, обусловленными гиперпродукцией антифосфолипидных антител (Насонов Е.Л., 2004). Симптомы АФС могут предшествовать развитию основного заболевания, возникать одновременно с ним или спустя несколько лет. Симптоматика синдрома занимает первое место в клинической картине основного заболевания, определяя прогноз болезни и тактику лечения (Решетняк Т.М., Середавкина Н.В., 2008).
3) Синдром неонатальной волчанки развивается у новорожденных в результате трансплацентарного пассажа материнских аутоантител к растворимым антигенам тканевых рибонуклеопротеинов, в первую очередь Ro/SSA, и La/SS-B (встречающихся у 20–30% больных СКВ и некоторыми другими ревматическими заболеваниями). Частота синдрома – около 1% среди детей, родившихся от матерей с наличием патогенных аутоантител, и примерно 1 случай на 22 тыс. всех новорожденных в популяции. Проявления неонатальной волчанки включают поражение кожи, пневмонит, гепатолиенальный синдром, поражение сердца (миокардит, перикардит, врожденная полная поперечная блокада, транспозиция крупных сосудов, открытый артериальный проток, незаращение перегородки) и цитопению. Признаки носят транзиторный характер, как правило, полностью исчезают без лечения через 4–12 нед. по мере элиминации материнских антител из организма ребенка. Тяжелым проявлением считается врожденная полная поперечная блокада, выявляющаяся у 15–30% детей: при этом в 50–70% случаев требуется имплантация искусственного водителя ритма (KinlayJ.R., CookL., 2001).
Течение болезни волнообразное, с чередованием ремиссий и обострений. При обострениях в патологический процесс могут вовлекаться ранее неповрежденные органы и системы или нарастать уже имеющаяся симптоматика (Иванова М.М., 1994). «Вспышки» заболевания у больных СКВ в большинстве случаев начинаются с одного органа или системы.Было доказано, что обострения «по одному органу» предвещают начало обострения по другим. Регистрация обострений и степени их выраженности имеет огромное значение для оценки течения СКВ и выбора тактики лечения. Установлено, что частота обострений является предиктором исхода заболевания. Исследования показали, что 10-летняя выживаемость больных, не имевших обострений после верификации диагноза и назначения терапии, составляла 100%, тогда как при развитии 1, 2 или 3 рецидивов этот показатель снижался до 91, 69 и 33%. Обострения могут возникать независимо от давности заболевания. Одни исследователи (LaustrupH., VossA., GreenA., 2010) считают, что обострения характерны для ранних стадий СКВ, а после 5 лет заболевания их частота снижается. Другие, напротив, фиксировали периоды повышения активности и при длительном течении СКВ. Хорошо известна провоцирующая роль в активизации заболевания инсоляции, беременности, присоединения инфекции, назначения антибиотиков, отмены иммуносупрессивных препаратов и других факторов, но так же имеются данные о сохранении стабильного состояния даже при явном воздействии традиционных триггеров, и наоборот, развитии рецидивов СКВ без видимых причин. M. Petri и соавт. обнаружили, что обострения СКВ чаше встречаются у женщин, чем у мужчинами. Кроме того, частота и тяжесть обострений заболевания выше у женщин в пременопаузе, чем в постменопаузе. Особенности дебюта также могут отражать течение заболевания: есть данные, что больные с поражением почек, ЦНС и гемолитической анемией на момент установления диагноза имеют большую вероятность обострений (PetriM., BuyonJ., KimM., 1999). Однако, отсутствуют лабораторные маркеры, однозначно указывающие на возможность развития рецидива СКВ, хотя имеются данные о возможной независимой роли некоторых лабораторных нарушений – лимфопении, повышения уровня антител к двуспиральной ДНК и снижения уровня С3- и С4-компонентов комплемента (BertsiasG., IoannidisJ.P., BoletisJ., 2008).
Раннее выявление признаков обострения необходимо для профилактики развития или ухудшения поражения жизненно важных органов. Рецидивирующий характер течения, поражение ранее не заинтересованных органов-мишеней, потребность в усилении иммуносупрессивной терапии при развитии рецидивов приводят к накоплению органного повреждения у больных СКВ вследствие как самого заболевания, так и проводимой терапии. По данным M. Петри и соавт., необратимое органное поражение обнаруживалось спустя 7 лет наблюдения более чем у половины больных (PetriM., BarrS.G., Zonana-NachA.,1999).
Наряду с локализацией необратимого повреждения имеет значение и быстрота его развития. По данным П. Рахман и соавт., раннее органное поражение является предиктором летальных исходов у больных СКВ. Вероятность выживания после 10 лет наблюдения оказалась достоверно ниже у больных с органным повреждением, развившимся в течение первого года заболевания (RahmanP., GladmanD.D., UrowitzM.B., 2001).
Материалы исследования
Был проведен ретроспективный анализ 35 историй болезней с хроническим течением и достоверным диагнозом системная красная волчанка (не менее 4-х критериев Американской коллегии ревматологов, 1997), проходивших лечение в 1-ом терапевтическом отделении ГБУЗ РХ «Республиканская клиническая больница им. Г.Я. Ремишевской» с января 2013 года по декабрь 2016 года и не получавших глюкокортикоидные (ГК) препараты и цитостатики на момент обследования. В группу сравнения вошли 22 пациента с ревматодным артритом (РА). Группу контроля составили 30 здоровых доноров, посетивших ревматолога, которые были отобранны по амбулаторным картам в ГБУЗ РХ «Республиканская клиническая поликлиника им. Г.Я. Ремишевской». Все отобранные пациенты были сопоставимы по полу и возрасту.Анализировали иммунологические показатели (ANA-detect,ds-DNK, LE-феномен) и показатели общего анализа крови (эритроциты, лейкоциты, тромбоциты, гемоглобин, СОЭ).
Иммунологические показатели определяли с помощью автоматического иммуноферментного анализатора для лабораторной диагностики аутоиммунных заболеваний – ALEGRIA, который характеризуется высокой чувствительностью и воспроизводимостью.Забор крови осуществляется из локтевой вены натощак утром, в объеме не менее 10 мл.
Показатели общего анализа крови определяли с помощью автоматического гематологического анализатора.Для проведения анализа производился забор капиллярной крови (внутренняя сторона среднего пальца или конец безымянного пальца), натощак утром, в объеме не менее 30 мкл.
Методы исследования
Антитела к нуклеосомам
Нуклеосомы, представляют собой структурные единицы хроматина, состоящие из ДНК и гистоновых белков. Вокруг ядра нуклеосомы, состоящего из белков гистонов Н2А, Н2В, Н3 и Н4, обернуто 146 пар нуклеотидов ДНК, что составляет два с половиной витка. Между нуклеосомами находится промежуток из линейной ДНК и гистона Н1. Такая структура укладки ДНК позволяет компактно упаковать генетический материал в составе хромосом клетки. Значительное количество свободных нуклеосом может образоваться при программированной клеточной гибели (апоптозе). Свободные нуклеосомы рассматриваются в качестве основного иммуногена, стимулирующего иммунные ответ Т- и В-клеток при системной красной волчанке (СКВ). Вероятно, источником свободных нуклеосом при этом заболевании являются эпителиоциты и лимфоциты, которые подвергаются избыточному апоптозу.Совокупная частота выявления антитела к нуклеосомам при СКВ составляет 60-90%, причем антитела к нуклеосомам отмечаются несколько чаще, чем антитела к ДНК (40-50%), поэтому могут позволить диагностировать СКВ у пациентов без антител к двуспиральной ДНК. Антитела к нуклеосомам отмечаются у 40-70% пациентов с классической красной волчанкой с поражением кожи и внутренних органов и у 80% больных СКВ с поражением почек. Антитела к нуклеосомам являются одними из первых аутоантител, формирующихся в организме в ходе развития СКВ. Для выявления антител к нуклеосомам используется иммуноферментный тест второго поколения, основным отличием которого является применение высокоочищенных нуклеосом, что обеспечивает специфичность определения данных анутоантител для диагностики СКВ превышающую 95% (Лапин С.В., Тотолян А.А.,2010).
Антитела к ds - DNK
Для выявления антител к дсДНК методом ИФА сложно сохранить нативную структуру молекулы. Молекула дсДНК несет отрицательный заряд и не может быть непосредственно нанесена на отрицательно заряженный пластик иммуноферментного планшета. Для того, чтобы нанести дсДНК в дно лунок, необходимо использовать положительно заряженный белок протамин. Облучение дсДНК позволяет сделать ее более реактоспособной и сенсибилизировать ИФА-планшеты. Оба этих метода сенсибилизации проводят к деспирализациидсДНК с образованием значительного числа односпиральных молекул. Это приводит к тому, что большинство твердофазных иммуноферментных систем для обнаружения антител к дсДНК оказываются относительно неспецифичными. При СКВ антитела к дсДНК могут быть обнаружены у 40-50% больных и характеризуются гомогенным типом свечения ядра НЕр-2 клеток при выявлении АНФ. Причиной их появления является сенсибилизация к компонентам ядерного материала, высвобождающегося из ядер клеток в ходе апоптоза. Антитела к дсДНК включены в состав 10 критериев СКВ Американской Ассоциации Ревматологов (в настоящее время Американского Колледжа Ревматизма)(Лапин С.В., Тотолян А.А.,2010).
Общий анализ крови
Перед проведением испытания образец крови тщательным образом перемешивали, избегали резких и интенсивных движений. Исследование выполненяли не позднее 4 часов с момента забора.
Общий анализ крови проводился на автоматическом гематологическом анализаторе. В геманализаторе использовалась методика проточной цитометрии – клетки, выстраиваясь одна за другой, проходили через очень узкие капилляры, где их считали и измеряли при помощи лазера.
Для определения концентрации гемоглобина применялся метод колориметрии (абсорбционной спектрометрии). Учитывали следующие показатели: эритроциты 1012/л, лейкоциты 109/л, тромбоциты 109/л, гемоглобин г/л, СОЭ мм/ч.
0,381916
0,538981
0,498737
-0,258778
Лейкоциты
0,381916
1,000000
0,443277
0,373440
-0,245021
Тромбоциты
0,538981
0,443277
1,000000
0,224753
0,142427
Гемоглобин
0,498737
0,373440
0,224753
1,000000
-0,361902
СОЭ
-0,258778
-0,245021
0,142427
-0,361902
1,000000
Таким образом, прямую корреляционную связь эритроцитов с лейкоцитами, тромбоцитами можно объяснить тем, что их образование идет в костном мозге и если показатели ниже референтных значений, то будет поражение костного мозга при СКВ. Прямую корреляционную связь эритроцитов с гемоглобином можно объяснить либо снижением эритроцитов, либо видоизменение самих эритроцитов. Корреляционная связь лейкоцитов с тромбоцитами и гемоглобином объясняется таким же образом. Обратная корреляционная связь гемоглобина с СОЭ объясняется воспалительным процессом (синтезирование организмом «острых» белков – это специфический ответ печени на текущий процесс воспаления(воспалительный цитокин)).
Оценили результаты иммунологических методов исследования у пациентов с СКВ. Медиана ANA-detect составила – 3,2(1,2-7,1),ds-DNK– 59,5(30,5-101). Достоверных отличий выявлено не было (p>0,05) (табл. 3).
При изучении показателей медианы и достоверности у пациентов с ревматоидным артиритом мы получили данные, что медиана ANA-detect составила 0,3(0,2-0,5), ds-DNK – 5,1(3,1-7,1). Достоверных отличий выявлено не было (p>0,05) (табл. 3).
При оценке показателей медианы и достоверности у пациентов в группе контроле было выявилено, что медиана ANA-detect и ds-DNK составила 0,0(0,0-0,0). Достоверных отличий выявлено не было (p>0,05) (табл. 3).
Таблица 3
Показатели медианы и достоверности иммунологических методов исследования у пациентов с СКВ, РА и в группе контроля
| Показатели |
СКВ | РА |
ГРУППА КОНТРОЛЯ | |||
| Me(Q1-Q3) | р | Me(Q1-Q3) | р | Me(Q1-Q3) | р | |
| ANA-detect | 3,2(1,2-7,1) | 0,196495 | 0,3(0,2-0,5) | 0,23838 | 0,0(0,0-0,0) | 0,103724 |
| ds-DNK | 59,5(30,5-101,0) | 0,169843 | 5,1(3,1-7,1) | 0,14319 | 0,0(0,0-0,0) | 0,242686 |
При изучении частоты встречаемости антител к нуклеосомам (ANA-detect) установлено, что высокий титр антител встречается в 80,0% (28/35) случаев – при СКВ и в 9,1% (2/22) случаев - при РА, в группе контроля данных случаев не наблюдается; низкий титр антител встречается в 20%(7/35) случаев – при СКВ, в 90,9%(20/22) случаев – при РА и в 100% (30/30) случаев – в группе контроля (рис. 7).
Изучая иммунологический метод ds-DNK выявлено, что высокие титры антител встречаются в 82,9%(29/35) случаев - при СКВ, при ревматоидном артрите и в группе контроля наблюдений не имеется (рис. 7).
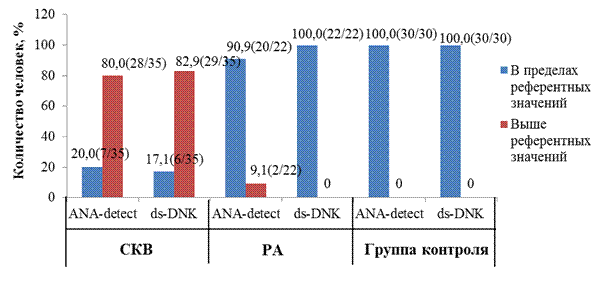
Рис. 7 Частота встречаемости антител к нуклеосомам (ANA-detect) и ds-DNK у больных, %
Оценивая частоту встречаемости LE-феномена у больных мы выявили, что при СКВ положительный LE-феномен – у 65,7% (23/35), отрицательный – у 34,3% (12/35); при ревматоидном артрите положительный – у 13,6% (3/22), отрицательный – у 86,4% (19/22); в группе контроля отрицательный у 100,0% (30/30) человек (рис. 8).
Проанализировали корреляционную связь между показателями и выявили прямую корреляционную связь между ANA-detect с СОЭ – 0,453646; также выявили обратную корреляционную связь лейкоцитов с ANA-detect – - 0,380060, ds-DNK – -0,501182 (табл.4).
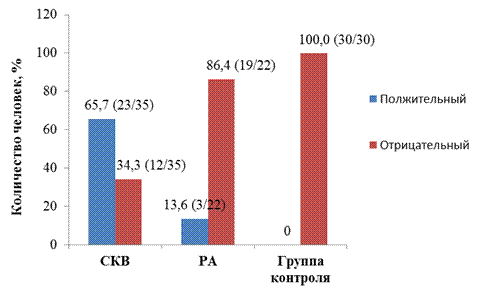
Рис. 8 Частота встречаемости антител к нуклеосомам (LE-феномен) у больных, %
Таблица 4
Корреляционная связь иммунологических анализов крови с ОАК у пациентов с СКВ
| Показатели | ANA-detect | ds-DNK |
| Эритроциты | -0,108832 | 0,119952 |
| Лейкоциты | -0,380060 | -0,501182 |
| Тромбоциты | -0,035063 | -0,055236 |
| Гемоглобин | -0,064978 | 0,070396 |
| СОЭ | 0,453646 | 0,269182 |
Таким образом, прямую корреляционную связь ANA-detect с СОЭ можно объяснить воспалительным процессом в организме, а обратную корреляционную связь ANA-detect и ds-DNK с лейкоцитами можно объяснить с самим аутоиммунным заболеванием, когда поражается костный мозг, поэтому ANA-detect и ds-DNK будут повышаться, а лейкоциты понижаться.
При анализе корреляционной связи LE-феномена с показателями ОАК у пациентов с СКВ была обнаружена обратная корреляционная связь LE-феномена с гемоглобином – -0,456459 (табл. 5).
Таблица 5
Корреляционная связь LE-феномена с показателями ОАК у пациентов с СКВ
| Показатели | LE-феномен |
| Эритроциты | 0,068675 |
| Лейкоциты | -0,080505 |
| Тромбоциты | 0,140070 |
| Гемоглобин | -0,456459 |
| СОЭ | 0,149125 |
Таким образом, обратная корреляционная связь LE-феномена с гемоглобином объясняется тем, что при положительном анализе LE-феномена, гемоглобин будет ниже референтных значений, что связано с поражением почек, где продуцируется гормон эритропоэтин.
0,462378
Таким образом, прямая корреляционная связь LE-феномена с ds-DNK объясняется высокой активностью титра антител.
ВЫВОДЫ
1) Системная красная волчанка чаще встречается у женщин– 85,7%(30/35), чем у мужчин – 14,3%(5/35). У женщин СКВ чаще встречается в молодом возрасте (18-44 лет) – 43,4%(13/30), у мужчин в среднем возрасте(45-59) – 60,0%(3/5). Чаще определяется 2 степень активности заболевания – 48,6%(17/35). При изучении клинических проявлениябыли выявлены основныесимптомы: полиартрит – 85,7% (30/35), синдром Рейно – 65,7% (29/35), эритема – 60,0% (21/35) и нефрит – 57,1% (20/35).
2)Повышение титра антител выше референтных значений иммунологического метода ANA-detectопределяется у 80,0% (28/35), ds-DNK – у 82,9%(29/35), положительный LE-феномен – у 65,7% (23/35). Выявлена прямая корреляционная связь ANA-detect с СОЭ, что подтверждает воспалительный процесс в организме и обратная корреляционная связь ANA-detectи и ds-DNK с лейкоцитами, что подтверждает поражение костного мозга. В процессе исследования мы обнаружили обратную корреляционную связь LE-феномена с гемоглобином, что говорит о поражение почек, где продуцируется гормон эритропоэтин, ответственного за выработку гемоглобина.
3)Выявлена прямая корреляционная связь ds-DNK с ANA-detect - это объясняетсяспособностью аутоиммунных антител проникать в места хранения ДНК и приводить к их разрушению и образованию антинуклеарных антител, так же выявлена прямая корреляционная связь LE-феномена с ds-DNK, что объясняется высокой активностью титра антител.
4) Чувствительность иммунологического метода ANA-Detect составила 80%, ds-DNK – 82,9%, LE-феномена – 65,7%. Специфичность метода ANA-Detect – 94,2%, ds-DNK – 100,0%, LE-феномена – 92,3%. Одновременное определение антител к нуклеосомам и ds-DNK позволяет повысить специфичность лабораторной диагностики СКВ.
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
1. Анализ данных лучевых методов исследования на основе принципов доказательной медицины: учебное пособие / Васильев А.Ю., Малый А.Ю., Серов Н.С. - М. : ГЭОТАР-Медиа, 2008 – 32 с.
2. Балабан С.Я., Петрова В.И. Особенности течения системной красной волчанки у больных среднего и пожилого возраста. Ревматология 1985 – 130 с.
3. Иванова М.М. Прогноз заболевания и особенности лечения больных системной красной волчанкой в различных возрастных группах. Терарх 1985 – 125 с.
4. Иванова М.М. Системная красная волчанка. В кн.: Диффузные болезни соедини- тельной ткани. М.: Медицина, 1994 – 301с.
5. Ильина А.Е., Клюквина Н.Г., Александрова Е.Н. и др. Атеросклеротическое поражение сосудов при системной красной волчанке и антифосфолипидном синдроме у мужчин. Научно-практическая ревматология 2005 – 10 с.
6. Клюквина Н.Г. Системная красная волчанка: многообразие форм и вариантов течения – Журнал: Современная ревматология, выпуск №4, 2011 - 25-30 с.
7. Лапин С.В., Тотолян А.А. Иммунологическая лабораторная диагностика аутоиммунных заболеваний. – СПб.: Человек, 2010. – 272 с.: ил.
8. Насонов Е.Л. Антифосфолипидный синдром. М.: Литтера, 2004 – 440 с.
9. Насонов Е.Л., Насонова В.А., редакторы. Ревматология: Национальное руководство. Москва: ГЭОТАР-Медиа; 2008 – 502 с.
10. Ревматические болезни. Руководство для врачей под ред. Насоновой В.А. и Бунчука Н.В. М., Медицина, 1997 – 425 с.
11. Решетняк Т.М., Середавкина Н.В., Насонов Е.Л. Кардиоваскулярные аспекты антифосфолипидного синдрома, М., Медицина, 2008 –12 с.
12. Andrade R.M., Alarcon G.S., Fernandez M. et al. Accelerated damage accrual among men with systemic lupus erythematosus. XLIY. Results from a multiethnic US cohort. Arthr Rheum 2007 – 622–30.
13. Bertolli A.M., Alarcon G.S., Calvo-Alen J. et al. Systemic lupus erythematosus in a multiethnic US cohort. Clinical features, course and outcome in patients with late-onset disease. ArthrRheum 2006 –1580–7.
14. Bertsias G., Ioannidis J.P., Boletis J. et al. EULAR recommendations for the management of systemic lupus erythematosus. Report of a task force of the EULAR Standing Committee for International Clinical Studies including therapeutics. AnnRheumDis 2008 – 195–205.
15. Chlebus E., Wolska H., Blaszczyk M. et al. Subacute cutaneous lupus erythematosus versus systemic lupus erythematosus: diagnostic criteria and theraupetic implications. J Am AcadDermat 1998 – 405–12.
16. Costallat L.T.L., Coimbra A.M.V. Systemic lupus erythematosus: clinical and laboratory aspects related to age at disease onset. Clin 30 Experim Rheum 1994 – 603–7.
17. Dai С, Deng Y, Quinlan A, et al. Genetics of systemic lupus erythematosus: immune responses and end organ resistance to damage. CurrOpinImmunol. 2014 – 87-96.
18. Dorner T. Deciphering the role of NETs and networks in SLE. Nat Rev Rheumatol. 2012;8(2):68-70. doi: 10.1038/nrrheum.2011 – 200.
19. Dubois’s lupus erythematosus. 6th ed. Wallace D.J., Hahn B.H. (eds). Rhiladelphia, PA: Lippincott Williams & Wilkins, 2001.
20. Font J., Cervera R., Espinosa G. et al. Systemic lupus erythematosus in childhood: analysis of clinical and immunological findings in 34 patients and comparison with SLE characteristics in adults. Ann Rheum Dis 1998 – 456–9.
21. Garcia M.A., Marcos J.C., Marcos A.I. et al. Male systemic lupus erythematosus in a Latin-American inception cohort of 1214 patients. Lupus 2005 –938–46.
22. Hochberg M.C. Updating the American College of Rheumatology revised criteria for the classification of systemic lupus erythematosus. Arthr Rheum 1997 – 1725–9.
23. Jacobi AM, Odendahl M, Reiter K, et al. Correlation between circulating CD27(high) plasma cells and disease activity in patients with systemic lupus erythematosus. Arthritis Rheum. 2003 – 1332- 42
24. Laustrup H., Voss A., Green A. et al. SLE disease patterns in a Danish population-based lupus cohort: an 8-year prospective study. Lupus 2010 – 239–46.
25. Lockshin M.D. Sex differences in autoimmune disease. Lupus 2006 –753–6.
26. Lupus: A GP Guide to diagnosis. Complied by Y. Norton. Lupus UK. 2000.
27. Marini R., Costallat L.T. Young age at onset, renal involvement and arterial hypertension are adverse prognostic significance in juvenile systemic lupus erythematosus. – Review of Rheumatology of Engl. Education. 1999 – 303–9.
28. Palanichamy A, Bauer JW, Yalavarthi S, et al. Neutrophil mediated IFN activation in the bone marrow alters B cell development in human and murine SLE. J Immunol. 2014 – 906-18.
29. Petri M., Barr S.G., Zonana-Nach A. et al. Measures of disease activity, damage and health status. The Hopkins Lupus Cohort Experience. J Rheum 1999 – 502–3.
30. Petri M., Buyon J., Kim M. Classification and definition of major flares in SLE clinical trialsю. Lupus 1999 – 685–91.
31. Rahman P., Gladman D.D., Urowitz M.B. et al. Early damage as measured by the SLICC/ACR damage index is a predictor of mortality in systemic lupus erythematosus. Lupus 2001 – 93–6.
32. Tucker L.B. Making the diagnosis of systemic lupus erythematosus in children and adolescents. Lupus 2007 – 546–9.
33. Uramoto K.M., Michet C.J., Thumbo J. et al. Trends in the incidence and mortality of systemic lupus erythematosus, 1950–1992. Arthr Rheum 1999 – 46–50.
МИНОБРНАУКИ РОССИИ
Государственное бюджетное образовательное учреждение
высшего профессионального образования
«ХАКАССКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ им. Н.Ф. КАТАНОВА»
МЕДИКО-ПСИХОЛОГО-СОЦИАЛЬНЫЙ ИНСТИТУТ
Кафедра Внутренних болезней
Дата: 2019-02-19, просмотров: 315.