Е. В. Щербакова Е. А. Ольховатов
ПРАКТИКУМ ПО ХИМИИ ВКУСА,
ЦВЕТА И АРОМАТА
Учебное пособие
2017
УДК 665.3 (076.5)
ББК 35.782
Щ61
Рецензент:
В. Д. Надыкта – доктор технических наук, профессор ВАК, заведующий кафедрой технологии хранения и переработки растениеводческой продукции Кубанского государственного аграрного университета им. И.Т. Трубилина, академик РАН
Щербакова Е.В., Ольховатов Е.А. Практикум по химии вкуса, цвета и аромата : учебное пособие.
Учебное пособие предназначено для формирования у обучающихся комплекса знаний о химизме и условиях образования основных соединений, обуславливающих вкус, цвет и аромат при производстве пищевых продуктов из растительного сырья и их влияние на органолептические и физико-химические показатели качества и изменения, происходящие в процессе хранения готовой продукции. Изложен теоретический материал и методики выполнения практических работ, включенных в рабочую программу по дисциплине «Химия вкуса, цвета и аромата». Приведенный материал предназначен для проведения практических занятий, а также может быть использован обучающимися для самостоятельной работы.
Издание предназначено для обучающихся по направлению подготовки магистратуры 19.04.02 «Продукты питания из растительного сырья», а также бакалавриата, аспирантуры, специалистов пищевых отраслей и широкого круга читателей.
УДК 665.3 (076.5)
ББК 35.782
Оглавление
| Введение……………………………………………………………. 1 Кратко о природе сенсорных систем……………………………. Контрольные вопросы……………………………………………... 2 Порядок исследований по проверке сенсорных способностей………………………………………… Контрольные вопросы……………………………………………... 3 Химия вкуса………………………………………………………. 3.1 Основные теоретические положения……………………….. 3.2 Методы проверки вкусовой чувствительности……………. Лабораторная работа № 1. Проверка на "вкусовой дальтонизм"………………………............................................ Лабораторная работа № 2. Проверка порога вкусовой чувствительности………………………………….. 2.1 Определение порога вкусовой чувствительности к сладкому………………………………………………... 2.2 Определение порога вкусовой чувствительности к солёному………………………………………………... 2.3 Определение порога вкусовой чувствительности к кислому………………………………………………... 2.4 Определение порога вкусовой чувствительности к горькому……………………………………………….. Лабораторная работа № 3. Проверка порога вкусовой разницы и интенсивности вкуса………………….. Лабораторная работа № 4. Изучение свойств пищевых кислот………………………………………………. 4.1 Кислотные свойства карбоновых кислот……………….. 4.2 Определение активной кислотности различных пищевых продуктов и растворов кислот различной концентрации………………………… Лабораторная работа № 5. Изучение свойств алкалоидов…...……………………………………………….. 5.1 Качественные реакции…………………………………… 5.2 Получение кофеина и качественная реакция на кофеин…………………………………………………. 5.3 Реакции с кофеином (хинином)…………………………. Контрольные вопросы……………………………………….. 4 Химия цвета………………………………………………………. 4.1 Основные теоретические положения………………........ Контрольные вопросы……………………………………….. Лабораторная работа № 6. Определение способности идентифицировать основные цвета и отмечать разницу в цвете с помощью растворов индикаторов………………... Лабораторная работа № 7. Метод определения количественного содержания антоцианов………………….. Лабораторная работа № 8. Особенности каротиноидов овощных и плодовых растений……………………………… Контрольные вопросы……………………………………….. 5 Химия аромата…………………………………………………… 5.1 Основные теоретические положения………………………. Лабораторная работа № 9. Тренировка сенсорной памяти дегустаторов……………………………. Лабораторная работа № 10. Проверка дегустаторов на обонятельную аносмию…………………………………... Контрольные вопросы……………………………………….. Словарь основных понятий и терминов………………………….. Список литературы………………………………………………… | 22 |
ВВЕДЕНИЕ
Целью освоения дисциплины «Химия, вкуса, цвета и аромата» является формирование комплекса знаний об организационных, научных и методических основах химизма и условий образования основных соединений, обуславливающих формирование вкуса, цвета и аромата при производстве пищевых продуктов из растительного сырья и их влияние на органолептические и физико-химические показатели качества готовой продукции, их изменений в процессе хранения.
Задачи
– сформировать практические основы определения основных органолептических показателей качества пищевых продуктов – вкуса, цвета и аромата;
– сформировать практические основы определения причин и условий образования нежелательного и постороннего вкуса, цвета и аромата пищевых продуктов
Учебное пособие предназначено для проведения практических занятий и организации самостоятельной работы обучающихся в целях освоения ими профессиональных компетенций по дисциплине «Химия, вкуса, цвета и аромата» для направления подготовки магистратуры 19.04.02 «Продукты питания из растительного сырья», а также бакалавриата, аспирантуры, специалистов пищевых отраслей и широкого круга читателей.
Техника безопасности при работе в химической лаборатории
При работе в химической лаборатории необходимо соблюдать правила техники безопасности и противопожарные мероприятия.
Все работающие в лаборатории должны пройти инструктаж по технике безопасности, что фиксируется в специальном журнале. Для работы в лаборатории необходим халат, который надевается перед началом работы и застегивается на все пуговицы.
При выполнении анализов нужно соблюдать осторожность, быть внимательным, все операции проводить аккуратно, без спешки. Особое внимание следует обращать на чистоту рук. Если на них попадают реактивы или другие загрязнения, то руки необходимо сразу мыть. В лаборатории должны быть два полотенца: для рук и для посуды, которые должны существенно отличаться цветом или фактурой материала. Категорически запрещается принимать пищу из лабораторной посуды или за лабораторными столами.
Стеклянные приборы: колбы, стаканы, пробирки изготовлены в основном из тонкостенного стекла, поэтому обращаться с ними нужно аккуратно - их следует осторожно переставлять с места на место, нельзя сжимать пальцами, при мытье не нажимать сильно на дно и стенки моющими приспособлениями. В случае пореза стеклом из ранки извлекают осколки стекла, смазывают йодом или другим заменяющим его средством, забинтовывают или заклеивают лейкопластырем.
При пользовании реактивами требуется выполнять особые правила. Нельзя использовать реактивы, на склянках с которыми отсутствует надпись с наименованием. Твердые реактивы для взвешивания или других целей берут специальным шпателем или ложечкой, избегая попадания реактива на руки. Категорически запрещается пробовать реактивы на вкус. Нюхать химические реактивы нужно очень осторожно, не наклоняясь над ними и не вдыхая полной грудью.
С легковоспламеняющимися и выделяющими летучие, ядовитые и другие фракции веществами можно работать только в вытяжном шкафу при опущенной дверце. Хранить их нужно также в вытяжном шкафу.
Для нагревания следует использовать только термостойкую стеклянную или фарфоровую посуду. Нельзя наклоняться над кипящей жидкостью при выпаривании или кипении различных растворов. Нагревать можно только открытые (сообщающиеся с атмосферой или вакуумом) сосуды. Запрещается герметично закрывать сосуд с горячей жидкостью, так как в результате конденсации паров образуется вакуум, и сосуд легко может быть раздавлен атмосферным воздухом.
Все электрические приборы должны быть заземлены.
Общая физиология рецепции
Рецепторы – это специализированные чувствительные образования, воспринимающие и преобразующие раздражения из внешней и внутренней среды организма в специфическую активность нервной системы.
Адекватные раздражители – это те раздражители, к энергии которых рецепторы наиболее чувствительны. По качеству вызываемых раздражителями ощущений (модальности) рецепторы классифицируют на слуховые, зрительные, обонятельные, вкусовые, тактильные, температурные и болевые.
По дальности расположения воспринимаемого стимула рецепторы являются дистантными (слух, зрение) и контактными (осязание, обоняние, вкус). Рецепторы, воспринимающие раздражители из внутренней среды организма, называют интероцепторами (рецепторы сосудов, внутренних органов, а также рецепторы двигательного аппарата, называемые проприоцепторами).
По месту приложения раздражителя рецепторы являются первич-ночувствующими (тактильные, обонятельные, интеропроприоцепторы) и вторичночувствующими (зрительные, слуховые, вестибуляторные, вкусовые).
Рецепторный потенциал возникает при действии внешнего стимула, который в результате появления ионных токов вызывает изменение потенциала покоя рецептора. Проницаемость мембраны рецептора к ионным токам, в основном к токам Na (в меньшей степени – К+, Са2+) меняется. Под действием стимула белковые молекулы белково-липидного слоя мембраны рецептора изменяют свою конфигурацию, и проводимость мембраны для мелких ионов повышается. Когда рецепторный потенциал достигает порогового значения, возникает нервный импульс – распространяющееся возбуждение. Такой рецепторный потенциал называют также генераторным потенциалом.
По функциональным характеристикам рецепторы делят на моно- и полимодальные, спонтанноактивные и молчащие.
Адаптация рецепторов – это снижение уровня их возбуждения под действием постоянно действующего раздражителя.
Функциональное назначение рецепторов с различной степенью адаптации:
– слабо адаптирующиеся рецепторы служат для сигнализации об истинных, абсолютных и мгновенных величинах стимулов;
– быстро и полностью адаптирующиеся рецепторы – для сигнализации об изменениях стимула на фоне шума – внешнего или биологического (пример внутреннего «шума» – спонтанная активность нейрона).
Когда рецепторы адаптируются к постоянно действующему стимулу, они теряют некоторое количество сведений о стимуле, например о его продолжительности. Однако чувствительность адаптированного рецептора к изменениям стимула возрастает. Любое усиление стимула действует на адаптированный рецептор как новый раздражитель.
Чувствительность рецептора – это способность воспринимать раздражитель. Ее характеризуют минимальной величиной стимула, вызывающего возбуждение рецептора. Эта величина называется абсолютным порогом чувствительности. В каждой сенсорной системе рецепторы широко распределены по порогам чувствительности. Например, в зрительной системе максимальная чувствительность рецепторов составляет один квант света, но чувствительность разных элементов отличается в 107 раз. В слуховой системе максимальная чувствительность рецепторов к звуку соответствует механическому смещению базилярной мембраны, но отличается для разных рецепторов в 109 раз.
Порог – это величина, обратно пропорциональная чувствительности. Он является важной характеристикой не только отдельного рецептора, но и сенсорной системы, поскольку чувствительность рецептора значительно выше, чем чувствительность системы в целом.
Сенсорных способностей
При проведении органолептических исследований, в том числе по проверке сенсорных способностей, предъявляются особые требования к условиям для проведения анализа и в первую очередь к помещению.
Рекомендуемая площадь помещения должна быть не менее 36 м2, из которых 15-20 м2 предназначаются для испытателей, а остальная - для подготовки образцов к анализу.
Дегустационная комната должна быть окрашена в светлые, спокойные для глаз тона. В помещении должна быть создана определенная температура (18-25 °С) и относительная влажность воздуха (70 ± 5 %).
Температура окружающей среды и анализируемой пробы влияет на оценку испытателя по-разному. Пребывание в хорошо отапливаемом помещении снижает чувствительность к соленым, кислым и горьким вкусам. Сладкий вкус лучше всего воспринимается при температуре пробы 37 °С, а при 50 °С чувствительность к этому вкусу резко падает. Соленый вкус лучше всего ощущается при температуре около 18 °С, а горький - при 10 °С. Как видно, тепловые зоны оптимального восприятия вкусов различны и одна и та же проба продукта может восприниматься и оцениваться по-разному в зависимости от температуры. Поэтому иногда целесообразно сначала опробовать образец в холодном виде, а затем постепенно подогревать его так, чтобы лучше почувствовать остальные вкусы изделия в оптимальной для них термической зоне.
В помещении должно быть дневное освещение. Свет не должен искажать естественную окраску образцов изделий.
Свет оказывает значительное влияние на чувствительность дегустатора при определении вкуса дегустируемого продукта. Так, например, пребывание человека в темноте в течение 30 мин ухудшает чувствительность к вкусам на 50 %. В связи с этим вкусовые качества анализируемого продукта будут недооцениваться, поэтому органолептический анализ следует проводить в хорошо освещенном помещении.
Не рекомендуется украшать стены лаборатории картинами, чтобы не отвлекать внимание испытателей.
Органолептический анализ рекомендуется проводить в первой половине дня. Не следует назначать время, близкое к обеду или ужину, при этом надо избегать состояний голода или сытости. За полчаса до начала анализа следует воздержаться от курения, еды и напитков.
Состояние организма оказывает очень значительное влияние на восприятие вкусов. Так, например, состояние голода резко повышает чувствительность к сладкому. Но в состоянии насыщения чувствительность падает.
Подсобное помещение, предназначенное для подготовки проб и мытья посуды, следует изолировать от лаборатории, в которой проводится органолептический анализ.
Обстановка должна обеспечивать максимальную сосредоточенность испытателей, исключать влияние различных помех (шума, вибрации, запахов и др.).
Кроме высокой чувствительности органов чувств большое значение для участников органолептического анализа имеет наличие психофизических качеств: каждый испытатель должен обладать такими качествами, как собранность, сосредоточенность, пунктуальность, хорошая память, ответственность, коммуникабельность, самостоятельность в суждениях и отсутствие навязывания своего мнения коллегам.
При проверке сенсорной чувствительности не допускается обмен мнениями!
Между опробованием вкусовых веществ должна быть пауза в течение 1-2 минут.
Определение сенсорной чувствительности включает проверку:
– на "вкусовой дальтонизм" (определение способности распознавать основные виды вкуса - сладкий, соленый, кислый, горький);
– порога вкусовой чувствительности;
– порога разницы интенсивности вкуса;
– способности распознавать характерные запахи;
– порога разницы интенсивности запаха (определение способности различать разницу в интенсивности запаха);
– на дальтонизм (определение способности различать разницу в цвете).
Контрольные вопросы:
1. Какие особые требования к помещению для проведения сенсорного анализа предъявляют?
2. Какие требования предъявляют к условиям внутренней среды помещения для проведения сенсорного анализа?
3. В какое время суток рекомендовано проводить сенсорную оценку продукции?
4. Какими качествами должен обладать дегустатор?
ХИМИЯ ВКУСА
Таблица 1 – Относительная сладость некоторых веществ
| Название | Группа веществ | Относительная сладость |
| Лактоза | Дисахарид | 0,16 |
| Глюкоза | Моносахарид | 0,75 |
| Сахароза | Дисахарид | 1,00 (референсное вещество) |
| Фруктоза | Моносахарид | 1,75 |
| Цикламат натрия | Сульфонат | 26 |
| Аспартам | Метиловый эфир дипетида | 250 |
| Сахаринат натрия | сульфонил | 510 |
Среднестатистические пороги обнаружения некоторых сладких веществ для человека (в миллимолях) представлены в табл. 2:
Таблица 2 – Порог обнаружения некоторых сладких веществ
| Молекула | Порог, мМоль |
| Сахароза | 10 |
| Лактоза | 30 |
| L-пропил-2-амино-4-нитробензол | 2х10 -3 |
В соответствии с требованиями методических рекомендаций 2.3.1.2432-08 «Нормы физиологических потребностей в энергии и пищевых веществах для различных групп населения Российской Федерации» (далее МР 2.3.1.2432-08) потребление добавленного сахара не должно превышать 10% от калорийности суточного рациона.
В таблице 3 представлены данные о рекомендуемых нормах потребления сахара различными группами населения с учетом рекомендуемой им суточной калорийности питания.
Таблица 3 - Рекомендуемые нормы потребления сахара
| Группы населения | Физиологические потребности в энергии | Физиологические потребности в сахарозе, г не более |
| Мужчины | 2100-4200 ккал/сут | 52,5- 105 г/сут |
| Женщины | 1800-3050 ккал/сут | 45-76 г/сут |
| Дети до 1 года | 110-115 ккал/кг массы тела | 2,8-2,9 г/кг массы тела |
| Дети старше 1 года | 1200-2900 ккал/сут | 30-72,5 г/сут |
Солёный вкус.
Соленый вкус в чистом виде присущ только поваренной соли - хлористому натрию. Другие соли, обладающие соленым вкусом, дают дополнительные ощущения сладкого, горького и кислого. Считается, что соленый вкус определяется главным образом катионом натрия (Na+), при этом при молекулярном весе солей ниже 110 преобладает соленый вкус, выше 160 –горький.
Натрий - основной внеклеточный ион, принимающий участие в генерации и передаче электрических нервных сигналов, мышечном сокращении. Недостаток натрия в организме выражается общей слабостью, апатией, головными болями, гипотонией, судорогами. Среднее потребление натрия составляет 3000-5000 мг/сутки, а установленный уровень потребности в нем составляет 1300-1600 мг/сутки. Верхний допустимый уровень не установлен.
Хлориды необходимы для образования и секреции соляной кислоты в желудке, участвуют в регуляции осмотического давления и водного обмена. Среднее потребление хлоридов составляет 5000-7000 мг/сутки, а установленный уровень потребности составляет 2000-2500 мг/сутки.
Верхний допустимый уровень не установлен.
Физиологические потребности в натрии и хлоре, впервые установленные МР 2.3.1.2432-08 представлены в таблице 4.
Таблица 4 - Рекомендуемые нормы потребления натрия и
Хлоридов
| Группы населения | Физиологические потребности в натрии, мг/сутки | Физиологические потребности в хлоридах, мг/сутки |
| взрослые | 1300 | 2300 |
| дети | от 200 до 1300 | от 300 до 2300 |
Натрий и хлор поступают в организм в основном в виде поваренной соли. Потребление большого количества соли ведет к повышению артериального давления и увеличению нагрузки на почки, а также стойкому набору веса. Происходит это из-за удержания в организме излишней жидкости, а еще и потому, что вместе с пищей, богатой солью, люди склонны потреблять больше жиров и сахара и меньше кальция и клетчатки. Подобное питание в течение длительного времени может вызвать сердечно-сосудистые заболевания и болезни печени, диабет, ожирение и даже рак. Считается, что количества соли, поступающего в организм из животных и растительных продуктов вполне достаточно, для нормального функционирования организма.
Физиологическая потребность человека в поваренной соли невелика - около 10 г в сутки, некоторые авторы считают, что достаточно 4 г.
Кислый вкус. Как было отмечено ранее, кислый вкус однозначно ассоциируется с величиной pH жидкости. Механизм восприятия кислого подобен восприятию соленого. Ионы оксония (преимущественно H3O+) возникают при диссоциации кислот. Так как величина pH слюны человека близка к нейтральному значению (рН=7), действие сильных кислот и кислот средней силы вызывает ощущение чисто-кислого вкуса. Однако некоторые слабые органические кислоты и гидролизующиеся ионы (алюминий) могут вызывать и ощущение терпкости (вяжущий вкус).
Горький вкус. Горьким вкусом обладают вещества самого различного строения, имеющие в своем составе следующие группы: (NO2)>2, N=, SH-, -S-,- S-S-, CS-. Горечь, как и сладость, воспринимается посредством G-белков. Исторически горький вкус ассоциировался с неприятным ощущением, и, возможно - с опасностью некоторых растительных продуктов для здоровья. Действительно, большинство растительных алкалоидов одновременно токсичны и горьки, и эволюционная биология имеет основания к такому заключению.
Умами - название вкусового ощущения, производимого свободными аминокислотами, в частности глутаминовой, которые можно найти в ферментированной и выдержанной пище, например сырах пармезан и рокфор, в соевом и рыбном соусах. Также они содержатся в большом количестве неферментированных продуктов, например грецких орехах, винограде, брокколи, помидорах, грибах и, в меньшем количестве, в мясе. К другим ощущениям, близким к вкусовым относятся жгучий вкус, терпкое, жирное, металлический привкус. Выделяют также мятный, щелочной и др. вкусы.
Жгучий вкус не относят к числу основных вкусов, так как до настоящего времени не обнаружены соответствующие вкусовые рецепторы. Он связан с веществами, стимулирующими «тепловые» рецепторы (этанол, капсаицин) - они возбуждают ветви тройничного нерва и вносят свой вклад в «чисто вкусовое» ощущение.
Терпкое - это ощущение («вяжущий вкус») связано с рецепцией дубильных веществ (таннины в чае, в ягодах терна и др.). Механизм его возникновения объясняют связыванием таннинов с белками, богатыми пролином.
Жирное. Человек, несомненно, воспринимает «жирный» вкус - но это ощущение не так чётко выражено, как обычно выделяемая стандартная тетрада «сладкий-кислый-горький-солёный».
Металлический привкус характерен для свежей (несвернувшейся) крови, а также обычно чувствуется у пищи, которая соприкасалась с окисленными металлами (ложки, вилки, банки). Особенно сильный металлический привкус наблюдается при контакте с медными сплавами - латунью, мельхиором и др., поэтому столовые предметы из мельхиора и нейзильбера покрывают тонким слоем серебра. Это ощущение может служить признаком некоторых заболеваний; отравлений металлами (напр., при литейной лихорадке) или пестицидами, действия некоторых лекарственных средств и др. Металлический вкус во рту обычно также возникает во время проведения процедуры электрофореза.
Пищевые продукты имеют либо какой - то один вкус (сахар - сладкий, поваренная соль - соленый, кислоты - кислый), либо отмечаются сочетанием основных видов вкуса. В этом случае можно говорить о гармоничном и негармоничном сочетании вкуса. Примером могут служить сладко-кислый вкус плодов, некоторых кондитерских изделий, сладко-горький вкус шоколада, кисло-соленый вкус квашеных овощей, солено горький - маслин. Негармоничными считаются сочетания солено-сладкий и горько-кислый. Они не свойственны пищевым продуктам и возникают, как правило, вследствие порчи.
Разные виды вкуса при сочетании могут смягчать или усиливать друг друга. Так, сладкий вкус смягчает кислый и горький, кислый усиливает соленый и горький.
Качественное определение вкуса связано не только с определением основных вкусовых ощущений (сладкого, кислого, соленого, горького) и их гармоничного сочетания, но и с осязанием пищи, что характеризуется терпкостью вкуса, остротой, жгучестью. Вкус многих продуктов определяется также обонятельными ощущениями.
Для характеристики комплекса впечатлений вкуса, запаха и осязания, определенных количественно и качественно, применяется определение "вкусность пищевых продуктов".
Расстройства вкуса - дисгевзии. Дисгевзия возникает по разным причинам - беременность, сахарный диабет, заболевания желудочно-кишечного тракта или ротовой полости, анемия, гипотиреоз и др.
Выделяют различные виды дисгевзий:
– агевзия - потеря одного из основных вкусовых ощущений,
– гипогевзия - ослабление одного из ощущений,
– парагевзия - когда вместо сладкого, ощущается соленое,
– фантагевзия - когда ощущение того или иного вкуса наблюдается без явных физических причин, например, при неврозах.
– бридость - временная потеря или искажение вкуса у повара или кондитера, аналогично потере голоса у певцов, которая возникает в результате переутомления, возбуждения, заболевания органов внутренней секреции или в результате ожогов полости рта при опробовании горячей пищи или напитков и исчезает после получения отдыха.
Изменение вкуса отмечается довольно часто: при инфекционных и желудочно-кишечных заболеваниях, при заболеваниях ротовой полости и полости носа, при органических поражениях головного мозга, при наркомании и длительном приеме различных лекарственных препаратов. Психиатрам известно, что на ранних стадиях шизофрении многие больные жалуются на неприятный вкус или безвкусность пищи. С патологией вкусового анализатора у таких больных, по-видимому, связаны частичный или полный отказ от пищи, а также бредовые идеи отравления и отдельные варианты ипохондрического бреда. Феномен понижения и извращения вкуса встречается у 0,5 % всех больных. Больные с понижением вкусовой чувствительности обычно страдают также снижением обоняния и аппетита. Они, как правило, худеют и долго, но не всегда успешно, лечатся. Для некоторых из них прием пищи нередко превращается в мучительное испытание из-за того, что пищевые продукты приобретают скверный, порою зловонный запах и вкус. Показано, что такие состояния могут быть связаны со снижением в организме меди и цинка, и в этих случаях хорошо помогают пилюли, содержащие сульфат цинка.
Многие лекарства способны изменить ощущения вкуса, особенно часто наблюдается «металлический вкус». К медикаментам, изменяющим вкусовые ощущения, можно отнести следующие группы препаратов: антибактериальные, гиполипидемические, седативные и противосудорожные препараты, антихолинергические, нестероидные противовоспалительные и сердечно-сосудистые (ингибиторы АПФ, антагонисты кальция).
Ощущение вкуса может возникать под действием радиоактивного облучения, в ряде случаев при уровнях около 1 р/ч.
Лабораторная работа № 1
Проверка на "вкусовой дальтонизм"
Цель работы: научиться выявлять индивидуальную способность распознавания вкуса.
Оборудование, посуда и реактивы:
Весы лабораторные 2-го класса точности по ГОСТ 24104;
Стаканы химические по ГОСТ 25336 В-1-50;
Колбы мерные по ГОСТ 1770 вместимостью 100мл, 1000мл;
Неметаллические ложки;
Сахароза
Хлористый натрий,
Винная или лимонная кислота или кофеин;
Хинингидрохлорид или серно - кислый магний
Вода дистиллированная.
Подготовка к исследованию.
Для проверки отсутствия аномалии вкусового анализатора готовят основные растворы вкусовых веществ, путем дальнейшего разбавления которых готовят пробы с низкой концентрацией для определения способности определять основные виды вкуса.
Основные растворы вкусовых веществ готовят следующим образом:
– сладкого вкуса – 10 % раствор сахарозы;
– соленого вкуса – 1 % раствор хлористого натрия;
– кислого вкуса – 1 % раствор винной или лимонной кислоты, кофеина;
– горького вкуса - 0,1% раствор хинингидрохлорида или 10 % раствор серно - кислого магния.
Для приготовления растворов вместо дистиллированной воды рекомендуется использовать кипяченную охлажденную питьевую воду и высушенные до постоянного веса высокоочищенный мелкозернистый сахар и поваренную соль, а также химически чистые препараты винной или лимонной кислот, кофеина, хинингидрохлорида и серно - кислого магния.
Приготовленные рабочие растворы разливают в девять колб по 1000 мл, при чем растворы трех видов вкуса должны быть повторены двукратно, а один трехкратно. Например: растворы сладкого, соленого и горького вкуса разливают в две колбы каждый, а раствор кислого вкуса - в три колбы.
Каждая пробе присваивают цифровое или буквенное обозначение.
На рабочем месте испытуемого лица помещают десять образцов: в девяти закодированных колбах находятся приготовленные рабочие растворы и в одном сосуде - вода.
Раствор вводится в полость рта нержавеющей ложкой и должен омывать всю полость. Между опробованием вкусовых веществ должна быть пауза в течение 1-2 минут.
Обработка результатов.
Правильное определение всех девяти образцов с четырьмя видами вкуса или идентификация их не более чем с двумя ошибками означает выполнение сенсорного минимума на способность определять четыре основных вкуса, т. е. отсутствие "вкусового дальтонизма".
Лица, прошедшие пробу на "вкусовой дальтонизм", признаются способными к идентификации вкусов и годными для проверки вкусовой чувствительности.
Лабораторная работа № 2
Таблица 5 - Рекомендуемая форма анкеты по проверке вкусовой чувствительности
| № строки | 1 (вода) | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| ответ |
При ответе проставлять обозначения:
0 - если впечатление полностью отсутствует, + - если вкус воспринят, но ощущения слабые (порог ощущения),
++ - если вкус однозначно опознан (порог распознавания).
Считается, что испытуемый выдержал проверку, если его идентификация вкуса оказалась не ниже, чем:
– для раствора сахарозы – 0,4 %,
– для раствора поваренной соли – 0,1 %,
– для раствора винной кислоты – 0,014 %,
– для раствора лимонной кислоты – 0,02 %,
– для раствора кофеина – 0,004 %,
– для раствора хинингидрохлорида – 0,00015 %,
– для раствора сернокислого магния – 0,35 %.
Пороговые величины вкусовой чувствительности индивидуальны. Причем возможно избирательное повышение абсолютного порога к отдельным веществам, вплоть до полной «вкусовой слепоты». Различия во вкусовых порогах характерны не только для разных людей, но и для одного и того же человека в различных состояниях (болезнь, беременность, усталость и т.п.).
К сладкому
Цель работы: научиться устанавливать индивидуальный порог вкусовой чувствительности к сладкому.
Оборудование, посуда и реактивы:
Весы лабораторные 2-го класса точности по ГОСТ 24104; стаканы химические по ГОСТ 25336 В-1-50; колбы мерные по ГОСТ 1770 вместимостью 100мл, 1000мл; нержавеющие ложки; сахароза вода дистиллированная.
Подготовка к исследованию.
Для определения индивидуальной величины порогов вкусовой чувствительности готовят рабочие растворы сахарозы в концентрациях, приведенных в табл. 6, разбавляя соответствующий основной раствор.
Таблица 6 - Концентрация рабочих растворов сахарозы, %
| № пробирок | 1 (вода) | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Концентрация сахарозы,% | 0,0 | 0,1 | 0,2 | 0,3 | 0,4 | 0,5 | 0,6 | 0,7 | 0,8 | 0,9 |
Изготовленные рабочие растворы обозначают цифрами или буквами.
Проведение исследования.
Сначала подается вода (контрольный образец), а затем растворы сахарозы в возрастающей концентрации, начиная от величины ниже пороговой до величины выше пороговой. Испытуемые лица должны определить наличие вкусового возбуждения и охарактеризовать его качество (сладкий), а также определить интенсивность вкусового возбудителя (слабосладкий, сладкий, очень сладкий).
Заполняется анкета проверки вкусовой чувствительности (табл. 5).
Обработка результатов. Считается, что испытуемый выдержал проверку, если его идентификация вкуса для раствора сахарозы оказалась не ниже чем - 0,4 %.
Для количественной оценки полученных результатов предлагается шкала чувствительности к сахарозе (таблица 7).
Таблица 7 - Количественная обработка результатов
| № пробирок | 1(вода) | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Концентрация сахарозы, % | 0,0 | 0,1 | 0,2 | 0,3 | 0,4 | 0,5 | 0,6 | 0,7 | 0,8 | 0,9 |
| % распознавания вкуса | - | 100 | 95 | 90 | 85 | 80 | 75 | 70 | 65 | 60 |
– 90-100 %- высокая чувствительность к сахарозе;
– 85 %- хорошая чувствительность к сахарозе;
– 70-80 %- удовлетворительная чувствительность к сахарозе;
– 60- 65 % –низкая чувствительность к сахарозе;
– менее 60% –отсутствие чувствительности к сахарозе.
К солёному
Цель работы: научиться устанавливать индивидуальный порог вкусовой чувствительности к соленому.
Оборудование, посуда и реактивы:
Весы лабораторные 2-го класса точности по ГОСТ 24104; Стаканы химические по ГОСТ 25336 В-1-50; Колбы мерные по ГОСТ 1770 вместимостью 100мл, 1000мл; Нержавеющие ложки; Поваренная соль; Вода дистиллированная.
Подготовка к исследованию.
Для определения индивидуальной величины порогов вкусовой чувствительности готовят рабочие растворы поваренной соли в концентрациях, приведенных в табл. 8, разбавляя соответствующий основной раствор.
Таблица 8.- Концентрация рабочих растворов поваренной соли, %
| № пробирок | 1 (вода) | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Концентрация поваренной соли, % | 0,0 | 0,05 | 0,08 | 0,1 | 0,12 | 0,14 | 0,16 | 0,18 | 0,20 | 0,22 |
Изготовленные рабочие растворы обозначают цифрами или буквами.
Проведение исследования.
Сначала подается вода (контрольный образец), а затем растворы поваренной соли в возрастающей концентрации, начиная от величины ниже пороговой до величины выше пороговой. Испытуемые лица должны определить наличие вкусового возбуждения и охарактеризовать его качество (соленый), а также определить интенсивность вкусового возбудителя (слабосоленый, соленый, очень соленый).
Заполняется анкета проверки вкусовой чувствительности к соленому (табл. 5).
Обработка результатов. Считается, что испытуемый выдержал проверку, если его идентификация вкуса для раствора поваренной соли оказалась не ниже чем – 0,1 %. Для количественной оценки полученных результатов предлагается шкала чувствительности к поваренной соли, представленная в таблице 9.
Таблица 9 - Количественная обработка результатов определения порога вкусовой чувствительности к поваренной соли
| № пробирок | 1(вода) | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Концентрация сахарозы, % | 0,0 | 0,1 | 0,2 | 0,3 | 0,4 | 0,5 | 0,6 | 0,7 | 0,8 | 0,9 |
| Концентрация поваренной соли, % | 0,0 | 0,05 | 0,08 | 0,1 | 0,12 | 0,14 | 0,16 | 0,18 | 0,20 | 0,22 |
| % распознавания вкуса | - | 100 | 95 | 90 | 85 | 80 | 75 | 70 | 65 | 60 |
– 95-100 %- высокая чувствительность к поваренной соли;
– 90 %- хорошая чувствительность к поваренной соли;
– 75-85 %- удовлетворительная чувствительность к поваренной соли;
– 60-70 % –низкая чувствительность к поваренной соли;
– менее 60% –отсутствие чувствительности к поваренной соли.
Подготовка к исследованию.
Для определения индивидуальной величины порогов вкусовой чувствительности готовят рабочие растворы лимонной или винной кислот, или кофеина в концентрациях, приведенных в табл. 10, разбавляя соответствующие основные растворы.
Таблица 10 - Концентрации рабочих растворов лимонной и винной кислот, кофеина, %
| № пробирок | 1 (вода) | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Концентрация лимонной кислоты, % | 0,0 | 0,010 | 0,012 | 0,014 | 0,016 | 0,018 | 0,02 | 0,022 | 0,024 | 0,026 |
| Концентрация винной кислоты, % | 0,0 | 0,005 | 0,010 | 0,012 | 0,014 | 0,016 | 0,018 | 0,020 | 0,021 | 0,022 |
| Концентрация кофеина, % | 0,0 | 0,003 | 0,0036 | 0,0038 | 0,004 | 0,0043 | 0,0045 | 0,0048 | 0,0050 | 0,0055 |
Изготовленные рабочие растворы обозначают цифрами или буквами.
Проведение исследования.
Сначала подается вода (контрольный образец), а затем растворы лимонной или винной кислот, или кофеина, в возрастающей концентрации, начиная от величины ниже пороговой до величины выше пороговой. Испытуемые лица должны определить наличие вкусового возбуждения и охарактеризовать его качество (кислый), а также определить интенсивность вкусового возбудителя (слабокислый, кислый, очень кислый).
Заполняется анкета проверки вкусовой чувствительности к кислому (табл. 5).
Обработка результатов. Считается, что испытуемый выдержал проверку, если его идентификация вкуса для раствора винной кислоты не ниже 0,014 %, раствора лимонной кислоты - не ниже 0,02 %, раствора кофеина - не ниже 0,004 %. Для количественной оценки полученных результатов предлагается шкала чувствительности к указанным соединениям, представленная в таблице 11.
Таблица 11 - Количественная обработка результатов определения порога вкусовой чувствительности к кислому вкусу
| № пробирок | 1 (вода) | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| А. Концентрация лимонной кислоты, % | 0,0 | 0,010 | 0,012 | 0,014 | 0,016 | 0,018 | 0,02 | 0,022 | 0,024 | 0,026 |
| В. Концентрация винной кислоты, % | 0,0 | 0,005 | 0,010 | 0,012 | 0,014 | 0,016 | 0,018 | 0,020 | 0,021 | 0,022 |
| С. Концентрация кофеина, % | 0,0 | 0,003 | 0,0036 | 0,0038 | 0,004 | 0,0043 | 0,0045 | 0,0048 | 0,0050 | 0,0055 |
| % распознавания вкуса | - | 100 | 95 | 90 | 85 | 80 | 75 | 70 | 65 | 60 |
А: – 70-100 % - высокая чувствительность к лимонной кислоте;
– 75 % - хорошая чувствительность к лимонной кислоте;
– 65-70 % - удовлетворительная чувствительность к лимонной кислоте;
– 60 % – низкая чувствительность к лимонной кислоте;
– менее 60% –отсутствие чувствительности к лимонной кислоте.
В: – 90-100 % - высокая чувствительность к винной кислоте;
– 85 % - хорошая чувствительность к винной кислоте;
– 70-80 % - удовлетворительная чувствительность к винной кислоте;
– 60-65 % – низкая чувствительность к винной кислоте;
– менее 60% – отсутствие чувствительности к винной кислоте.
С: – 90-100 % - высокая чувствительность к кофеину;
– 85 % - хорошая чувствительность к кофеину;
– 70-80 % - удовлетворительная чувствительность к кофеину;
– 60-65 % – низкая чувствительность к кофеину;
– менее 60% – отсутствие чувствительности к кофеину.
К горькому
Цель работы: научиться устанавливать индивидуальный порог вкусовой чувствительности к горькому вкусу.
Оборудование, посуда и реактивы:
Весы лабораторные 2-го класса точности по ГОСТ 24104;
Стаканы химические по ГОСТ 25336 В-1-50; Колбы мерные по ГОСТ 1770 вместимостью 100мл, 1000мл; Нержавеющие ложки; Хинингидрохлорид или сернокислый магний; Вода дистиллированная.
Подготовка к исследованию.
Для определения индивидуальной величины порогов вкусовой чувствительности готовят рабочие растворы хинингидрохлорида или сернокислого магния в концентрациях, приведенных в табл. 12, разбавляя соответствующие основные растворы.
Таблица 12 - Концентрации рабочих растворов хинингидрохлорида и сернокислого магния, %
| № пробирок | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Концентрация хинингидрохлорида, % | 0,0 | 0,00005 | 0,00007 | 0,00009 | 0,00011 | 0,00013 | 0,00015 | 0,00018 | 0,0002 | 0,00022 |
| Концентрация сернокислого магния, % | 0,0 | 0,1 | 0,13 | 0,17 | 0,21 | 0,27 | 0,35 | 0,45 | 0,57 | 0,73 |
Изготовленные рабочие растворы обозначают цифрами или буквами.
Проведение исследования.
Сначала подается вода (контрольный образец), а затем растворы хинингидрохлорида или сернокислого магния в возрастающей концентрации, начиная от величины ниже пороговой до величины выше пороговой. Испытуемые лица должны определить наличие вкусового возбуждения и охарактеризовать его качество (горький), а также определить интенсивность вкусового возбудителя (слабо горький, горький, очень горький).
Заполняется анкета проверки вкусовой чувствительности к горькому (табл. 5).
Обработка результатов. Считается, что испытуемый выдержал проверку, если его идентификация вкуса для раствора хинингидрохлорида не ниже 0,00015 %, раствора сернокислого магния - не ниже 0,35 %. Для количественной оценки полученных результатов предлагается шкала чувствительности к указанным соединениям, представленная в таблице 13.
Таблица 13 - Количественная обработка результатов определения порога вкусовой чувствительности к горькому вкусу
| № пробирок | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| А. Концентрация хинингидрохлорида, % | 0,0 | 0,00005 | 0,00007 | 0,00009 | 0,00011 | 0,00013 | 0,00015 | 0,00018 | 0,0002 | 0,00022 |
| В. Концентрация сернокислого магния, % | 0,0 | 0,1 | 0,13 | 0,17 | 0,21 | 0,27 | 0,35 | 0,45 | 0,57 | 0,73 |
| % распознавания вкуса | - | 100 | 95 | 90 | 85 | 80 | 75 | 70 | 65 | 60 |
А: – 70-100 % - высокая чувствительность к хинингидрохлориду;
– 75 % - хорошая чувствительность к хинингидрохлориду;
– 65-70 % - удовлетворительная чувствительность к хинингидрохлориду;
– 60 % – низкая чувствительность к хинингидрохлориду;
– менее 60% –отсутствие чувствительности к хинингидрохлориду.
В: – 70-100 % - высокая чувствительность к сернокислому магнию;
– 75 % - хорошая чувствительность к сернокислому магнию;
– 60 % - удовлетворительная чувствительность к сернокислому магнию;
– 60-65 % – низкая чувствительность к сернокислому магнию;
– менее 60% – отсутствие чувствительности к сернокислому магнию.
Лабораторная работа № 2
И интенсивности вкуса
Цель работы: научиться устанавливать индивидуальный порог разницы интенсивности вкуса.
Оборудование, посуда и реактивы:
Весы лабораторные 2-го класса точности по ГОСТ 24104; стаканы химические по ГОСТ 25336 В-1-50; колбы мерные по ГОСТ 1770 вместимостью 100мл, 1000мл; нержавеющие ложки; сахароза хлористый натрий
Винная или лимонная кислоты хинингидрохлорид; вода дистиллированная.
Подготовка к исследованию.
Пороги разницы интенсивности вкуса определяют при помощи растворов химически чистых вкусовых веществ, представленных в двух концентрациях выше пороговых. Концентрации водных растворов для определения порогов разницы представлены в табл. 14.
Таблица 14 - Концентрация вкусовых веществ для определения порогов разницы интенсивности вкуса
| Вид вкуса | Название раствора для проверки порога разницы интенсивности вкуса | Концентрация рабочих растворов, % | ||
| Сладкий | Раствор сахарозы | 0,50 | 0,75 | |
| Соленый | Раствор хлористого натрия | 0,15 | 0,25 | |
| Кислый | Раствор винной кислоты | 0,018 | 0,026 | |
| Раствор лимонной кислоты | 0,020 | 0,025 | ||
| Горький | Раствор хинилгидрохлорида | 0,00015 | 0,0003 | |
Количество необходимых растворов зависит от числа лиц, принимающих участие в испытании, и метода проведения пробы (парная или тройная). Каждая проба нумеруется, записывается вид вкуса и концентрация, соответствующая данному обозначению образца. Определение порогов разницы интенсивности вкусов проводят методами парной или тройной пробы.
Проведение исследования.
При определении порога разницы методом парной пробы подают растворы с двумя концентрациями в семи парных повторностях по каждому виду вкуса. Между отдельными видами вкуса должны быть интервалы не менее 10 мин.
Испытуемый оценивает все образцы парных проб, отмечая на бланке знаками (+) номера образцов, которые характеризуются высшей интенсивностью вкуса в каждой пробе. Для каждого вида вкуса записывается отдельная анкета.
Обработка результатов.
Положительным результатом считается правильное определение шести пар из семи пар образцов.
Проведение исследования.
При определении порога разницы интенсивности вкуса методом тройной пробы к оценке подают растворы с двумя концентрациями в тройной системе, причем одна концентрация представлена двумя растворами, а другая – одним.
Тройные пробы подают в семи повторностях (21 образец). Испытуемый определяет, какие два образца из каждых трех имеют одинаковую интенсивность вкуса, а также насколько непарный образец обладает высшей или низшей интенсивностью вкуса по сравнению с парным.
Анкета проверки на определение порога разницы интенсивности вкуса методом тройной пробы представлена в табл. 15.
Таблица 15 - Кодирование образцов при методе тройной пробы
| Коды образцов | |||||||||||||
| I | 1 | II | 4 | III | 7 | IV | 10 | V | 13 | VI | 16 | VII | 19 |
| 2 | 5 | 8 | 11 | 14 | 17 | 20 | |||||||
| 3 | 6 | 9 | 12 | 15 | 18 | 21 | |||||||
Обработка результатов.
При тройной пробе испытуемый считается выдержавшим испытание, если правильно узнал разницу интенсивности вкуса в пяти тройных пробах из семи.
При помощи двойной и тройной проб можно определить порог разницы интенсивности вкуса и степень повторяемости правильных распознаваний.
На предприятиях пищевой промышленности пороги разницы рекомендуется определять только для видов вкуса, которые оценщики будут чаще всего встречать в своей работе, например, сладкий - для работников кондитерской промышленности, соленый - для работников мясной промышленности и т.д.
Выводы. По результатам оценки "вкусового дальтонизма" (определения способности распознавать основные виды вкуса – сладкий, соленый, кислый, горький), порога вкусовой чувствительности и порога разницы интенсивности вкуса подводится итог проверки индивидуальной вкусовой чувствительности.
Лабораторная работа № 4.
Таблица 16 - Свойства основных пищевых кислот
| Кислота | Эмпирическая формула | Молекулярная масса | Температура плавления, °С | Растворимость, г/100 мл Н2О при 25°С |
| Уксусная | С2Н4О2 | 60,05 | -8,5 | Смешивается |
| Молочная | С3Н6О3 | 90,08 | 16,8 | Хорошо растворима |
| Лимонная | С6Н8О6 | 192,12 | 153,0 (безв.) | 181 |
| Яблочная | С4Н6О5 | 134,09 | 132,0 | 62 |
| Винная | С4Н6О6 | 150,09 | 168-170 | 147 |
| Янтарная | С4Н6О4 | 118,09 | 188,0 | 6,8 |
| Янтарный ангидрид | С4Н4О3 | 100,07 | 118,3 | Мало растворима |
| Адипиновая | С6Н10О4 | 146,14 | 152,0 | 1,9 (при +20°С) |
| Фумаровая | С4Н4О 4 | 116,07 | 286,0 | 0,5 (при +20°С) |
| Фосфорная | Н3РО 4 | 98,00 | 42,4 | Хорошо растворима в горячей воде |
Разрешенные для пищевого использования органические кислоты, как правило, безвредны для организма, в связи с чем, их применение не лимитируется в гигиеническом отношении, а регламентируется лишь технологическими инструкциями на конкретные пищевые продукты. Исключение составляет обладающая токсичностью фумаровая кислота, допустимая суточная доза которой установлена на уровне 6 мг на 1 кг массы тела.
Уксусная кислота является наиболее известной пищевой кислотой и выпускается в виде эссенции, содержащей 70-80% собственно кислоты. В быту используют разбавленную водой уксусную эссенцию, получившую название столовый уксус. Уксусную кислоту получают путем уксуснокислого брожения. Соли и эфиры этой кислоты имеют название ацетаты. Основная область использования – овощные консервы и маринованные продукты.
Молочная кислота выпускается в двух формах, отличающихся концентрацией: 40%-й раствор и концентрат, содержащий не менее 70% кислоты. Получают молочнокислым брожением сахаров. Ее соли и эфиры называются лактатами. Используется в производстве безалкогольных напитков, карамельных масс, кисломолочных продуктов. Молочная кислота имеет ограничения к применению в продуктах детского питания.
Лимонная кислота – продукт лимоннокислого брожения Сахаров. Имеет наиболее мягкий вкус по сравнению с другими пищевыми кислотами и не оказывает раздражающего действия на слизистые пищеварительного тракта. Соли и эфиры лимонной кислоты – цитраты. Применяется в кондитерской промышленности, при производстве безалкогольных напитков и некоторых видов рыбных консервов.
Яблочная кислота обладает менее кислым вкусом, чем лимонная и винная. Для промышленного использования эту кислоту получают синтетическим путем из малеиновой кислоты, в связи с чем критерии чистоты включают ограничения по содержанию в ней примесей токсичной малеиновой кислоты. Соли и эфиры яблочной кислоты называются малатами. Яблочная кислота обладает химическими свойствами оксикислот. При нагревании до 100°С превращается в ангидрид. Применяется в кондитерском производстве и при получении безалкогольных напитков.
Винная кислота является продуктом переработки отходов виноделия (винных дрожжей и винного камня). Не обладает каким-либо существенным раздражающим действием на слизистые оболочки желудочно-кишечного тракта и не подвергается обменным превращениям в организме человека. Основная часть (около 80%) разрушается в кишечнике под действием бактерий. Соли и эфиры винной кислоты называются тартратами. Применяется в кондитерских изделиях и в безалкогольных напитках.
Янтарная кислота представляет собой побочный продукт производства адипиновой кислоты. Известен также способ ее выделения из отходов янтаря. Обладает химическими свойствами, характерными для ди-карбоновых кислот, и образует соли и эфиры, которые получили название сукцинаты. При 235°С янтарная кислота отщепляет воду, образуя янтарный ангидрид. Используется в пищевой промышленности для регулирования рН пищевых систем.
Адипиновая кислота получается в промышленности, главным образом, двухстадийным окислением циклогексана. Обладает всеми химическими свойствами, характерными для карбоновых кислот, в частности, образует соли, большинство из которых растворимо в воде. Легко этерифи-цируется в моно- и диэфиры. Соли и эфиры адипиновой кислоты получили название адипинаты. Является пищевой добавкой, обеспечивающей кислый вкус продуктов, в частности, безалкогольных напитков.
Фумаровая кислота содержится во многих растениях и грибах, образуется при брожении углеводов в присутствии Aspergillus fumaricus. Промышленный способ основан на изомеризации малеиновой кислоты под действием НС1, содержащей Вг. Соли и эфиры называются фумаратами.
В пищевой промышленности фумаровую кислоту используют как заменитель лимонной и винной кислот. Обладает токсичностью, в связи с чем суточное потребление с продуктами питания лимитировано уровнем 6 мг на 1 кг массы тела.
Фосфорная кислота и ее соли – фосфаты (калия, натрия и кальция) широко распространены в пищевом сырье и продуктах его переработки. В высоких концентрациях фосфаты содержатся в молочных, мясных и рыбных продуктах, в некоторых видах злаков и орехов. Фосфаты вводятся в безалкогольные напитки и кондитерские изделия. Допустимая суточная доза в пересчете на фосфорную кислоту соответствует 5–15 мкг на кг массы тела, поскольку избыточное количество ее в организме может стать причиной дисбаланса кальция и фосфора.
Порядок выполнения
В три пробирки поместите по 3 капли ледяной уксусной кислоты CH3COOH, винной кислоты и лимонной кислоты. Из каждой пробирки стеклянной палочкой перенесите каплю раствора на полоску универсальной индикаторной бумаги. Приложите к шкале (она нанесена на упаковке) и определите значение pH, характерное для каждой кислоты.
Наблюдения
Какова окраска универсальной индикаторной бумаги? Какие значения pH вы определили в каждом случае? Запишите значения.
Запишите уравнение реакции
CH3COOH → CH3COO- + Н+
уксусная кислота ацетат-анион катион водорода
Выводы: (содержат ответы на следующие вопросы)
1. Какова сила карбоновых кислот?
2. От каких факторов зависит сила карбоновых кислот? Приведите примеры сильных карбоновых кислот.
3. Какие карбоновые кислоты используют в качестве консервантов?
Дополнительные вопросы:
1. Какие природные карбоновые кислоты Вы знаете? В каких продуктах питания они встречаются?
2. Какая кислота отвечает за запах прогорклого масла?
Различной концентрации
В 5 стеклянных стаканчиков на 50см3 поместите образцы пищевых продуктов, имеющих кислый вкус, например, соки или напитки из плодов и ягод, молочная сыворотка, пектиновый экстракт. В другие 5 стаканчиков добавьте постепенно увеличивающееся количество 1%-ного раствора винной кислоты – в первый стакан 1 мл, второй – 5 мл, в третий – 10 мл, в четвертый – 15 мл, в пятый – 20мл и доведите до метки 50см 3 дистиллированной водой.
Внимательно ознакомьтесь с принципом действия и правилами работы на приборе - потенциометре.
С помощью откалиброванного прибора определите значение активной кислотности – рH.
Параллельно проведите органолептическую оценку продуктов и растворов кислоты в стаканчиках. Дегустацию начинайте с менее кислых, затем пробуйте продукты и растворы, имеющие большие значения кислотности. Между образцами можно полоскать рот питьевой водой.
Установите, при каких значениях рН вкус продуктов и растворов становится очень сильным, резким и неприятным.
Определите индивидуальные пределы ощущения кислого вкуса.
Полученные результаты занесите в таблицу17.
Таблица17 - Результаты оценки активной кислотности различных продуктов
| № стакана | Продукт или раствор | Значение рН | Органолептическая характеристика |
Лабораторная работа № 5
Изучение свойств алкалоидов
Алкалоиды (от позднелат. alcali-щёлочь и греч. eidos-вид), азотсодержащие органические основания природного. (преим. рас-тительного) происхождения. Помимо С, Н и N молекулы алкалоиды могут содержать атомы S, реже-С1 или Вг. Обычно алкалоидам присваивают тривиальные названия, используя видовые или родовые названия алкалоидоносов с прибавлением суффикса "ин", например, атропин (выделен из растения Atropa belladonna), стрихнин (выделен из Strychnos nux Vomica). Наиболее принятая классификация алкалоидов основана на строении углеродно-азотного скелета молекулы (напр., изохинолиновые алкалоиды, пептидные алкалоиды, пиридиновые алкалоиды, пуриновые алкалоиды, хиназолиновые алкалоиды, хинолиновые алкалоиды). Алкалоиды классифицируют также по филогенетическому признаку, объединяя в одну группу все соединения, выделенные из растений одного рода (напр., алкалоиды дафнифиллума, алкалоиды ипекакуаны, алкалоиды ликоподиума). Иногда алкалоиды систематизируют по их биогенетическим предшественникам, различая группы алкалоидов, в биосинтезе которых участвуют орнитин и пролин, лизин, фенилаланин, триптофан, антраниловая к-та и гистидин. Однако такая классификация часто не позволяет однозначно отнести тот или иной алкалоид, особенно сложной структуры, к определенной группе.
Выделено несколько тысяч алкалоидов. Содержание их в рас-тениях невелико (0,001-2%), однако известны уникальные растения, в которых оно достигает 10-18% (напр., хинное дерево, листья та-бака, трахелантус). Часто алкалоиды локализуются лишь в опреде-ленных органах растения, например, в листьях, семенах, клубнях, корнях, коре. Химическая структура и содержание алкалоидов в растении обычно сильно зависят от периода вегетации растения и места его произрастания. Многие алкалоиды, особенно сложного строения (например,морфин, хинин), специфичны для растений оп-ределенных родов и даже семейств, что широко используется для установления их филогенетического родства.
Большинство алкалоидов - гетероциклич. соединения. В рас-тениях они существуют обычно в виде солей органических кислот.
Алкалоиды экстрагируют (обычно с помощью СНС13 или С1СН2СН2С1) из предварительно смоченного щелочными агентами (NH4OH, Na2CO3 и др.) растительного сырья, либо непосредственно из этого сырья водным раствором кислоты или спиртом, например, метанолом, этанолом.
Структурное многообразие и относительная доступность алка-лоидов позволяют широко использовать их в качестве модельных соединений при изучении взаимосвязи структуры с физиологической активностью или физико-химическими свойствами. Некоторые алкалоиды - сильные яды (напр., стрихнин, тубокурарин). Многие алкалоиды обладают специфическим, зачастую уникальным фи-зиологическим действием и используются в медицине (напр., атро-пин, кодеин, кофеин, папаверин, эфедрин).
Качественные реакции
I. Реакции осаждения основаны на способности алкалоидов к комплексообразованию. Образующиеся комплексы нерастворимы или мало растворимы в воде.
Общеалкалоидные осадочные реактивы можно разделить на несколько групп:
1. Йод и его растворы. Образуют с алкалоидами перйодиды, плохо растворимые в воде:
– пары йода используют для открытия алкалоидов на хроматограммах;
– раствор йода в растворе калия йодида – K[I3] (реактив Вагнера, реактив Бушарда). С алкалоидами образуют бурые, трудно растворимые в воде осадки.
2. Комплексные йодиды металлов:
– реактив Драгендорфа – раствор висмута основного нитрата и калия йодида с добавлением кислоты уксусной - К[BiI4] (калия тетрайодовисмутат) - образует оранжевые или красно-бурые нерастворимые осадки.
Реакцию с реактивом Драгендорфа, согласно действующей НД, используют для обнаружения (проявления) алкалоидов крестовника плосколистного на хроматограмме в качественном и количественном анализе, алкалоидов травы термопсиса очередноцветкового на хроматограмме в количественном анализе;
– реактив Майера – раствор ртути дихлорида и калия йодида - K2[HgI4] (тетрайодомеркурат калия) - образует осадки белого или желтоватого цвета.
Реакцию с реактивом Майера широко используют для проверки полноты экстракции алкалоидов при их количественном определении в листьях и траве красавки обыкновенной, в листьях белены черной, листьях дурмана обыкновенного, траве эфедры хвощевой, семенах чилибухи.
3. Реактивы комплексных неорганических кислот:
– реактив Бертрана – 1 %-ный водный раствор кислоты кремневольфрамовой (SiO2· 12WO3 · 2Н2O) - образует белый аморфный осадок.
Реакцию с реактивом Бертрана используют для подтверждения наличия алкалоидов в извлечении из листьев барбариса обыкновенного (качественная реакция); для проверки полноты экстракции алкалоидов при их количественном определении в траве крестовника плосколистного и траве чистотела, листьях и корнях барбариса обыкновенного, семенах дурмана индейского;
– реактив Шейблера – 1 %-ный водный раствор кислоты фосфорно-вольфрамовой (Н3РО4 · 12WO3 · 2Н2O) - образует белые аморфные осадки;
– реактив Зонненштейна – 1 %-ный водный раствор кислоты фосфорно-молибденовой (Н3РО4 · 12МoО3 · 2H2О) - образует желтоватые аморфные осадки.
Все эти реактивы высокочувствительны и часто используются в научно-исследовательских работах.
4. Органические соединения кислотного характера:
– раствор кислоты пикриновой - образует осадки желтого цвета.
Реакцию используют для осаждения алкалоида скополамина при его гравиметрическом определении в семенах дурмана индейского;
– раствор таннина - образует беловатые или бурые осадки.
Таннин используют в качестве противоядия при отравлении алкалоидами.
II. Реакции окрашивания (частные реакции) основаны на окислении, конденсации, дегидратации алкалоидов концентрированными кислотами и другими окислителями. Используют:
– концентрированную кислоту серную - качественная реакция на корни барбариса обыкновенного (берберин) (оранжево-красное окрашивание);
– концентрированную кислоту азотную - качественная реакция на корни барбариса обыкновенного (берберин) (красно-бурое окрашивание);
– раствор пероксида водорода - качественная реакция на корни барбариса обыкновенного (берберин) (фиолетовое окрашивание);
– раствор калия бихромата и концентрированную кислоту серную - качественная реакция на семена чилибухи (стрихнин) (красно-фиолетовое окрашивание);
– раствор калия бихромата и концентрированную кислоту азотную - качественная реакция на семена чилибухи (бруцин) (оранжево-красное окрашивание).
В анализе могут быть использованы:
– реактив Эрдмана - смесь концентрированных кислот серной и азотной;
– реактив Марки - раствор формалина в концентрированной кислоте серной;
– реактив Фреде - раствор аммония молибдата в концентрированной кислоте серной.
Окраска в зависимости от структуры алкалоидов различна.
Для некоторых алкалоидов существуют групповые качественные реакции, такие как мурексидная проба (на пуриновые алкалоиды), реакция Витали-Морена (на тропановые алкалоиды) и другие, которые подробно рассматриваются в курсе фармацевтической химии.
Частные реакции основаны также на специфических свойствах алкалоидов и наличии в их структуре функциональных групп. Например, реакция на алкалоиды спорыньи - алкалоиды переводят в соли кислоты винной и добавляют реактив Ван-Урка (концентрированная кислота серная + железа (III) хлорид + пара-диметиламинобензальдегид) - появляется фиолетовое окрашивание. Эту реакцию используют для подтверждения подлинности сырья, а также в методе количественного определения алкалоидов.
Таким образом, общей специфической качественной реакции на алкалоиды не существует.
Если проводят поиск алкалоидсодержащих растений, то всегда выполняют 5-10 реакций с общеалкалоидными реактивами, т.к. чувствительность реакций различна. Обычно эти реакции выполняют капельным образом на стеклянных пластинках.
Количественное определение алкалоидов проводят для всех видов сырья, кроме травы пассифлоры воплощенной (определяют экстрактивные вещества) и листьев фирмианы простой (стеркулии платанолистной) (определяют сумму азотистых оснований в пересчете на холина хлорид).
Единой методикиколичественного определения содержания алкалоидов в растительном сырье не существует, т.к. их химическая структура, физические и химические свойства различны.
Разработаны индивидуальные методики определения содержания алкалоидов или групповые методики (определение тропановых алкалоидов).
Все методики количественного определения алкалоидов в растительном сырье многоэтапные. Относительная точность их невелика, ошибка составляет 10 % и более.
В ходе анализа обычно выделяют следующие этапы (стадии):
I. Извлечение суммы алкалоидов из сырья.
Алкалоиды извлекают в виде солей или в виде оснований.
В первом случае сырье обрабатывают слабыми растворами органических или минеральных кислот, соли которых хорошо растворимы в воде или спирте. Используют винную, лимонную, уксусную, серную, соляную и другие кислоты. В извлечение попадают углеводы, белки и другие сопутствующие вещества.
Во втором случае сырье смачивают концентрированным раствором аммиака. Щелочи не используют, т.к. они образуют феноляты, вызывают гидролиз, изомеризацию алкалоидов. Раствор аммиака вытесняет алкалоиды-основания из солей. Алкалоиды-основания извлекают органическим растворителем (эфиром, хлороформом, бензолом и др.). В извлечение попадают воски, смолы, каротиноиды, фенольные соединения.
Извлечение проводят многократно новыми порциями до полного истощения сырья. Полученные порции объединяют.
II. Очистка извлечения от балластных веществ.
Обычно проводят путем дву- или трехкратной смены растворителя. Реже используют ионообменную или адсорбционную хроматографию.
III. Разделение суммы алкалоидов и выделение индивидуальных алкалоидов.
Выполняют в тех случаях, когда оценку качества сырья проводят не по всей сумме алкалоидов, а по содержанию алкалоида, определяющего основное фармакологическое действие сырья.
Разделение основано на различных физико-химических свойствах алкалоидов, извлеченных из сырья:
– на способности перегоняться с водяным паром. Например, пахикарпин из суммы алкалоидов травы софоры толстоплодной отделяют путем отгонки его с водяным паром;
– на различной растворимости алкалоидов в органических растворителях. Например, колхамин из суммы алкалоидов клубнелуковиц безвременника отделяют, используя его плохую растворимость в ацетоне;
– на различной растворимости полученных комплексов с общеалкалоидными реактивами, т.е. используют реакции осаждения. Например, скополамин из суммы алкалоидов семян дурмана индейского отделяют, осаждая его в виде солей кислоты пикриновой (пикрата);
– на различной адсорбции и десорбции хроматографируемых веществ. Например, колхамин отделяют хроматографическим разделением суммы алкалоидов клубнелуковиц безвременника, капсаициноиды плодов стручкового перца отделяют хроматографически.
IV. Собственно количественное определение проводят различными методами:
1. Гравиметрический (весовой) метод. Алкалоиды переводят в весовую форму, осадок отделяют, высушивают, взвешивают. Этим методом определяют алкалоиды листьев барбариса обыкновенного, травы гармалы обыкновенной, травы баранца обыкновенного, клубнелуковиц безвременника, семян и плодов дурмана индейского;
2. Титриметрические методы:
a) ацидиметрическое прямое или обратное титрование (алкалоиды листьев белены, листьев дурмана обыкновенного, листьев и травы красавки, травы термопсиса ланцетного, травы эфедры хвощевой, побегов анабазиса, семян чилибухи);
б) титрование в неводных средах:
– точку эквивалентности определяют, используя индикатор (алкалоиды травы барвинка малого);
– потенциометрическое титрование (алкалоиды травы чистотела);
3. Физико-химические (инструментальные) методы:
a) фотоэлектроколориметрический метод (алкалоиды листьев катарантуса розового, листьев унгернии Виктора, травы крестовника плосколистного, травы мачка желтого, травы софоры толстоплодной, травы паслена дольчатого, клубней с корнями стефании гладкой, склероциев спорыньи);
б) спектрофотометрический метод (алкалоиды корней барбариса обыкновенного, листьев унгернии Северцова, травы маклейи, травы термопсиса очередноцветкового, плодов стручкового перца);
в) полярографический метод (алкалоиды семян термопсиса ланцетного, корневищ кубышки желтой).
Так, например, количественное определение алкалоидов группы тропана в листьях красавки, белены, дурмана Государственная Фармакопея XI (вып. 2, ст. 13, 17, 24) предлагает проводить ацидиметрическим методом (вариант обратного титрования). При этом предварительно алкалоиды переводят в форму оснований, извлекают их из сырья эфиром, проводят очистку методом двукратной смены растворителей, удаляют экстрагент и растворяют сухой остаток суммы оснований алкалоидов в кислоте хлористоводородной, избыток которой титруют натрия гидроксидом.
Подобное определение рекомендовано и для травы термопсиса ланцетного (ГФ ХI, вып. 2, ст. 59).
Оценку количественного содержания алкалоидов в семенах чилибухи (ГФ Х, ст. 606) проводят ацидиметрическим методом (прямое титрование). При этом предварительно алкалоиды переводят в форму оснований, извлекают их из сырья хлороформом, проводят очистку путем двукратной смены растворителя, удаляют экстрагент, растворяют сухой остаток суммы оснований алкалоидов в этаноле и титруют кислотой хлористоводородной.
Количественное определение алкалоидов в сырье спорыньи проводят фотоэлектроколориметрическим методом (ГФ Х, ст. 599). Метод основан на измерении степени поглощения немонохроматического света устойчивым окрашенным комплексом алкалоидов спорыньи с реактивом Ван-Урка с помощью фотоэлектроколориметра при зеленом светофильтре. При этом склероции спорыньи обезжиривают петролейным эфиром, сумму алкалоидов-оснований извлекают из сырья эфиром, очищают алкалоиды путем смены растворителя (переводят сумму алкалоидов в соли кислоты винной, удаляют эфир), проводят реакцию образования комплекса алкалоидов-солей с реактивом Ван-Урка и определяют оптическую плотность окрашенного раствора.
На кофеин
Получение кофеина
(обнаружение кофеина в листьях чая)
Порядок выполнения
В фарфоровую чашку помещают 0,5 – 1 г сухой чайной заварки, накрывают воронкой с заткнутым ватой отверстием и нагревают на асбестовой сетке в течение 10 минут. На внутренней поверхности воронки начинают конденсироваться сначала капельки воды, а затем – тонкие кристаллы кофеина. По окончании возгонки нагревание прекращают. Чашку охлаждают на воздухе и счищают кристаллики кофеина с поверхности воронки.
Наблюдения
Как выглядит чистый алкалоид кофеин?
Порядок выполнения
Полученные кристаллы растворяют в 1 мл воды. Каплю полученного раствора наносят на предметное стекло, добавляют 1 каплю 30% водного раствора перекиси водорода H2O2 и 1 каплю 10% соляной кислоты HCl. Смесь осторожно выпаривают. Затем стекло охлаждают и наносят на него 1 каплю концентрированного раствора аммиака NH3. Затем стекло вновь нагревают до полного испарения воды.
Наблюдения
Какую окраску приобретает пятно?
Выводы: (содержат ответы на следующие вопросы)
1. Можно ли считать данную реакцию качественной на кофеин?
2. Где больше кофеина: в кофе или чае?
3. Какие гетероциклы составляет основу молекулы кофеина? Как называют ансамбль этих двух циклов?
4. Какое действие на организм человека оказывает кофеин? Является ли это свойство общим для алкалоидов группы 2,6-диоксипурина (ксантинов)?
Порядок выполнения
В пробирку помещают 1 каплю 1% раствора кофеина (или хинина), добавляют 5 капель воды и перемешивают. На предметное стекло наносят 2 капли полученного раствора на некотором расстоянии друг от друга.
К первой капле добавляют на некотором расстоянии сбоку 1 каплю раствора I2 в KI. Ко второй капле аналогичным образом добавляют 1 каплю 0,5% раствора танина. Осторожно палочкой совместите каплю раствора кофеина с каплей каждого из реактивов.
Наблюдения:
Что наблюдается на месте соприкосновения капель? Какой цвет и агрегатное состояние имеет образующееся вещество?
Выводы: (содержат ответы на следующие вопросы)
1. Что такое хинин и кофеин? Для каких целей их используют?
2. Какие гетероциклы составляет основу молекул хинина и кофеина?
3. Какой вкус имеет хинин? С какой целью таблетки хинина покрывают оболочкой?
4. Лекарственным средством против какого заболевания является хинин?
Контрольные вопросы:
1. Что вкладывается в понятие «вкус»?
2. Перечислите основные виды вкуса.
3. Каков механизм восприятия вкуса?
4. Какие ощущения, близки к основным вкусовым?
5. Перечислите химические вещества, являющиеся носителями сладкого вкуса.
6. С каким веществом связан соленый вкус?
7. Что вкладывается в понятие «кислый вкус»?
8. Какие химические вещества вызывают горький вкус?
9. С каким классом химических веществ связан вкус умами?
10.Каков принцип определения "вкусового дальтонизма"?
11.Как определяется порог вкусовой чувствительности к сладкому? Какова Ваша вкусовая чувствительность к сладкому?
12.Как определяется порог вкусовой чувствительности к соленому? Какова Ваша вкусовая чувствительность к соленому?
13.Как определяется порог вкусовой чувствительности к кислому? Какова Ваша вкусовая чувствительность к кислому?
14.Как определяется порог вкусовой чувствительности к горькому? Какова Ваша вкусовая чувствительность к горькому?
Химия цвета
Лабораторная работа № 6
Подготовка к исследованию
При проверке на цветовой дальтонизм готовят основные растворы красящих веществ, путем дальнейшего разбавления которых готовят пробы с низкой концентрацией для определения способности испытуемых определять цвета.
Основные растворы готовят следующим образом:
– зеленого цвета - 2 % раствор яркого зеленого;
– красного цвета - 2 % раствор азорубина;
– желтого цвета - 2 % раствор хризолина-3.
Из основных растворов готовят рабочие растворы для проведения пробы на дальтонизм. Рабочие растворы для каждого цвета готовят десяти концентраций, таким образом, чтобы цвет равномерно изменялся от едва заметного до яркого. Растворы разливают в 30 кодированных пробирок и расставляют их в штативы в случайном порядке.
Проведение исследования
Испытуемому предлагают правильно разделить растворы по цвету и расставить в ряд в порядке возрастания интенсивности окраски.
Внимание! При органолептической оценке цвета следует учитывать явление цветового контраста, которое заключается в том, что любой цвет на фоне более темных тонов светлеет, на фоне более светлых - темнеет. Особенно важно, чтобы при проведении исследования фон был одинаковым.
Обработка результатов
Положительным считается результат, если из десяти растворов каждого цвета правильно расположено не менее восьми.
Версия работы
Проверку цветового зрения можно проводить с помощью полихроматических таблиц.
Выводы. По результатам определения способности идентифицировать основные цвета и отмечать разницу в цвете подводится итог индивидуальной способности испытуемого правильно распознавать цвета.
Лабораторная работа № 7
Метод определения количественного содержания антоцианов Антоциан в переводе с греческого означает «синий цветок» и в соответствии с международной цифровой системой кодификации пищевых добавок имеет код Е163. Название частично себя оправдывает, ведь антоцианы – это пигменты растений. Зачастую именно они определяют цвет лепестков цветов, осенних листьев и плодов. Правда, придают они не только синюю окраску, но также пурпурную, фиолетовую, темно-лиловую, и даже розовую, красную и оранжевую.Сама окраска зависит от pH клеточного содержимого: окраска большинства антоцианов ярко-красная, при увеличении рН она постепенно переходит в темно-синюю, зеленую и затем желтую. Это связано с изменением структуры входящего в состав пигмента агликона. Таким образом объясняется и смена окраски при созревании плодов и отцветании цветков: данные процессы сопровождаются закислением клеточного содержимого, в результате чего и меняется цвет.Благодаря своему углеродному каркасу С6С3С6 антоцианы относятся к флавоноидам – важной подгруппе фенольных соединений органических веществ. В основе структуры антоцианов лежит 2-фенилбензопириллиевая соль флавилия. Пигмент растений существует в виде гликозидов полигидрокси- и /или полиметоксипроизводных этой соли.Антоцианты являются антиоксидантами, которые содержатся в ягодах: смородине, винограде, малине, ежевике, вишне. В последнее время по всему миру появилось множество исследований по изучению действия антоциантов. Американские исследователи определили, что употребление в пищу антоциантов сокращает риск поражения раком пищевода и прямой кишки, способствуют снижению воспалительных процессов в организме.Эти пигменты растений благоприятно воздействуют на сосуды сетчатки и улучшают состояние сосудистой ткани. Эти свойства антоциантов особенно привлекли офтальмологов, тем более что эти вещества в составе ягод предотвращают повреждение тканей глаза. Так, например, употребление антоцианта черники благотворно влияет на капилляры, уменьшает их хрупкость и повышает эластичность. Помимо этого, согласно исследованиям японских ученых, экстракты черники способны снимать раздражение глаз и усталость, и даже улучшать зрение в сумерках.Американские исследователи установили, что антоцианы, которыми богаты плоды черники, в силу своей уникальной способности подавляют активность свободных радикалов, препятствуют их воздействию на биологические мембраны и таким замедляют процесс старения.Сегодня антоцианы используются в пищевой промышленности, в частности в производстве кондитерских изделий, напитков, йогуртов: Экстракты растений с высоким содержанием антоцианов также активно используют в производстве БАД (биологически активных добавок к пище) и СПП (специализированных пищевых продуктов).Однако необходимо помнить и знать, что только антоцианы черники обладают и оказывают наиболее эффективное воздействие на сетчатку глаз. Поэтому идентификация и контроль антоцианов при производстве БАД под Собственной Торговой Маркой является не прихотью, а обязательной процедурой контрактного производства.Для определения антоцианов существуют стандартные методики, которые позволяют контролировать подлинность и качество как сырья, так и готовой продукции. Эти методики описаны в Руководстве Р 4.1.1672-03 (Руководстве по методам контроля качества и безопасности биологически активных добавок к пище) и ГФ ХI (Государственная ФАРМАКОПЕЯ, одиннадцатое издание, выпуск 2).Наиболее современным и эффективным методом для идентификации, очистки и выделения органических соединений является метод высокоэффективной жидкостной хромотографии - ВЭЖХ. Хроматография – наиболее современный метод, который определяет содержание компонентов в смеси. Этот метод заключается в разделении составляющих компонентов на хроматографической колонке и дальнейшей регистрацией хроматограмм при помощи специального детектора. В соответствии по времени удерживания и спектрам поглощения. производится идентификация исследуемых компонентовОбразцы БАД с антоциан-содержащими компонентами (экстракты черники, красного винограда) экстрагируют дистиллированной водой. Пробы фильтруют через мембранный фильтр с диаметром пор 0,2 мкм. Разделение проводят на хроматографической колонке. Детектирование фотометрическое при длине волны 520 нм.Идентификацию пиков проводят путем сравнения с хроматограммами ягод с известным составом антоциановых пигментов и с литературными данными. Относительное содержание индивидуальных пигментов определяют как отношение площади хроматографического пика и суммы площадей пиков всех идентифицированных антоцианов.
Ход работы.
Опыт 1.
Зависимость окраски от рН среды.
Проэкстрагировать антоцианы из растительного сырья с помощью горячей воды, раствора кислоты и раствора щелочи.
Определить рН среды.
Записать цвет полученного раствора.
Опыт 2.
Изменение окраски продукта в зависимости от рН среды
В 10 пробирок отмерить по 2-3 мл окрашенного сока.
Добавить по несколько мл раствора щелочи до изменения окраски от светло вишневой в первой пробирке ( без добавления раствора щелочи) до желтой ( с максимальным количеством щелочи). Записать объем щелочи и цвет полученного раствора.
Наиболее устойчивую красную окраску антоцианы имеют в кислой среде при рН 1,5-2; при рН 3,4-5 окраска становится красно-пурпурной или пурпурной. В щелочной среде происходит изменение окраски, при рН 6,7-8 она становится синей, сине-зеленой, а при рН 9 - зеленой, которая при повышении рН до 10 меняется на желтую окраску.
Лабораторная работа № 8
И плодовых растений
Цель занятия: ознакомиться с характеристикой группы каротиноидных пигментов. Освоить методики определения витаминов в сырье и пищевых продуктах.
Порядок выполнения работы
Метод основан на разделении каротиноидов на хроматографической бумаге, выделении полоски бумаги с каротином, растворении его и колориметрировании.
Ход анализа.
Отвешивают 5+0,01г размельченных корнеплодов (листьев или других частей растений) в чашки, затем растирают в ступке с ацетоном (или спиртом) в присутствии 5 г стеклянного песка и щепотки соды (анализ рекомендуется проводить в токе СО2 или азота). Растертую с ацетоном массу перемещают в цилиндр на 100 см3, смывают ступку порциями ацетона и доводят объем до 50 или 100 см3. Затем 1 см3 или другое количество этого экстракта наносят в виде полоски на нижний конец хроматографической бумаги на высоте 4 см от края.
Нанесенный на бумагу раствор подсушивают в токе теплого воздуха (феном), избегая света, и после этого бумагу сворачивают в однослойную трубку, а верхний конец скрепляют скрепкой из пластмассы и ставят на дно цилиндрического сосуда, в котором находится слой петролейного эфира в 2-3 см.
Через 20–30 минут хроматограмму вынимают и вырезают полоску бумаги, окрашенную в желтый цвет (каротин идет следом за фронтом подъема растворителя). Полоску бумаги с каротином мелко нарезают в бюкс и извлекают пигмент небольшими порциями (по 1см3) петролейного эфира со следами спирта или ацетона. Для более полного извлечения нарезанные полоски бумаги несколько раз промывают растворителем до полного обесцвечивания. Затем этот раствор доводят до определенного объема и колориметрируют; количество каротина вычисляют как обычно.
В объектах, содержащих ликопин, широкая, окрашенная в розовый цвет полоса ликопина следует на хроматограмме за желтой полоской каротина. Полоску бумаги с каротином отрезают и поступают так, как было сказано выше. Размытая полоса ликопина не всегда позволяет получить концентрированный раствор ликопина.
В дальнейшем, при определении ликопина, поступают так, как описано при определении каротина. При этом в качестве стандартного раствора при колориметрировании используют первый раствор, 1 см3 которого по окраске соответствует 0,078 мг ликопина.
Определение ксантофиллов
В объектах, содержащих ксантофилл-капсантин (стручковый перец), определение каротина проводят как обычно. Капсантин отделяют от других ксантофиллов при повторном хроматографировании в смеси бензола и петролейного эфира (в соотношении 3:1 или 4:1). Верхняя полоса на хроматограмме принадлежит капсантину.
Вычисление результатов производят по следующей формуле:
Х = 0,00235*V1*V3*В*100
н*V1*В1
где В – показание колориметра стандартного раствора (обычно10);
В1 – показание колориметра для исследуемого раствора;
V1 – объем полученной ацетоновой вытяжки;
V2 – объем ацетоновой вытяжки, взятой для определения каротина;
V3 – объем готового петролейного раствора каротина;
н – навеска материала (в г).
Реактивы и аппаратура
1)петролейный эфир (t кип. 60-800); 2) ацетон «ч» или спирт этиловый;
3) сода;
4) хроматографическая бумага или хроматографические пластины;
5) стандартный раствор –145 мг азобензола в 100 мл этилового спирта (такой раствор по окраске соответствует 0,0078 мг ликопина в 1 мл; при разбавлении первого раствора в 10 раз получают второй раствор, который содержит 14,5 мг азобензола в 100 мл спирта; 1 мл второго раствора соответствует 0,00235 мг каротина, 0,00252 мг ксантофилла, 0,00256 мг лютеина и 0,00260 мг виолаксантина);
6) спектрофотометр UNICO;
7) хроматографический комплекс «Сорбфил»
Пример вычисления содержания каротина (в корнеплодах моркови).
Навеска (5 г) проэкстрагирована ацетоном и доведена до объема 80 см3 (V1), из этого объема взят 1 см3 (V2) , и нанесен на хроматографическую бумагу. После разделения пигментов в петролейном эфире объем раствора каротина составил 5 см3 (V3). Этот раствор служит для колориметрирования. Стандартный раствор (в1) установлен на высоте 10 см, при этом опытный раствор (в2) установился на высоте 20,1. Подставив эти значения в формулу, вычисляют содержание каротина:
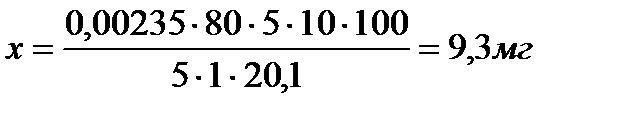 на 100 г.
на 100 г.
Задание:
1. Изучить основные теоретические положения по теме занятия.
2. Определить содержание каротиноидов и др. пигментов в исследуемых образцах продукции выданных преподавателем.
3. Оформить результаты исследований
4. Отчет по работе сдать преподавателю
Контрольные вопросы:
1. Что такое пигменты?
2. Классификация пигментов по химическому составу?
3. Классификация пигментов пластид?
4. Какие пигменты относятся к группе каротиноидов? Их характеристика, особенности строения?
5. Особенность строения, физико-химические свойства α-, β-, γ- каротинов?
6. Особенность строения, физико-химические свойства ликопина и лютеина?
7. Особенность строения, физико-химические свойства зеаксантина и виолаксантина?
8. Распространение каротиноидов в растениях?
9. Методика определения каротиноидов?
Химия запаха
Обоняние - способность определять запах веществ, рассеянных в воздухе (или растворенных в воде - для животных, живущих в ней).
Обоняние одно из самых древних и важнейших чувств, при помощи которого животные ориентируются в окружающей их среде. Ставка на обоняние была стратегической в эволюции млекопитающих, однако у приматов и в особенности у человекообразных обезьян обоняние всегда было третьестепенным чувством, после зрения, слуха и даже осязания. Человек имеет один из самых худших органов нюха среди всех млекопитающих, почти все они чувствуют запах лучше и острее человека. Для сравнения - площадь обонятельной области в носу собак составляет 150 см2, что в 15 раз больше, чем у человека.
Процесс обоняния довольно сложен. У человека в верхней части носа находится обонятельный эпителий площадью около 10см2, состоящий из миллионов особых «пушистых» клеток приблизительно с 12 ресничками на каждой. С помощью дыхания и специальных желез поддерживается постоянный, высокий уровень влажности в этой области. Проникающие в нос молекулы запаха растворяются во влажной среде. Реснички, при увеличении концентрации молекул запаха в полученном растворе, срабатыват и передают нервные импульсы по обонятельным нервам в обонятельные луковицы, а затем в подкорковые центры (миндалину и др.) и, наконец, в корковый центр обоняния мозга. Обонятельный эпителий, нервы и центры обоняния мозга объединяют в обонятельный анализатор.
Каждая клетка обонятельного эпителия носа активизируется, если на нее (в раствор) попадает хотя бы 8 молекул пахучего вещества. Сигнал же в мозг подается, если активизировались около 40 клеток. Таким образом, достаточно 320 молекул остро пахнущего вещества, чтобы мы почувствовали его запах. Чтобы запах распространился вокруг пахучего вещества, молекулы должны распространиться вокруг него. К факторам, ускоряющим перенос молекул запаха, относятся температура и вода. Известно, что горячие блюда пахнут сильнее холодных - пары испаряющейся воды переносят молекулы запаха очень хорошо. В воде запахи распространяются лучше, чем в воздухе. Неслучайно морские обитатели, особенно акулы и хищные рыбы, чувствуют добычу за много километров, что в воздушной среде было бы невозможно. По этой же причине во время сильного дождя мы можем чувствовать множество окружающих запахов острее, чем в сухую погоду - капельки воды действуют как проводники запаха.
В природе существует около 110000 различных запахов, из которых среднестатистический взрослый человек может распознать 100-200. Дети ощущают в несколько раз больше запахов. По другим данным обычный человек без труда может различать до 1000 запахов, а опытный специалист - до 10 000.
В зависимости от концентрации одно и то же вещество, может эмоционально восприниматься как приятное, нейтральное или неприятное.
Сильно различающееся по химическому составу вещество могут пахнуть почти одинаково и, наоборот, близкие по химическому составу пахнуть совершенно по-разному.
При одновременном действии нескольких запахов общая оценка аромата может существенно измениться.
Если человек заходит в помещение, где присутствует сильный запах, первые несколько минут он будет очень сильно его ощущать, однако, со временем чувствительные клетки в носу адаптируются, и перестают посылать сигналы в мозг, чтобы не перегружать его.
Когда человек простужен, его способность определять запах еды резко снижается. При этом снижается проходимость носа, а чувствительность к вкусу остается той же, что помогает ощущать запах «по памяти», ощущая только вкус. Если вы попробуете кушать, закрыв глаза и нос, будет очень трудно определить, например, картошку вы едите или печеное яблоко - их можно будет распознать только по консистенции.
Как правило, у женщин обоняние тоньше, чем у мужчин и позже, чем них начинает снижаться его острота.
Левая ноздря чувствует запахи лучше, чем правая.
У новорожденных младенцев обоняние развито сильно, но за один год жизни оно теряется на 40-50 %. С возрастом уменьшается чувствительность обоняния и способность к различению запахов.
Расстройства обоняния. Существует большая группа нарушений работы обонятельного анализатора, а также индивидуальная сниженная чувствительность к запахам, иногда доходящая до аносмии.
Аносмия - потеря обоняния. Обычно подразумевается полная потеря обоняния, но чаще встречается частичная аносмия, на некоторые вещества. Аносмия может быть врождённой и приобретенной. Приобретенная аносмия может быть вызвана поражением нервных путей (после вирусных заболеваний), некоторыми поражениями головного мозга, а также нарушением проходимости воздуха при рините и других заболеваниях.
Гипосмия - (снижение обоняния) встречаются у человека при болезненных изменениях слизистой оболочки носа, насморке, иногда при мозговых заболеваниях.
Теории обоняния
Атомарная (корпускулярная) теория римского поэта и философа Лукреция Кара.
Атомарная теория Дайсона или гипотеза обусловленности запаха инфракрасным резонансом колебания молекул (1938 год);
Предположение Лайнуса Полинга о взаимосвязи спецефичности запаха с размером и формой молекул химических веществ (1946 год).
Стерическая теория Монкриффа, который заявил, что запах ощущается, если переносимые воздухом молекулы комплементарно «встраиваются» в некие участки рецепторов обонятельной нервной системы (1949 год).
Химическая теория Цваадемакера: одоривектор (молекулы пахучего вещества) растворяется в секрете бауменовских желез и вступает в контакт с волосками обонятельных клеток и вызывает их возбуждение.
Физическая теория Генингса: одоривекторы излучают волны высокой частоты, которые передаются на обонятельный анализатор и различные группы клеток резонируют в ответ на колебания, характерные определенному одоривектору.
Электрохимичекая теория Мюллера: возбуждение органа обоняния происходит благодаря электрохимической энергии пахучего вещества.
Стереохимическая гипотеза обоняния Эймура: обоняние зависит от взаимодействия молекул пахучего вещества с мембранной обонятельной клетки, которое определяется как формой молекул, так и наличием в ней определенных функциональных групп. Молекулы пахучего вещества попадают в определенную рецепторную «лунку» на мембране обонятельной клетки. Было предположено, что молекулы, приводящие к восприятию камфроподобного запаха, имеют форму шара, с цветочным – диска с ручкой (1964 год).
Колебательная спектроскопическая теория туннелирования электронов, или волновая теория Лука Тьюрина: аромат определяется не формой молекул, а частотой колебаний межатомных связей в молекулах, на которые реагирует нос (1990 год).
Источники запаха и аромата
Ощущение запаха воспринимается посредством органов обоняния и возбуждается определенными летучими веществами:
– ароматическими углеводородами,
– эфирными маслами,
– альдегидами,
– высшими спиртами,
– сложными эфирами, кетонами,
– некоторыми кислотами и др.
Запах образуется в результате сложного сочетания перечисленных химических веществ.
Запах зависит от структуры молекул (величины, формы, числа функциональных групп, наличия двойных связей и т. д.). Однако известны соединения, имеющие сходное строение, но различающиеся по запаху и, наоборот, имеющие разное строение, но обладающие аналогичным запахом.
Некоторые вещества изменяют запах в зависимости от их количественного содержания. Поэтому знание химического строения еще недостаточно для предсказания запаха.
Комплекс пахучих веществ запаха пищевых продуктов состоит из большого числа компонентов, принадлежащих различным классам веществ. Всего в пищевых продуктах идентифицировано свыше 2000 компонентов.
Названия запаховых ощущений всегда конкретны и всегда соответствуют веществам, вызывающим их. Запахи бесконечно разнообразны.
Наряду с понятием запаха специалисты используют еще термин «аромат». Если под запахом понимают любые ощущения, воспринимаемые органом обоняния, то определение «аромат» дается исключительно привлекательному запаху, вызывающему приятное ощущение.
В образовании аромата принимают участие ароматические вещества. Как правило, аромат лабилен, легко испаряется, а поэтому любую органолептическую оценку следует начинать с определения аромата.
По интенсивности различают яркий, сильный, умеренный и слабый аромат.
Классификации запахов
– Крокер-Хендерсон выделяет четыре основных запаха: ароматный, кислый, горелый и каприловый (или козлиный).
– Шведский ботаник К. Линней выделяет семь основных запахов: ароматический (красная гвоздика), бальзамический (лилия), амброзиальный (мускус), луковый (чеснок), псиный (валериана), отталкивающий (некоторые насекомые), тошнотворный (падаль).
– Хеннинг Х. выделяет шесть основных запахов: фруктовый, цветочный, смолистый, пряный, гнилостный, горелый.
– Цваардемакера Г. (1857-1930 гг.) выделяет девять основных классов запахов (табл.18).
Таблица 18 - Перечень химических веществ и (или) продуктов, обуславливающих определенные запахи
| Группы запахов | Химические вещества и (или) продукты, обуславливающие запах |
| эфирный | ацетон, фруктовые, винные запахи |
| ароматические | гвоздика, пряности, камфора |
| бальзамические | ваниль, цветочные запахи |
| амбромускусные | мускус, сандаловое дерево |
| чесночные | сероводород, чеснок, хлор |
| пригорелые | бензол, жаренный кофе, креозот |
| каприловые или псинные | сыр, протухший жир |
| противные | запах клопов, беладонны |
| тошнотворные | скатол, фекалии, трупный запах |
Запахи делятся на два основных класса: приятные и неприятные. В основе классификации лежат обонятельные ощущения человека.
1. Приятные запахи чаще ассоциируются с запахом цветов, фруктов и трав. Вещества, отвечающие за приятные запахи, сосредоточены во фракции «эфирных масел», выделяемых растением. Эфирные масла получают либо при перегонке с водяным паром, либо экстракцией органическим растворителем.
Эфирные масла – многокомпонентные смеси летучих органических соединений, главным образом терпенов и терпеноидов, вырабатываемые растениями и обуславливающие их запах.
Соединения, относящиеся к классу терпенов и терпеноидов, составляют основу многих эфирных масел. У большинства из них имеется до 10 углеродных атомов и один или несколько фрагментов изопрена с общей формулой (С5Н8)n. Они обладают умеренной летучестью и большим разнообразием оттенков запаха. К этим классам соединений относятся мирцен С10Н16О – алифатический терпен эфирного масла хмеля, гераниол С10Н18О – алифатический терпеноид гераниевого масла.
Терпены могут иметь циклическую структуру, причем среди них бывают моно- и бициклические соединения. Простейшие соединения – это моноциклические терпены. В структуре терпеноидов наряду с повторяющимися фрагментами изопрена всегда присутствует функциональная группа –ОН (спиртовая), –НС=О (альдегидная), С=О (кетонная) и т.п.
Многие моноциклические терпены могут существовать в виде двух оптических зеркальных изомеров (D- и L-). Каждый изомер обладает только ему присущим запахом и свойствами. Органы чувств по-разному воспринимают разные оптические изомеры. Например, (–) ментол, выделяемый из масла мяты перечной, применяют в пищевой промышленности для придания холодящего вкуса. (+) Ментол для этих целей не используется. Среди бициклических терпенов следует отметить камфору. Один из изомеров (+) камфора – известное лекарственное вещество, стимулирующее дыхание и кровообращение, обладающее антисептическим действием, а (–) камфора
Физиологическое действие эфирных масел. Эфирные масла были популярны на Востоке, где искусство составления благовоний и их употребления стало составной частью воспитания. Продолжением этого в наши дни стала наука «аромотерапия» о применении душистых веществ в медицинских целях. Правильно подобранные запахи способны регулировать и восстанавливать многие функции организма. Запахи розы, розмарина, лаванды, лимона усиливают внимание и повышают точность выполнения монотонной работы. Запах мирта, мяты оказывает тонизирующее действие на нервную систему, а аромат жасмина и лаванды – успокаивающее.
Ароматизаторы
Качество пищевых продуктов в значительной степени определяет их запах, или другими словами аромат.
Аромат пищевых продуктов – интегральный фактор, обусловленный присутствием в нем сложных органических соединений, имеющихся в сырье и образующийся под влиянием ряда факторов в ходе технологической обработки продуктов.
Вкус и аромат готового продукта определяется совокупностью большого числа соединений и оценивается с помощью сенсорного анализа.
Очень многие простые по строению ароматобразующие вещества обнаружены практически во всех пищевых продуктах. К ним относятся простые спирты (от С2 до С6), уксусный альдегид, гексаналь, ацетон, этилацетат, уксусная кислота. Во многих пищевых продуктах установлено присутствие всего ряда насыщенных кислот от (С2 до С18) с четным числом углеродных атомов. По мере созревания растения идет формирование веществ аромата, которые образуются как продукты микробиологических ферментативных процессов. Аналогично, основные компоненты аромата хлеба формируются в процессе приготовления теста и в результате термических реакций на стадии выпечки.
Наиболее интенсивный аромат в плодовых соках образуется в результате ферментативных реакций непосредственно после разрушения плода и вытекания сока. Далее развиваются процессы, ухудшающие его аромат. Например, наиболее сильный клубничный аромат образуется через 2 минуты после прессования клубники, а через 10 минут начинается его ухудшение.
В образовании веществ, обусловливающих аромат и вкус обработанного мяса, принимают участие основные его компоненты – белки, жиры, углеводы, витамины, а также продукты их деструкции, возникающие в мясе в результате различных ферментативных процессов.
Выделяют пять основных процессов химических превращений: распад аминокислот, сахаров; сахароаминные реакции; окисление; гидролиз липидов; термическая дегидратация витаминов и других компонентов исходного сырья.
В настоящее время в различных пищевых продуктах идентифицировано около 600 соединений, которые, как полагают, и определяют их аромат. Для улучшения или придания аромата пище человек издавна использовал пряности. К пряным растениям относятся деревья семейства лавровых, мускатниковых и др.
Пряности – высушенные части пряных растений, которые используют в качестве приправ к пище. Они улучшают ее вкусовые качества, переваривание и усвоение. В качестве пряностей используют различные части растения: семена (мускатного ореха), плоды (ваниль, анис, перец), цветки или их части (каперсы, гвоздика), листья (лавровый лист), кору (корица), корневища (имбирь). Пряности широко применяют в кулинарии.
Дополнительно такие пряности, как бадьян, мускатный орех, имбирь, кардамон, улучшают кровообращение в периферических сосудах, в том числе в сосудах головного мозга.
Натуральные ароматизаторы
Натуральными считают ароматизаторы, которые имеют в своем составе только натуральные компоненты, т.е. химические соединения или их смеси, выделенные из натурального сырья. Источниками их получения являются: эфирные масла и настои трав, натуральные плодоовощные соки, пряности и продукты их переработки.
Ряд веществ аромата (чаще сложные эфиры) получают синтетически в лаборатории и по мере надобности используют для улучшения запаха продуктов питания. Так, некоторые формиаты напоминают запах слив, ацетаты – груш, бутираты и изобутираты имеют ананасовый аромат, а валераты и изовалераты по запаху напоминают яблоки.
Методика определения чувствительности обоняния
Метод, с помощью которого оценивается запах, называется обонятельный и основан на восприятии запаха с помощью рецепторов обоняния.
Восприятие запахов нельзя измерить непосредственно. Вместо этого используют непрямые методы:
- оценка интенсивности (как сильно ощущается запах?), -определение порога восприятия (то есть, при какой силе запах
начинает ощущаться), - сравнение с другими запахами (на что похож данный запах?).
Обычно наблюдается прямая зависимость между порогом восприятия и чувствительностью.
При оценке качества пищевых продуктов обычно различают семь основных групп запахов, сочетание которых порождает все существующие оттенки: камфорный, мускусный, цветочный, мятный, эфирный, острый и гнилостный.
В таблице 19 представлен перечень химических веществ, обуславливающих указанные группы запахов.
Таблица 19 - Перечень химических веществ, обуславливающих определенные запахи.
| Группы запахов | Химическое вещество, обуславливающее запах |
| камфорный | гексахролэтан |
| мускусный | мускус |
| цветочный | альфаамилпиридин |
| мятный | ментол |
| эфирный | диэтиловый эфир |
| острый | муравьиная кислота |
| гнилостный | сероводород |
Лабораторная работа № 9
Задание
Тренировка сенсорной памяти проводится на отварах специй. Студентам предлагают опробовать запах 10 известных насыщенных отваров специй и дают команду на запоминание. После небольшого перерыва (около 3 минут) испытуемым предлагают серию разбавленных в 5-10 раз таких же отваров специй в различной последовательности. Группа разделяется на 2 подгруппы и для каждой подгруппы выдается свое задание. Отвары налиты в колбы с номерами и закрыты пробками. Студентам необходимо опробовать ароматы специй и распознать их. Результаты исследований заносят в табл. 20.
Таблица 20 – Результаты исследований сенсорной памяти
| № колбы* | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
| Обнаруженные запахи | |||||||||||
| Соответствие заданию |
*) 1 - лук; 2 - чеснок; 3 - перец черный горошком; 4 - перец душистый; 5- тмин; 6 - мускатный орех; 7 - кардамон; 8 – кориандр; 9 - гвоздика; 10 - лавровый лист.
Объем памяти увеличивается с опытом, в случае несоответствия более 50% ответов, испытуемому необходимо серьезно заняться тренировкой памяти.
Для студентов справившихся с заданием можно предложить оценить ароматы специй в их смесях. С этой целью приготавливаются смеси уже известных специй в соотношении 1:1. Смеси отваров специй представлены в табл. 21.
Таблица 21 – Смеси отваров специй
| № пробирки | 14 | 50 | 53 | 70 | 69 | 33 | 67 | 45 | 23 | 24 |
| Комбинация |
Оборудование и материалы
Колбы конические стеклянные вместимостью 150-200 см3 с пробками, из них: 20 шт. пронумерованы, 10 шт. с надписями названий специй;
Отвары специй: перца черного горошка, перца душистого, кориандра, тмина, кардамона, мускатного ореха, гвоздики, лука, чеснока, лаврового листа;
Пробирки из бесцветного стекла с пробками пронумерованные, для смесей специй − 10 шт.
Лабораторная работа № 10
Задание
Каждому студенту выдается задание, номер которого указан на стакане. В стакане находится 6 пробирок с 10 см3 запахового вещества (уксусной кислоты, этилового спирта, мятного масла), причем два вещества могут повторяться, а в одной пробирке находится дистиллированная вода. Опробование проводят в той последовательности, в которой образцы представлены и не возвращаются к ранее опробованным пробам. Для восстановления обонятельной чувствительности анализаторов дегустатора необходимо после каждого опробования запаха делать перерывы не менее 30 сек.
Каждое задание имеет свою последовательность растворов (пример представлен в табл. 4). Студентам необходимо распознать данные вещества.
Результаты эксперимента заносят в табл. 22
В заключении отмечают, обнаружена или не обнаружена обонятельная аносмия, если обнаружена, то к какому запаху?
Таблица 22 – Пример последовательности растворов
| № задания | Номер пробирки* | |||||
| 1 | 2 | 3 | 4 | 5 | 6 | |
| 1 | А | Б | В | Б | Д | А |
| 2 | Б | В | А | Д | В | Б |
| 3 | Б | А | Д | В | Б | А |
| 4 | А | В | Б | Д | А | Б |
| 5 | В | А | Б | В | Д | Б |
| 6 | Д | А | Б | В | В | Б |
| 7 | Б | Б | Д | А | А | Б |
| 8 | В | Б | В | Д | Б | А |
| 9 | Б | Д | А | А | Б | В |
| 10 | А | Б | Б | В | А | Д |
*А – раствор уксусной кислоты; Б – раствор мятного масла; В – раствор этилового спирта; Д – дистиллированная вода.
Таблица 5 – Протокол проверки дегустатора на обонятельную аносмию
Протокол
Проверки дегустатора на обонятельную аносмию
Ф.И.О.__________________________________________________
Курс______________группа________________
Номер задания___________
| № пробирки | 1 | 2 | 3 | 4 | 5 | 6 |
| Обнаруженный запах | ||||||
| Соответствие заданию |
Заключение______________________________________________________
________________________________________________________________
Дата_______________ Подпись__________________
Оборудование и материалы
Стаканы лабораторные с номерами вместимостью 200 см3 по количеству студентов в группе;
Пробирки из бесцветного стекла с притертыми пробками, пронумерованные (1, 2, 3, 4, 5, 6) и содержащие растворы ароматических веществ (не менее 10 см3);
Уксусная кислота (раствор концентрации 1,0%) - 200 см3; Мятное масло (раствор концентрации 0,01 г/дм3) - 200 см3; Этиловый спирт (раствор концентрации 5,0%) - 200 см3; Дистиллированная вода - 200 см3.
Список литературы
1. Бурова, Т.Е. Химия вкуса, цвета и аромата [Электронный ресурс] : учебно-методическое пособие. – Электрон. дан. – Спб. : НИУ ИТМО (Санкт-Петербургский национальный исследовательский университет информационных технологий, механики и оптики), 2014. – 29 с. – Режим доступа: http://e.lanbook.com/books/element.php?pl1_id=71175 – Загл. с экрана
2. Нечаев, А.П. Пищевая химия [Электронный ресурс] : учебник / А.П. Нечаев, С.Е. Траубенберг, А.А. Кочеткова [и др.]. – Электрон. дан. – СПб. : ГИОРД, 2015. – 670 с. – Режим доступа: http://e.lanbook.com/books/element.php?pl1_id=69876 – Загл. с экрана
3. Бурова, Т.Е. Влияние обработки на состав и свойства растительного сырья [Электронный ресурс] : учебно-методическое пособие. – Электрон. дан. – Спб. : НИУ ИТМО (Санкт-Петербургский национальный исследовательский университет информационных технологий, механики и оптики), 2014. – 83 с. – Режим доступа: http://e.lanbook.com/books/element.php?pl1_id=70833 – Загл. с экрана.
4. Романюк, Т.И. Методы исследования сырья и продуктов растительного происхождения (теория и практика) [Электронный ресурс] : учебное пособие / Т.И. Романюк, А.Е. Чусова, И.В. Новикова. – Электрон. дан. – Воронеж : ВГУИТ (Воронежский государственный университет инженерных технологий), 2014. – 161 с. – Режим доступа: http://e.lanbook.com/books/element.php?pl1_id=71662 – Загл. с экрана.
5. Базарнова, Ю.Г. Теоретические основы методов исследования пищевых продуктов [Электронный ресурс] : учебное пособие. – Электрон. дан. – Спб. : НИУ ИТМО (Санкт-Петербургский национальный исследовательский университет информационных технологий, механики и оптики), 2014. – 134 с. – Режим доступа: http://e.lanbook.com/books/element.php?pl1_id=71109 – Загл. с экрана.
6. Методические указания к лабораторно-практической работе «Количественное определение каротиноидных пигментов овощных и плодовых растений» /Родионова Л.Я., Соболь И.В., Ивершин Д.А. // Краснодар. КубГАУ, 2006.
7. Методические указания к лабораторно-практической работе «Проведение сенсорного анализа» /Родионова Л.Я., Соболь И.В., Ковалева С.Е. - // Краснодар. КубГАУ, 2009
8. Методические указания к лабораторно-практическим работам по дисциплине «Химия цвета, вкуса и аромата» / Щербакова Е.В. // Краснодар. КубГАУ, 2014
Е. В. Щербакова Е. А. Ольховатов
ПРАКТИКУМ ПО ХИМИИ ВКУСА,
ЦВЕТА И АРОМАТА
Учебное пособие
2017
УДК 665.3 (076.5)
ББК 35.782
Щ61
Рецензент:
В. Д. Надыкта – доктор технических наук, профессор ВАК, заведующий кафедрой технологии хранения и переработки растениеводческой продукции Кубанского государственного аграрного университета им. И.Т. Трубилина, академик РАН
Щербакова Е.В., Ольховатов Е.А. Практикум по химии вкуса, цвета и аромата : учебное пособие.
Учебное пособие предназначено для формирования у обучающихся комплекса знаний о химизме и условиях образования основных соединений, обуславливающих вкус, цвет и аромат при производстве пищевых продуктов из растительного сырья и их влияние на органолептические и физико-химические показатели качества и изменения, происходящие в процессе хранения готовой продукции. Изложен теоретический материал и методики выполнения практических работ, включенных в рабочую программу по дисциплине «Химия вкуса, цвета и аромата». Приведенный материал предназначен для проведения практических занятий, а также может быть использован обучающимися для самостоятельной работы.
Издание предназначено для обучающихся по направлению подготовки магистратуры 19.04.02 «Продукты питания из растительного сырья», а также бакалавриата, аспирантуры, специалистов пищевых отраслей и широкого круга читателей.
УДК 665.3 (076.5)
ББК 35.782
Оглавление
| Введение……………………………………………………………. 1 Кратко о природе сенсорных систем……………………………. Контрольные вопросы……………………………………………... 2 Порядок исследований по проверке сенсорных способностей………………………………………… Контрольные вопросы……………………………………………... 3 Химия вкуса………………………………………………………. 3.1 Основные теоретические положения……………………….. 3.2 Методы проверки вкусовой чувствительности……………. Лабораторная работа № 1. Проверка на "вкусовой дальтонизм"………………………............................................ Лабораторная работа № 2. Проверка порога вкусовой чувствительности………………………………….. 2.1 Определение порога вкусовой чувствительности к сладкому………………………………………………... 2.2 Определение порога вкусовой чувствительности к солёному………………………………………………... 2.3 Определение порога вкусовой чувствительности к кислому………………………………………………... 2.4 Определение порога вкусовой чувствительности к горькому……………………………………………….. Лабораторная работа № 3. Проверка порога вкусовой разницы и интенсивности вкуса………………….. Лабораторная работа № 4. Изучение свойств пищевых кислот………………………………………………. 4.1 Кислотные свойства карбоновых кислот……………….. 4.2 Определение активной кислотности различных пищевых продуктов и растворов кислот различной концентрации………………………… Лабораторная работа № 5. Изучение свойств алкалоидов…...……………………………………………….. 5.1 Качественные реакции…………………………………… 5.2 Получение кофеина и качественная реакция на кофеин…………………………………………………. 5.3 Реакции с кофеином (хинином)…………………………. Контрольные вопросы……………………………………….. 4 Химия цвета………………………………………………………. 4.1 Основные теоретические положения………………........ Контрольные вопросы……………………………………….. Лабораторная работа № 6. Определение способности идентифицировать основные цвета и отмечать разницу в цвете с помощью растворов индикаторов………………... Лабораторная работа № 7. Метод определения количественного содержания антоцианов………………….. Лабораторная работа № 8. Особенности каротиноидов овощных и плодовых растений……………………………… Контрольные вопросы……………………………………….. 5 Химия аромата…………………………………………………… 5.1 Основные теоретические положения………………………. Лабораторная работа № 9. Тренировка сенсорной памяти дегустаторов……………………………. Лабораторная работа № 10. Проверка дегустаторов на обонятельную аносмию…………………………………... Контрольные вопросы……………………………………….. Словарь основных понятий и терминов………………………….. Список литературы………………………………………………… | 22 |
ВВЕДЕНИЕ
Целью освоения дисциплины «Химия, вкуса, цвета и аромата» является формирование комплекса знаний об организационных, научных и методических основах химизма и условий образования основных соединений, обуславливающих формирование вкуса, цвета и аромата при производстве пищевых продуктов из растительного сырья и их влияние на органолептические и физико-химические показатели качества готовой продукции, их изменений в процессе хранения.
Задачи
– сформировать практические основы определения основных органолептических показателей качества пищевых продуктов – вкуса, цвета и аромата;
– сформировать практические основы определения причин и условий образования нежелательного и постороннего вкуса, цвета и аромата пищевых продуктов
Учебное пособие предназначено для проведения практических занятий и организации самостоятельной работы обучающихся в целях освоения ими профессиональных компетенций по дисциплине «Химия, вкуса, цвета и аромата» для направления подготовки магистратуры 19.04.02 «Продукты питания из растительного сырья», а также бакалавриата, аспирантуры, специалистов пищевых отраслей и широкого круга читателей.
Техника безопасности при работе в химической лаборатории
При работе в химической лаборатории необходимо соблюдать правила техники безопасности и противопожарные мероприятия.
Все работающие в лаборатории должны пройти инструктаж по технике безопасности, что фиксируется в специальном журнале. Для работы в лаборатории необходим халат, который надевается перед началом работы и застегивается на все пуговицы.
При выполнении анализов нужно соблюдать осторожность, быть внимательным, все операции проводить аккуратно, без спешки. Особое внимание следует обращать на чистоту рук. Если на них попадают реактивы или другие загрязнения, то руки необходимо сразу мыть. В лаборатории должны быть два полотенца: для рук и для посуды, которые должны существенно отличаться цветом или фактурой материала. Категорически запрещается принимать пищу из лабораторной посуды или за лабораторными столами.
Стеклянные приборы: колбы, стаканы, пробирки изготовлены в основном из тонкостенного стекла, поэтому обращаться с ними нужно аккуратно - их следует осторожно переставлять с места на место, нельзя сжимать пальцами, при мытье не нажимать сильно на дно и стенки моющими приспособлениями. В случае пореза стеклом из ранки извлекают осколки стекла, смазывают йодом или другим заменяющим его средством, забинтовывают или заклеивают лейкопластырем.
При пользовании реактивами требуется выполнять особые правила. Нельзя использовать реактивы, на склянках с которыми отсутствует надпись с наименованием. Твердые реактивы для взвешивания или других целей берут специальным шпателем или ложечкой, избегая попадания реактива на руки. Категорически запрещается пробовать реактивы на вкус. Нюхать химические реактивы нужно очень осторожно, не наклоняясь над ними и не вдыхая полной грудью.
С легковоспламеняющимися и выделяющими летучие, ядовитые и другие фракции веществами можно работать только в вытяжном шкафу при опущенной дверце. Хранить их нужно также в вытяжном шкафу.
Для нагревания следует использовать только термостойкую стеклянную или фарфоровую посуду. Нельзя наклоняться над кипящей жидкостью при выпаривании или кипении различных растворов. Нагревать можно только открытые (сообщающиеся с атмосферой или вакуумом) сосуды. Запрещается герметично закрывать сосуд с горячей жидкостью, так как в результате конденсации паров образуется вакуум, и сосуд легко может быть раздавлен атмосферным воздухом.
Все электрические приборы должны быть заземлены.
Дата: 2019-02-19, просмотров: 786.