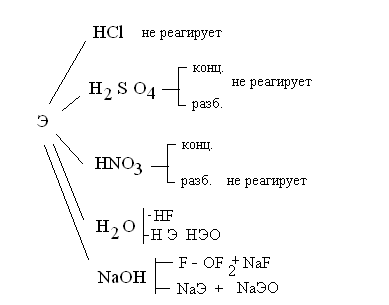
А. Трансформация комплекса с образованием более устойчивого комплекса в результате:
- более прочного связывания лигандов с новым комплексообразователем, т. е. реакции обмена комплексообразователя:
[Сu(NН3)4]S04 + 2Н2SО4 СиSО4 + 2[NН4]2SО4
([Сu(NН3)4]2+ 4Н+ Сu2+ + [NН4]+)
- более прочного связывания комплексообразователя с новым лигандом, т. е. реакции обмена лигандами во внутренней сфере:
[Pt(NH3)4Cl2] + 4КСN К2[Рt(СN)4] + 4NН3 + 2КСl
([Pt(NH3)4Cl2]+ 4СN- [Рt(СN)4]2-+ 4NH3)
Замена лигандов во внутренней сфере комплексного соединения протекает ступенчато, причем при наличии различных лигандов вначале замещается тот лиганд, связь которого с комплексообразователем лабильна:
[Рt(NН3)2С12] + КI [Рt(NН3)2ClI] + КС1
([Рt(NН3)2С12] + I- [Рt(NН3)2СlI] + Сl-)
Б. Разрушение гидроксокомплексов в кислой среде из-за образования малодиссоциированного соединения
Nа2[Zn(ОН)4] + 4НС1 2NaCl + ZnCl2 + 4Н2O
([Zn(ОН)4]- + 4Н+ Zn2+ + 4Н20)
В. Разрушение комплексного соединения с образованием малорастворимого соединения, в котором комплексообразователь или лиганд связан прочнее, чем в комплексе:
[Ag(NH3)2]Cl + KI AgI + 2КСl + 2NН3
([Ag(NH3)2]+ + I- AgI + 2NH3)
Г. Разрушение или трансформация комплексного соединения в результате окислительно-восстановительных превращений:
- лиганда:
K2[CdI4] + Cl2 2КСl + СdС12 + 2I2
([CdI4]2- + Cl2 Сd2+ + 2I2 + 4Сl-)
- комплексообразователя:
2К4[Fе(СN)6] + С12 2К3[Fе(СN)6] + 2КС1
(2[Fе (СN)6]4- + С12 2[Fе(СN)6] + 2Сl- )
Вопрос 42
ГАЛОГЕНЫ
Как видно из этих данных, в ряду F — С1 — Вг — I — At радиус атомов увеличивается, а энергия ионизации уменьшается. Это свидетельствует об ослаблении признаков неметаллического элемента: фтор — наиболее ярко выраженный элемент-неметалл, а астат проявляет уже некоторые признаки элемента-металла.
Способы получен ия галогенов
Промышленные способы получения галогенов.
Фтор получают электролизом расплавов KF·HF(t =250оС).
Хлор получают электролизом водных растворов хлоридов щелочных металлов.
Бром и иод получают окислением растворов бромидов и иодидов природной воды хлором
2NaГ + Cl2 = 2NaCl+ Г2 , где Г – Вг, I
Лабораторные способы получения галогенов:
С12 , Вг2 , I2 – окислением различными, сильными окислителями конц. соляной кислоты, бромидов, иодидов
2KMnO4 + 16HCl ® 2KCl + 2MnCl2 + 5Cl2 + 8H2O
2KI + 2H2SO4 + MnO2 ® I2 + MnSO4 + K2SO4 + 2H2O
2NaBr + Cl2 ® 2NaCl + Br2
Химические свойства.
Окислительная способность повышается в ряду Аt2—F2.
Отсюда следует, что более сильный окислитель вытесняет более слабый из галогенидов.
2NaBr + Cl2 ® 2NaCl + Br2
F2. — один из сильнейших окислителей, с большинством простых веществ реагирует бурно уже при обычной температуре, с некоторыми из них (S, Р) — даже при температуре жидкого воздуха (—190°С); окисляет инертные газы (Кг, Хе, Rn) и такие стойкие соединения, как Н20 и SiO2.
Вг2, I2 , Аt2 окисляются при действии сильных окислителей, Cl2 — только при взаимодействии со F2.
Способность окисляться т.е. повышается в ряду Вг2, I2 , Аt2.
Правило: нижестоящий в ПС галоген вытесняет вышестоящий из солей с галогенами в положительной степени окисления
2NaClО + Br2 ® 2NaBrО + Cl2
Для С12, Вг2, I2 характерны реакции диспропорционирования; способность к диспропорционированию в ряду Cl2, Br2 ,I2 уменьшается.
NaOH + Cl2 = NaOCl + NaCl + H 2O
Реакции галогенов с простыми веществами

Реакции с галогенов с важнейшими реагентами
Примеры : Cl2 + H2O ® HCl + HClO
2Cl2 + 2Ca(OH)2 ® CaCl2 + Ca(ClO)2 + 2H2O
2F2 + 2H2O ® 4HF + O2
Сверху вниз окислительная способность галогенов растет, поэтому каждый вышестоящий галоген вытесняет нижестоящий из галогенидов, т.е.
Na Br + Cl 2® NaCl + Br 2
Наоборот каждый нижестоящий вытесняет вышестоящий из кислородосодержащих солей
NaClО + Br 2® NaBrО + Cl2
Вопрос 43
Галогеноводоро́ды — общее название соединений, образованных из водорода и галогенов (элементов подгруппы фтора):
· Плавиковая кислота — водный раствор фтороводорода
· Соляная кислота — водный раствор хлороводорода
· Бромоводородная кислота — водный раствор бромоводорода
· Иодоводородная кислота — водный раствор иодоводорода
· Астатоводородная кислота — водный раствор астатоводорода
Все галогеноводороды — бесцветные ядовитые газы с резким запахом, хорошо растворимые в воде. На воздухе их концентрированные растворы дымят вследствие выделения галогеноводородов.
Способы получения
Вытеснение из солей сильными кислотами:
2NaCl+H2SO4=2HCl+Na2SO4
{\displaystyle {\mathsf {NaCl+H_{2}SO_{4}\rightarrow HCl+NaHSO_{4}}}}Хлор, бром, иод непосредственно взаимодействуют с водородом, образуя галогеноводороды:
{\displaystyle {\mathsf {H_{2}+Cl_{2}\rightarrow 2HCl}}}H2+Cl2=2HCl
H2+Br2=2HBr
H2+I2=2HIhHH
{\displaystyle {\mathsf {H_{2}+Br_{2}\rightarrow 2HBr}}}{\displaystyle {\mathsf {H_{2}+I_{2}\rightarrow 2HI}}}Хлор реагирует с водородом бурно, со взрывом, но реакцию необходимо инициировать (путём нагревания или освещения), что связано с её цепным механизмом. Кислотные свойства HI выражены гораздо сильнее, чем HF, поскольку связь H-I слабая, водород легко отщепляется от атома йода. От HF водород уходит с неохотой, поскольку связь H-F короткая и крепкая. Окислительные свойства от HF до HI уменьшаются, а восстановительные - возрастают. Сверху вниз кислотные свойства увеличиваются, а основные уменьшаются.
Галогениды — группа минералов, представляющих собой соединения галогенов с другими химическими элементами или радикалами. К галогенидным минералам относятся фтористые, хлористые и очень редкие бромистые и иодистые соединения. Фтористые соединения (фториды), генетически связаны с магматической деятельностью, они являются возгонами вулканов или продуктами гидротермальных процессов, иногда имеют осадочное происхождение. Некоторые галогенные соединения образуются в зоне окисления сульфидных (медных, свинцовых и других) месторождений.
Типичные минералы класса фторидов — виллиомит NaF, флюорит CaF2, криолит Na3AlF6; класса хлоридов — галит NaCl, сильвин КCl, карналлит KMgCl3·6(H2O). Сырьё в пищевой, химической, металлургической промышленности
Галогениды щелочных металлов представляют собой соединения ионного типа. За исключением галогенидов цезия, они кристаллизуются в решетку со структурой каменной соли. Галогениды многих металлов обнаруживают частично ионный и частично ковалентный характер. Ковалентный характер галогенидов возрастает не только в пределах каждого периода, но и при перемещении к нижней части группы галогенов
Пример гидролиза
MgI2+H2O=MgOHI+HI
Mg2+ + H2O=Mg(OH)+ + H+
MgOHI+H2O=Mg(OH)2+HI
Mg(OH)+ + H2O=Mg(OH)2 + H+
Практика
11) Н2S (г) + Cl2(г) ↔2НСl(г) + S (т)
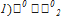 /
/ 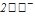 =+1,36
=+1,36
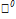
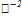 /
/ 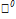 =0,14
=0,14
Таким образом Cl2 – более сильный окислитель, значит, реакция пойдет в прямом направлении.
1) K= 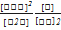
17) 5K2 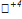 O3 + 2K
O3 + 2K 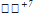 O4 + 3H2SO4 → 6K2
O4 + 3H2SO4 → 6K2 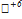 O4 + 2
O4 + 2 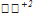 SO4 + 3H2O
SO4 + 3H2O
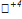 -2
-2  5 окисление
5 окисление
 +5
+5 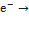
 2 восстановление
2 восстановление
K2SO3 - восстановитель
KMnO 4- окислитель
12) N(HCl)= 2 моль
m(HCl)= 2*(1+35.5)= 73 г
73 ----- 38%
х -------- 100%
х= 100*73/38= 192,1 г р-ра
V=m/плотность
V= 192.1/1.19= 161.43 мл
11)Дано: V=2дм3, n(A)=4,5 моль n(В)=3 моль, n(С)=2 моль, t=20 сек
Определить:v
Решение:
A+B=2C
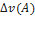 =
= 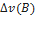 =-
=-  v(B)
v(B)
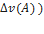 =
= 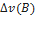 =-
=-  *2=-1 моль
*2=-1 моль
Средняя скорость реакции по веществу А
V= 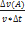
V= 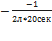 =-0,025
=-0,025 
Дата: 2019-02-19, просмотров: 340.