Моляльность —число молей растворённого вещества в 1000 г растворителя. Измеряется в
молях на кг, также распространено выражение в «моляльности». Так, раствор с концентрацией 0,5 моль/кг называют 0,5-моляльным.
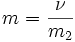 ,
,
где:
ν — количество растворённого вещества, моль;
m2 — масса растворителя, кг.
Следует обратить особое внимание, что несмотря на сходство названий,
молярная концентрация и моляльность -величины различные. Прежде всего, в отличие от молярной концентрации,
при выражении концентрации в моляльности расчёт ведут на массу
растворителя, а не на объём раствора. Моляльность, вотличие от молярной
концентрации, не зависит от температуры.
Массовая доля -безразмерная физическая величина, равная отношению массы компонентов
смеси к массе смеси. Выражается в долях единицы, процентах (%), промилле (‰), миллионных долях.
ω (x) = m(x) / (m(x) + m(s)) = m(x) / m
где ω(х) — массовая доля растворенного вещества Х
m(x) — масса растворенного вещества Х, г;
m(s) — масса растворителя S, г;
m = m(x) + m(s) — масса раствора, г.
Массовую долю выражают в долях единицы или в процентах (например — ω = 0,05 или 5%)
Нормальность раствора (нормальная концентрация, молярная концентрация эквивалента) с(Х) – это отношение количества вещества эквивалента, содержащегося в растворе, к объему этого раствора [моль / м3]. С= n / V
Вопрос 31
Электролитическая диссоциация — процесс распада электролита на ионы при его растворении или плавлении.
ТЭД
- Электролиты при их растворении в воде или в расплавленном состоянии распадаются (диссоциируют) на ионы: положительные катионы и отрицательные – анионы. Ион – это атом или группа атомов, имеющие заряды.
- Ионы отличаются от атомов по строению и по свойствам
- В растворе и расплаве электролита движение ионов хаотическое, при пропускании постоянного тока через раствор или расплав электролита положительно заряженные ионы движутся к катоду (–), отрицательные ионы к аноду (+).
- Процесс электролитической диссоциации – процесс обратимый. Прямая реакция разложения гидроксида аммония называется диссоциацией, обратная – моляризацией, ассоциацией ионов.
МЕХАНИЗМ ДИССОЦИАЦИИ
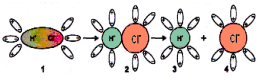
Схема электролитической диссоциации полярной молекулы в водном растворе
1. полярная молекула в начале гидратации,
2. переход полярной структуры в ионную под действием диполей воды (процесс ионизации),
3. гидратированный катион,
4. гидратированный анион.
Растворы сильных электролитов
Сильные электролиты в растворах полностью распадаются на ионы, т.е. 100%. Их истинная степень диссоциации не зависит от концентрации. В растворах слабых электролитов концентрация ионов мала, расстояния между ними большие, то в растворах сильных электролитов расстояния малы и сильны электростатические взаимодействия между ионами. В таких растворах ионы не свободны, а окружены оболочкой из противоположных ионов. В электрическом поле ион и его окружение будут стремиться к разным полюсам, ионы будут тормозиться, что определиться как падение диссоциации.
а = сf, где a – активность, f- коэффициент активности.
Величина f рассматривается как кажущаяся степень диссоциации сильных электролитов.
Вопрос 32
Дата: 2019-02-19, просмотров: 348.