Равновесие в растворах слабых электролитов. Если процесс диссоциации представить в виде обратимой реакции
КА  К+ + А- ,
К+ + А- ,
то скорости прямой и обратной реакции будут равны, можно записать выражение константы равновесия данного процесса.
Кр = 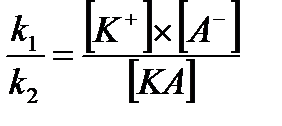 ,
,
Величина Кр в этом случае называется константой диссоциации. Чем больше Кдис., тем меньше недиссоциированных молекул в растворе, тем сильнее электролит. Константа диссоциации является более точной характеристикой слабых электролитов, чем степень диссоциации. Для диссоциации слабого бинарного электролита КА можно записать
К р = 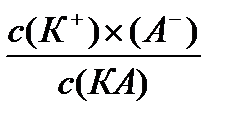
Константа связана со степенью диссоциации слабого электролита следующей формулой: К = 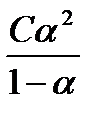 ,
,
если ά ≤ 1, то ά = 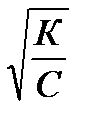
Это математическое выражение закона разбавления Оствальда: с уменьшением концентрации раствора степень диссоциации слабого электролита увеличивается.
Вопрос 33
H2O ↔ H+ + OH-Методом электрической проводимости ученые вычислили константу диссоциации воды:
Kд = ([H+]·[HO-])/[H2O] = 1,8·10-16 моль/л Kд·[H2O] = [H+]·[HO-]- Kд - константа диссоциации воды;
- [H+], [HO-] - молярные концентрации ионов;
- [H2O] - молярная концентрация воды.
Произведение [H+]·[HO-] называют ионным произведением воды Kв. В чистой воде концентрации катионов водорода и гидроксид-ионов равны, поэтому при температуре 22°C будет справедливо следующее равенство:
[H+] = [HO-] = √10-14 = 10-7В кислых растворах концентрация [H+] больше 10-7, в щелочных меньше 10-7, в нейтральных равна 10-7. Соответственно, концентрация [HO-] в кислых растворах меньше 10-7, в щелочных больше 10-7, в нейтральных также равна 10-7.
Для количественной характеристики кислотности раствора "придумали" водородный показатель pH - отрицательный десятичный логарифм концентрации катионов водорода:
pH = -lg[H+]Ионное произведение воды
Процесс электролитической диссоциации воды протекает в две стадии:
1. образование водородных ионов и гидроксид–ионов:
Н2О <=> Н+ + ОН-
2. гидратация водородного иона с образованием гидроксония–иона:
Н+ + Н2О <=> Н3О+.
Первая стадия этого процесса протекает с поглощением тепла, вторая – с выделением его значительного количества. Поэтому практически все ионы водорода гидратированны и диссоциация воды должна изображаться следующим уравнением:
2Н2О <=> Н3О+ + ОН-.
Вода – очень слабый электролит, и для описания процесса ее диссоциации применим закон действующих масс:
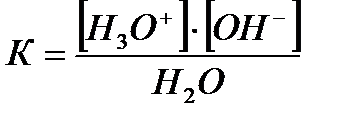
где К - константа диссоциации воды.
[Н3О+]·[ОН-] = К·[Н2О]2
Так как [Н2О] = const, то получим:
[Н3О+][ОН-] = Кw.
Постоянная Кw называется ионным произведением воды.
Величина Кw возрастает с повышением температуры, так как при этом увеличивается степень электролитической диссоциации.
Водородный показатель рН
Вода принадлежит к типичным амфотерным соединениям, совмещающим кислотные и основные свойства, выраженные в одинаковой степени. Если концентрация ионов гидроксония больше концентрации гидроксид–ионов, то есть [Н3О+] > [ОН-], то реакция среды становится кислой. Кислотность тем выше, чем больше концентрация ионов гидроксония. Если наоборот, концентрация ионов гидроксония меньше концентрации гидроксид–ионов, то есть [Н3О+] < [ОН-], то реакция среды становится щелочной. Кислотность или основность раствора можно выразить, взяв вместо концентрации ионов водорода ее десятичный логарифм. Чтобы избавиться от отрицательной степени в значении концентрации ионов водорода, предложено пользоваться отрицательным значением логарифма величины [Н+], названным водородным показателем или рН:
рН = -lg[Н+];
Соотношения между реакцией среды, концентрациями ионов и значением водородного показателя получаются следующие:
Нейтральная среда [Н3О+] = [ОН-] = 10-7 моль/л, рН = 7.
Кислотная среда [Н3О+] > [ОН-] > 10-7 моль/л, рН < 7.
Щелочная среда [Н3О+] < [ОН-] < 10-7 моль/л, рН > 7.
Индикатор в химии — вещество, дающее характерные (обычно цветные) химические реакции и употребляющиеся при анализе веществ.
Широко используются кислотно-основные индикаторы, разбавленные растворы которых обладают способностью заметно изменять цвет, в зависимости от кислотности раствора. Причина изменения цвета — изменения в строении молекул индикатора в кислой и щелочной среде, что приводит к изменению спектра поглощения раствора.
Фенолфталеин: бесцветный (кислая среда), малиновый (щелочная) рН=8-10
Лакмус: красный (кисл.), синий (щелочная) рН=5-8
Метиловый оранжевый: красный (кисл.), жёлтый (щелочная) рН=3-4
Для определения состава газовых сред используют индикаторные бумажки и индикаторные трубки.
Вопрос 34
Ионные обменные реакции идут до конца в том случае, если в результате реакции образуется:
-нерастворимое соединение, выпадающее в осадок;
-газообразное вещество;
-слабый электролит (вода, слабое основание или слабая кислота).
Уравнения реакций такого типа более правильно писать не в молекулярной, а в ионно-молекулярной форме.
Произведение растворимости
В насыщенном растворе сульфата бария, находящегося в контакте с кристаллами этого вещества, устанавливается динамическое равновесие: BaSO4(т)⇄ Ba2+(р)+ 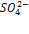 (р).
(р).
Для этого равновесного процесса можно написать выражение константы равновесия, учитывая, что концентрация твердой фазы не входит в выражение константы равновесия: Kp = [Ba2+] [ 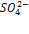 ].
].
Эта величина называется произведением растворимости малорастворимого вещества (ПР). Таким образом, в насыщенном растворе малорастворимого соединения произведение концентраций его ионов в степени стехиометрических коэффициентов равно величине произведения растворимости. В рассмотренном примере ПР(BaSO4) = [Ba2+] [ 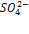 ].
].
Чем меньше произведение растворимости, тем хуже растворимо соединение. Зная произведение растворимости, можно определить растворимость малорастворимого электролита и содержание его в определенном объеме насыщенного раствора.
1) Условие выпадения осадка:
Если произведение концентраций ионов, возведенных в степени их стехиометрических коэффициентов, превышает произведение растворимости, то происходит образование твердой фазы (осадка)
2) Условие растворения осадка:
Если произведение концентраций ионов, возведенных в степени стехиометрических коэффициентов, не превышает произведение растворимости, то осадок не образуется, а при наличии в системе твердой фазы (осадка) происходит ее растворение
Следует отметить, что для растворения осадка достаточно уменьшить концентрацию одного из ионов. Этого можно достичь, например, добавляя реагент, связывающий ион малорастворимого электролита в растворимое малодиссоциирующее соединение или газообразное вещество.
Вопрос 35
Гидролиз солей
В общем случае, гидролиз солей – это процесс обменного разложения воды и растворенной в ней соли – электролита, приводящий к образованию малодиссоциирующего вещества.
Гидролиз протекает тем полнее, сильнее поляризующее действие ионов. Возможны 4 случая протекания гидролиза:
1) Соли, образованные сильным основанием и сильной кислотой не подвергаются гидролизу. В этом случае, гидролиз практически не происходит, т.к. катионы и анионы, образующиеся в растворе при диссоциации соли, слабо поляризуют гидратную оболочку. pH среды не изменяется (рН ≈ 7):
NaCl ↔ Na+ + Cl—
Na+ + HOH ↔ реакция практически не протекает
Cl— + HOH ↔ реакция практически не протекает
Дата: 2019-02-19, просмотров: 328.