Вопрос 30
Молярность (молярная объёмная концентрация)
Молярная концентрация- число молей растворённого вещества в единице объёма раствора. Молярная концентрация в системе СИ измеряется в моль/м3, однако на практике её гораздо чаще выражают в моль/л или ммоль/л. Также распространено выражение в «молярности». Возможно другое обозначение молярной концентрации - С(х), которое принято обозначать М. Так, раствор с концентрацией 0,5 моль/л называют 0,5-молярным.
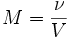 ,
,
где:
ν — количество растворённого вещества, моль;
V — общий объём раствора, л.
Молярность (молярная весовая концентрация)
Моляльность —число молей растворённого вещества в 1000 г растворителя. Измеряется в
молях на кг, также распространено выражение в «моляльности». Так, раствор с концентрацией 0,5 моль/кг называют 0,5-моляльным.
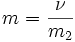 ,
,
где:
ν — количество растворённого вещества, моль;
m2 — масса растворителя, кг.
Следует обратить особое внимание, что несмотря на сходство названий,
молярная концентрация и моляльность -величины различные. Прежде всего, в отличие от молярной концентрации,
при выражении концентрации в моляльности расчёт ведут на массу
растворителя, а не на объём раствора. Моляльность, вотличие от молярной
концентрации, не зависит от температуры.
Массовая доля -безразмерная физическая величина, равная отношению массы компонентов
смеси к массе смеси. Выражается в долях единицы, процентах (%), промилле (‰), миллионных долях.
ω (x) = m(x) / (m(x) + m(s)) = m(x) / m
где ω(х) — массовая доля растворенного вещества Х
m(x) — масса растворенного вещества Х, г;
m(s) — масса растворителя S, г;
m = m(x) + m(s) — масса раствора, г.
Массовую долю выражают в долях единицы или в процентах (например — ω = 0,05 или 5%)
Нормальность раствора (нормальная концентрация, молярная концентрация эквивалента) с(Х) – это отношение количества вещества эквивалента, содержащегося в растворе, к объему этого раствора [моль / м3]. С= n / V
Вопрос 31
Электролитическая диссоциация — процесс распада электролита на ионы при его растворении или плавлении.
ТЭД
- Электролиты при их растворении в воде или в расплавленном состоянии распадаются (диссоциируют) на ионы: положительные катионы и отрицательные – анионы. Ион – это атом или группа атомов, имеющие заряды.
- Ионы отличаются от атомов по строению и по свойствам
- В растворе и расплаве электролита движение ионов хаотическое, при пропускании постоянного тока через раствор или расплав электролита положительно заряженные ионы движутся к катоду (–), отрицательные ионы к аноду (+).
- Процесс электролитической диссоциации – процесс обратимый. Прямая реакция разложения гидроксида аммония называется диссоциацией, обратная – моляризацией, ассоциацией ионов.
МЕХАНИЗМ ДИССОЦИАЦИИ
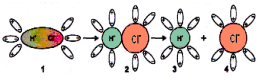
Схема электролитической диссоциации полярной молекулы в водном растворе
1. полярная молекула в начале гидратации,
2. переход полярной структуры в ионную под действием диполей воды (процесс ионизации),
3. гидратированный катион,
4. гидратированный анион.
Растворы сильных электролитов
Сильные электролиты в растворах полностью распадаются на ионы, т.е. 100%. Их истинная степень диссоциации не зависит от концентрации. В растворах слабых электролитов концентрация ионов мала, расстояния между ними большие, то в растворах сильных электролитов расстояния малы и сильны электростатические взаимодействия между ионами. В таких растворах ионы не свободны, а окружены оболочкой из противоположных ионов. В электрическом поле ион и его окружение будут стремиться к разным полюсам, ионы будут тормозиться, что определиться как падение диссоциации.
а = сf, где a – активность, f- коэффициент активности.
Величина f рассматривается как кажущаяся степень диссоциации сильных электролитов.
Вопрос 32
Вопрос 33
H2O ↔ H+ + OH-Методом электрической проводимости ученые вычислили константу диссоциации воды:
Kд = ([H+]·[HO-])/[H2O] = 1,8·10-16 моль/л Kд·[H2O] = [H+]·[HO-]- Kд - константа диссоциации воды;
- [H+], [HO-] - молярные концентрации ионов;
- [H2O] - молярная концентрация воды.
Произведение [H+]·[HO-] называют ионным произведением воды Kв. В чистой воде концентрации катионов водорода и гидроксид-ионов равны, поэтому при температуре 22°C будет справедливо следующее равенство:
[H+] = [HO-] = √10-14 = 10-7В кислых растворах концентрация [H+] больше 10-7, в щелочных меньше 10-7, в нейтральных равна 10-7. Соответственно, концентрация [HO-] в кислых растворах меньше 10-7, в щелочных больше 10-7, в нейтральных также равна 10-7.
Для количественной характеристики кислотности раствора "придумали" водородный показатель pH - отрицательный десятичный логарифм концентрации катионов водорода:
pH = -lg[H+]Ионное произведение воды
Процесс электролитической диссоциации воды протекает в две стадии:
1. образование водородных ионов и гидроксид–ионов:
Н2О <=> Н+ + ОН-
2. гидратация водородного иона с образованием гидроксония–иона:
Н+ + Н2О <=> Н3О+.
Первая стадия этого процесса протекает с поглощением тепла, вторая – с выделением его значительного количества. Поэтому практически все ионы водорода гидратированны и диссоциация воды должна изображаться следующим уравнением:
2Н2О <=> Н3О+ + ОН-.
Вода – очень слабый электролит, и для описания процесса ее диссоциации применим закон действующих масс:
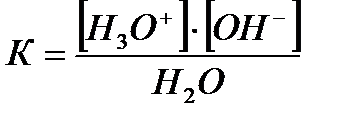
где К - константа диссоциации воды.
[Н3О+]·[ОН-] = К·[Н2О]2
Так как [Н2О] = const, то получим:
[Н3О+][ОН-] = Кw.
Постоянная Кw называется ионным произведением воды.
Величина Кw возрастает с повышением температуры, так как при этом увеличивается степень электролитической диссоциации.
Водородный показатель рН
Вода принадлежит к типичным амфотерным соединениям, совмещающим кислотные и основные свойства, выраженные в одинаковой степени. Если концентрация ионов гидроксония больше концентрации гидроксид–ионов, то есть [Н3О+] > [ОН-], то реакция среды становится кислой. Кислотность тем выше, чем больше концентрация ионов гидроксония. Если наоборот, концентрация ионов гидроксония меньше концентрации гидроксид–ионов, то есть [Н3О+] < [ОН-], то реакция среды становится щелочной. Кислотность или основность раствора можно выразить, взяв вместо концентрации ионов водорода ее десятичный логарифм. Чтобы избавиться от отрицательной степени в значении концентрации ионов водорода, предложено пользоваться отрицательным значением логарифма величины [Н+], названным водородным показателем или рН:
рН = -lg[Н+];
Соотношения между реакцией среды, концентрациями ионов и значением водородного показателя получаются следующие:
Нейтральная среда [Н3О+] = [ОН-] = 10-7 моль/л, рН = 7.
Кислотная среда [Н3О+] > [ОН-] > 10-7 моль/л, рН < 7.
Щелочная среда [Н3О+] < [ОН-] < 10-7 моль/л, рН > 7.
Индикатор в химии — вещество, дающее характерные (обычно цветные) химические реакции и употребляющиеся при анализе веществ.
Широко используются кислотно-основные индикаторы, разбавленные растворы которых обладают способностью заметно изменять цвет, в зависимости от кислотности раствора. Причина изменения цвета — изменения в строении молекул индикатора в кислой и щелочной среде, что приводит к изменению спектра поглощения раствора.
Фенолфталеин: бесцветный (кислая среда), малиновый (щелочная) рН=8-10
Лакмус: красный (кисл.), синий (щелочная) рН=5-8
Метиловый оранжевый: красный (кисл.), жёлтый (щелочная) рН=3-4
Для определения состава газовых сред используют индикаторные бумажки и индикаторные трубки.
Вопрос 34
Ионные обменные реакции идут до конца в том случае, если в результате реакции образуется:
-нерастворимое соединение, выпадающее в осадок;
-газообразное вещество;
-слабый электролит (вода, слабое основание или слабая кислота).
Уравнения реакций такого типа более правильно писать не в молекулярной, а в ионно-молекулярной форме.
Произведение растворимости
В насыщенном растворе сульфата бария, находящегося в контакте с кристаллами этого вещества, устанавливается динамическое равновесие: BaSO4(т)⇄ Ba2+(р)+ 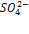 (р).
(р).
Для этого равновесного процесса можно написать выражение константы равновесия, учитывая, что концентрация твердой фазы не входит в выражение константы равновесия: Kp = [Ba2+] [ 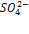 ].
].
Эта величина называется произведением растворимости малорастворимого вещества (ПР). Таким образом, в насыщенном растворе малорастворимого соединения произведение концентраций его ионов в степени стехиометрических коэффициентов равно величине произведения растворимости. В рассмотренном примере ПР(BaSO4) = [Ba2+] [ 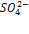 ].
].
Чем меньше произведение растворимости, тем хуже растворимо соединение. Зная произведение растворимости, можно определить растворимость малорастворимого электролита и содержание его в определенном объеме насыщенного раствора.
1) Условие выпадения осадка:
Если произведение концентраций ионов, возведенных в степени их стехиометрических коэффициентов, превышает произведение растворимости, то происходит образование твердой фазы (осадка)
2) Условие растворения осадка:
Если произведение концентраций ионов, возведенных в степени стехиометрических коэффициентов, не превышает произведение растворимости, то осадок не образуется, а при наличии в системе твердой фазы (осадка) происходит ее растворение
Следует отметить, что для растворения осадка достаточно уменьшить концентрацию одного из ионов. Этого можно достичь, например, добавляя реагент, связывающий ион малорастворимого электролита в растворимое малодиссоциирующее соединение или газообразное вещество.
Вопрос 35
Гидролиз солей
В общем случае, гидролиз солей – это процесс обменного разложения воды и растворенной в ней соли – электролита, приводящий к образованию малодиссоциирующего вещества.
Гидролиз протекает тем полнее, сильнее поляризующее действие ионов. Возможны 4 случая протекания гидролиза:
1) Соли, образованные сильным основанием и сильной кислотой не подвергаются гидролизу. В этом случае, гидролиз практически не происходит, т.к. катионы и анионы, образующиеся в растворе при диссоциации соли, слабо поляризуют гидратную оболочку. pH среды не изменяется (рН ≈ 7):
NaCl ↔ Na+ + Cl—
Na+ + HOH ↔ реакция практически не протекает
Cl— + HOH ↔ реакция практически не протекает
Вопрос 36
Окислительно-восстановительные реакции (ОВР), также редокс (сокр. англ. redox, от reduction-oxidation — восстановление-окисление) — это встречно-параллельные химические реакции, протекающие с изменением степеней окисления и не более 2 атомов, входящих в состав реагирующих веществ (или ионов веществ), реализующимся путём перераспределения электронов между атомом-окислителем (акцептором) и атомом-восстановителем (донором). В процессе окислительно-восстановительной реакции восстановитель отдаёт электроны, то есть окисляется; окислитель присоединяет электроны, то есть восстанавливается.
Восстановители: металлы, водород, уголь, окись углерода 2, сероводород, оксид серы, сернистая кислота+ее соли, галогеноводородные кислоты+их соли, катионы металлов в низших степенях окисления:
SnCl2, FeCl2, MnSO4, Cr2(SO4)3, азотистая кислота HNO2, аммиак NH3, гидразин NH2NH2, оксид азота(II) (NO)
Окислители: Галогены, Перманганат калия(KMnO4), манганат калия (K2MnO4), оксид марганца (IV) (MnO2), Дихромат калия (K2Cr2O7), хромат калия (K2CrO4), Азотная кислота (HNO3), Серная кислота (H2SO4) концентрированная, Оксид меди(II) (CuO), оксид свинца(IV) (PbO2), оксид серебра (Ag2O), пероксид водорода (H2O2), Хлорид железа(III) (FeCl3), Бертоллетова соль (KClO3)
Метод электронного баланса
1. Сначала необходимо составить схему реакции: записать вещества в начале и конце реакции, учитывая, что в кислой среде MnO4— восстанавливается до Mn2+:
Na2SO3 + KMnO4 + H2SO4 = Na2SO4 + MnSO4 + K2SO4 + H2O
2. Далее определим какие из соединений являются окислителем и восстановителем; найдем их степень окисления в начале и конце реакции:
Na2S+4O3 + KMn+7O4 + H2SO4 = Na2S+6O4 + Mn+2SO4 + K2SO4 + H2O
Из приведенной схемы понятно, что в процессе реакции происходит увеличение степени окисления серы с +4 до +6, таким образом, S+4 отдает 2 электрона и является восстановителем. Степень окисления марганца уменьшилась от +7 до +2, т.е. Mn+7 принимает 5 электронов и является окислителем.
3. Составим электронные уравнения и найдем коэффициенты при окислителе и восстановителе.
S+4 – 2e— = S+6 ¦ 5 восстановитель, процесс окисления
Mn+7 +5e— = Mn+2 ¦ 2 окислитель, процесс восстановления
Чтобы число электронов, отданных восстановителем, было равно числу электронов, принятых восстановителем, необходимо:
· Число электронов, отданных восстановителем, поставить коэффициентом перед окислителем.
· Число электронов, принятых окислителем, поставить коэффициентом перед восстановителем.
Таким образом, 5 электронов, принимаемых окислителем Mn+7, ставим коэффициентом перед восстановителем, а 2 электрона, отдаваемых восстановителем S+4 коэффициентом перед окислителем:
5Na2S+4O3 + 2KMn+7O4 + H2SO4 = 5Na2S+6O4 + 2Mn+2SO4 + K2SO4 + H2O
Вопрос 37
Направление ОВР
В основе определения направления самопроизвольного протекания окислительно-восстановительных реакций лежит следующее правило:
Окислительно-восстановительные реакции самопроизвольно протекают всегда в сторону превращения сильного окислителя в слабый сопряженный восстановитель или сильного восстановителя в слабый сопряженный окислитель. Это правило аналогично правилу, определяющему направление протекания кислотно-основных превращений. Количественной мерой окислительно-восстановительной способности данной сопряженной окислительно-восстановительной пары является величина ее восстановительного потенциала ф, которая зависит от:
- природы окисленной и восстановленной формы данной сопряженной пары;
- соотношения концентраций окисленной и восстановленной формы данной сопряженной пары;
- температуры.
В электрохимии стандартный электродный потенциал, обозначаемый Eo, E0, или Eθ, является мерой индивидуального потенциала обратимого электрода (в равновесии) в стандартном состоянии, которое осуществляется в растворах при эффективной концентрации в 1 моль/кг и в газах при давлении в 1 атмосферу или 100 кПа (килопаскалей). Объёмы чаще всего взяты при 25 °C.
Вопрос 38
Окислительно-восстановительное действие электрического тока может быть во много раз сильнее действия химических окислителей и восстановителей. При электролизе на катоде к ионам присоединяются электроны, а на аноде ионы отдают электроны. Следовательно, электрический ток при электролизе производит на катоде восстановление, а на аноде — окисление. При химических реакциях процессы окисления обязательно одновременно сопровождаются процессами восстановления. Это положение остается в силе и в случае электролиза, но здесь одновременно протекающие процессы окисления и восстановления пространственно разделены окисление происходит на аноде, а восстановление на катоде. Окислительно-восстановительное действие электрического тока используется в технике для получения некоторых очень важных химических соединений. Инертный электрод применяется, если необходимо, чтобы был установлен простой электрический контакт с раствором без возникновения дополнительных химических реакций с участием материала электрода. К наиболее употребительным инертным электродам относятся благородные металлы, обычно платина, реже серебро или золото, в ряде случаев пригодны угольный, графитовый или вольфрамовый электроды.
Типичные инертные электроды - платина и углерод; в следующем разделе мы познакомимся также с некоторыми наиболее реакционно-способными металлами, которые являются реагирующими электродами.
Активный электрод также подвергается поляризации, но в значительно меньшей степени и в обратном направлении - в том смысле, что по мере работы элемента и увеличения концентрации ионов металла переход в раствор новых ионов замедляется, и потенциал электрода становится более положительным.
Активным электродом называется электрод, состоящий из химического элемента в чистом виде, который при погружении в раствор входит в химическое равновесие с ионами того же элемента, находящимся в растворе.
Вопрос 39
Комплексное (или координационное) соединение – соединение сложного состава, в котором можно выделить центральный атом (комплексообразователь) и непосредственно связанные с ним молекулы или ионы (лиганды).Строение комплексных соединений
Основу координационной теории Вернера составляют следующие положения:
- Центральное место в комплексных соединениях занимает комплексообразователь - обычно положительно заряженный ион (чаще всего металл)
- Вокруг комплексообразователя расположены или координированы лиганды (старое название адденды), т.е. ионы противоположного знака или нейтральные молекулы.
- Комплексообразователь и лиганды образуют внутреннюю сферу комплексного соединения.
- Ионы, не вошедшие во внутреннюю сферу, составляют внешнюю сферу комплексных соединений.
- Согласно общепринятым обозначениям внутренняя сфера при написании отделяется от внешней квадратными скобками.
Так соединение [Cu(NH3)4]Cl2 может быть изображено:
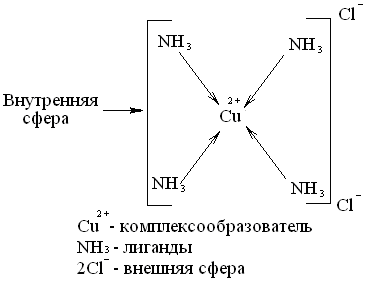
КЧ зависит от электронного строения центрального атома, от его степени окисления, размеров центрального атома и лигандов, условий образования комплексного соединения, температуры и других факторов. КЧ может принимать значения от 2 до 12. Чаще всего оно равно шести, несколько реже – четырем.
Лигандами могут быть частицы, до образования комплексного соединения представлявшие собой молекулы (H2O, CO, NH3 и др.), анионы (OH-, Cl-, PO43- и др.), а также катион водорода.
Дентантность (координационная емкость) лиганда - это число координационных мест, которое может занимать данный лиганд.
Механизм образования координационной (донорно-акцепторной) связи
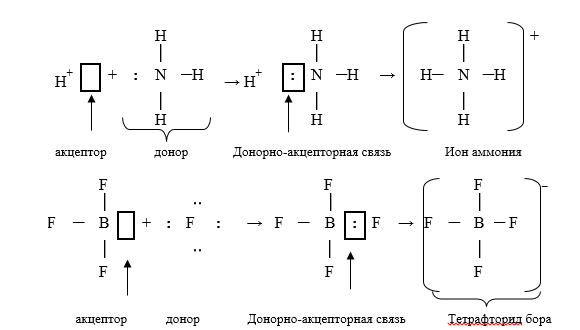
Вопрос 40
Константы нестойкости
Общая константа нестойкости равна произведению ступенчатых констант нестойкости. Константа устойчивости относится к процессу образования комплексного иона и равна обратной величине константы нестойкости: Куст = 1/Кнест. Константа устойчивости характеризует равновесие образования комплекса. Если вместо равновесия в реакциях образования комплексов рассматривать обратный процесс – реакции диссоциации комплексов (или реакции обмена лигандов на молекулы растворителя), то соответствующие константы будут носить название ступенчатых констант нестойкости комплексов:
[ML]  M + L; K1(нест) = [M] [L] / [ML]
M + L; K1(нест) = [M] [L] / [ML]
и общих (суммарных) констант нестойкости комплексов:
[ML]  M + L; 1(нест) = [M] [L] / [ML]
M + L; 1(нест) = [M] [L] / [ML]
поэтому для сравнения прочности комплексов могут использоваться справочные данные как по значениям констант образования, так и констант нестойкости. Чем больше концентрация хлоридных ионов, тем с большим координационным числом образуется комплексное соединение. Как только будет достигнуто максимально возможное для данного комплексообразователя координационное число, образование новых комплексных соединений приостанавливается, и при дальнейшем увеличении концентрации лиганда наблюдается постепенное исчезновение в растворе комплексных частиц с меньшими координационными числами. Как правило, ступенчатые константы образования уменьшаются по мере возрастания числа лигандов. Среди причин закономерного уменьшения значений ступенчатых констант образования с увеличением числа лигандов прежде всего выделяют возрастание пространственных затруднений в размещении вокруг комплексообразователя все большего числа лигандов и электростатическое отталкивание одноименно заряженных лигандов.
Образование КС
Как известно, реакции в растворах всегда протекают в направлении наиболее полного связывания ионов, в том числе за счет образования комплексных соединений, в которых в результате донорно-акцепторного взаимодействия возникает устойчивая внутренняя сфера.
FеCl3 + 6КСNS К3[Fе(СNS)6] + ЗКСl
(Fе3+ + 6СНS- [Fе(СNS)6]3-)
Вследствие образования устойчивых комплексов возможно даже растворение тех осадков, которые посылают в раствор за счет диссоциации растворившейся части вещества крайне небольшое количество ионов, способных с добавленным реагентом образовывать устойчивую внутреннюю сферу комплекса:
Zn(ОН)2 + 2NаОН Nа2[Zn(ОН)4]
(Zn(ОН)2 + OH- [Zn(ОН)4]2-)
Благодаря образованию комплекса происходит связывание молекулы аммиака (газообразного лиганда):
NН3 + НС1 [NН4]С1 (NН3 + Н+ [NН4]+)
NН3 + Н20 NН3 * Н20
В кислой среде происходит прочное связывание NН3 вследствие образования комплексного иона [NН4]+, а в нейтральной и щелочной среде имеет место конкуренция за прочное связывание Катиона водорода между анионом ОН- (Ка= КH2O = 1,8*10-16) и молекулой аммиака (Ка = Кнест (NH4+) = 5,4*10-10). Из сравнения констант соответствующих равновесий видно, что молекула воды удерживает катион Н+ значительно сильнее, чем комплексный ион [NН4]+.
Вопрос 42
ГАЛОГЕНЫ
Как видно из этих данных, в ряду F — С1 — Вг — I — At радиус атомов увеличивается, а энергия ионизации уменьшается. Это свидетельствует об ослаблении признаков неметаллического элемента: фтор — наиболее ярко выраженный элемент-неметалл, а астат проявляет уже некоторые признаки элемента-металла.
Химические свойства.
Окислительная способность повышается в ряду Аt2—F2.
Отсюда следует, что более сильный окислитель вытесняет более слабый из галогенидов.
2NaBr + Cl2 ® 2NaCl + Br2
F2. — один из сильнейших окислителей, с большинством простых веществ реагирует бурно уже при обычной температуре, с некоторыми из них (S, Р) — даже при температуре жидкого воздуха (—190°С); окисляет инертные газы (Кг, Хе, Rn) и такие стойкие соединения, как Н20 и SiO2.
Вг2, I2 , Аt2 окисляются при действии сильных окислителей, Cl2 — только при взаимодействии со F2.
Способность окисляться т.е. повышается в ряду Вг2, I2 , Аt2.
Правило: нижестоящий в ПС галоген вытесняет вышестоящий из солей с галогенами в положительной степени окисления
2NaClО + Br2 ® 2NaBrО + Cl2
Для С12, Вг2, I2 характерны реакции диспропорционирования; способность к диспропорционированию в ряду Cl2, Br2 ,I2 уменьшается.
NaOH + Cl2 = NaOCl + NaCl + H 2O
Реакции галогенов с простыми веществами

Реакции с галогенов с важнейшими реагентами
Примеры : Cl2 + H2O ® HCl + HClO
2Cl2 + 2Ca(OH)2 ® CaCl2 + Ca(ClO)2 + 2H2O
2F2 + 2H2O ® 4HF + O2
Сверху вниз окислительная способность галогенов растет, поэтому каждый вышестоящий галоген вытесняет нижестоящий из галогенидов, т.е.
Na Br + Cl 2® NaCl + Br 2
Наоборот каждый нижестоящий вытесняет вышестоящий из кислородосодержащих солей
NaClО + Br 2® NaBrО + Cl2
Вопрос 43
Галогеноводоро́ды — общее название соединений, образованных из водорода и галогенов (элементов подгруппы фтора):
· Плавиковая кислота — водный раствор фтороводорода
· Соляная кислота — водный раствор хлороводорода
· Бромоводородная кислота — водный раствор бромоводорода
· Иодоводородная кислота — водный раствор иодоводорода
· Астатоводородная кислота — водный раствор астатоводорода
Все галогеноводороды — бесцветные ядовитые газы с резким запахом, хорошо растворимые в воде. На воздухе их концентрированные растворы дымят вследствие выделения галогеноводородов.
Способы получения
Вытеснение из солей сильными кислотами:
2NaCl+H2SO4=2HCl+Na2SO4
{\displaystyle {\mathsf {NaCl+H_{2}SO_{4}\rightarrow HCl+NaHSO_{4}}}}Хлор, бром, иод непосредственно взаимодействуют с водородом, образуя галогеноводороды:
{\displaystyle {\mathsf {H_{2}+Cl_{2}\rightarrow 2HCl}}}H2+Cl2=2HCl
H2+Br2=2HBr
H2+I2=2HIhHH
{\displaystyle {\mathsf {H_{2}+Br_{2}\rightarrow 2HBr}}}{\displaystyle {\mathsf {H_{2}+I_{2}\rightarrow 2HI}}}Хлор реагирует с водородом бурно, со взрывом, но реакцию необходимо инициировать (путём нагревания или освещения), что связано с её цепным механизмом. Кислотные свойства HI выражены гораздо сильнее, чем HF, поскольку связь H-I слабая, водород легко отщепляется от атома йода. От HF водород уходит с неохотой, поскольку связь H-F короткая и крепкая. Окислительные свойства от HF до HI уменьшаются, а восстановительные - возрастают. Сверху вниз кислотные свойства увеличиваются, а основные уменьшаются.
Галогениды — группа минералов, представляющих собой соединения галогенов с другими химическими элементами или радикалами. К галогенидным минералам относятся фтористые, хлористые и очень редкие бромистые и иодистые соединения. Фтористые соединения (фториды), генетически связаны с магматической деятельностью, они являются возгонами вулканов или продуктами гидротермальных процессов, иногда имеют осадочное происхождение. Некоторые галогенные соединения образуются в зоне окисления сульфидных (медных, свинцовых и других) месторождений.
Типичные минералы класса фторидов — виллиомит NaF, флюорит CaF2, криолит Na3AlF6; класса хлоридов — галит NaCl, сильвин КCl, карналлит KMgCl3·6(H2O). Сырьё в пищевой, химической, металлургической промышленности
Галогениды щелочных металлов представляют собой соединения ионного типа. За исключением галогенидов цезия, они кристаллизуются в решетку со структурой каменной соли. Галогениды многих металлов обнаруживают частично ионный и частично ковалентный характер. Ковалентный характер галогенидов возрастает не только в пределах каждого периода, но и при перемещении к нижней части группы галогенов
Пример гидролиза
MgI2+H2O=MgOHI+HI
Mg2+ + H2O=Mg(OH)+ + H+
MgOHI+H2O=Mg(OH)2+HI
Mg(OH)+ + H2O=Mg(OH)2 + H+
Практика
11) Н2S (г) + Cl2(г) ↔2НСl(г) + S (т)
 /
/  =+1,36
=+1,36
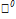
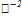 /
/ 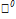 =0,14
=0,14
Таким образом Cl2 – более сильный окислитель, значит, реакция пойдет в прямом направлении.
1) K= 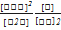
17) 5K2 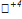 O3 + 2K
O3 + 2K 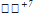 O4 + 3H2SO4 → 6K2
O4 + 3H2SO4 → 6K2 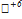 O4 + 2
O4 + 2 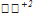 SO4 + 3H2O
SO4 + 3H2O
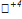 -2
-2  5 окисление
5 окисление
 +5
+5 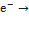
 2 восстановление
2 восстановление
K2SO3 - восстановитель
KMnO 4- окислитель
12) N(HCl)= 2 моль
m(HCl)= 2*(1+35.5)= 73 г
73 ----- 38%
х -------- 100%
х= 100*73/38= 192,1 г р-ра
V=m/плотность
V= 192.1/1.19= 161.43 мл
11)Дано: V=2дм3, n(A)=4,5 моль n(В)=3 моль, n(С)=2 моль, t=20 сек
Определить:v
Решение:
A+B=2C
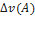 =
= 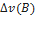 =-
=-  v(B)
v(B)
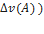 =
= 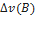 =-
=-  *2=-1 моль
*2=-1 моль
Средняя скорость реакции по веществу А
V= 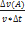
V= 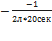 =-0,025
=-0,025 
Вопрос 30
Молярность (молярная объёмная концентрация)
Молярная концентрация- число молей растворённого вещества в единице объёма раствора. Молярная концентрация в системе СИ измеряется в моль/м3, однако на практике её гораздо чаще выражают в моль/л или ммоль/л. Также распространено выражение в «молярности». Возможно другое обозначение молярной концентрации - С(х), которое принято обозначать М. Так, раствор с концентрацией 0,5 моль/л называют 0,5-молярным.
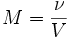 ,
,
где:
ν — количество растворённого вещества, моль;
V — общий объём раствора, л.
Дата: 2019-02-19, просмотров: 441.