Так как электродные потенциалы традиционно определяют как восстановительные потенциалы, знак окисляющегося металлического электрода должен быть изменён на противоположный при подсчёте общего потенциала ячейки. Также нужно иметь в виду, что потенциалы не зависят от количества передаваемых электронов в полуреакциях (даже если оно различно), так как они рассчитаны на 1 моль переданных электронов. Отсюда при расчёте какого-либо электродного потенциала на основании двух других следует проявлять внимательность. В гальванической ячейке, где самопроизвольная окислительно-восстановительная реакция заставляет ячейку производить электрический потенциал, Энергия Гиббса ΔGoдолжна быть отрицательной в соответствии со следующим уравнением:
ΔGoяч = -nFEoяч
где n это количество молей электронов на моль продуктов, а F является постоянной Фарадея, ~96485 Кл/моль. Таким образом применимы следующие правила:
если Eoяч> 0, тогда процесс самопроизвольный (гальваническая ячейка)
если Eoяч< 0, тогда процесс несамопроизвольный (электролитическая ячейка)
Уравнение Нернста — уравнение, связывающее окислительно-восстановительный потенциал системы с активностями веществ, входящих в электрохимическое уравнение, и стандартными электродными потенциалами окислительно-восстановительных пар. Было выведено немецким физико-химиком Вальтером Нернстом

E – электродный потенциал,  – стандартный электродный потенциал, измеряется в вольтах
– стандартный электродный потенциал, измеряется в вольтах
R – универсальная газовая постоянная, равна 8, 314 Дж/(моль*К)
Т – абсолютная температура
F – постоянная Фарадея = 96485,33 Кл·моль−1
n – число электронов, участвующих в процессе
aOx и aRed – активности, соответственно окисленной и восстановленной форм вещества, участвующего в полуреакции .
Электрохимический ряд активности металлов (ряд напряжений, ряд стандартных электродных потенциалов) — последовательность, в которой металлы расположены в порядке увеличения их стандартных электрохимических потенциалов φ0, отвечающих полуреакции восстановления катиона металла Men+: Men+ + nē → Me
Ряд напряжений характеризует сравнительную активность металлов в окислительно-восстановительных реакциях в водных растворах.
· Металлы, стоящие левее водорода, являются более сильными восстановителями, чем металлы, расположенные правее: они вытесняют последние из растворов солей. Например, взаимодействие Zn + Cu2+ → Zn2+ + Cu возможно только в прямом направлении.
· Металлы, стоящие в ряду левее водорода, вытесняют водород при взаимодействии с водными растворами кислот-неокислителей; наиболее активные металлы (до алюминия включительно) — и при взаимодействии с водой.
· Металлы, стоящие в ряду правее водорода, с водными растворами кислот-неокислителей при обычных условиях не взаимодействуют.
· При электролизе металлы, стоящие правее водорода, выделяются на катоде; восстановление металлов умеренной активности сопровождается выделением водорода; наиболее активные металлы (до алюминия) невозможно при обычных условиях выделить из водных растворов солей.
На редокс-процессы влияют: 1)концентрация ионов водорода, 2)комплексообразование, 3)ионная среда раствора, 4) образование осадка. Повышение степени окисления элемента увеличивает его электроотрицательность и усиливает различия в способности к комплексообразованию неодинаково для окисленной и восстановленной форм. Поэтому комплексообразование понижает активность окисленной формы в большей степени, чем активность восстановленной формы. Так как окислительный потенциал определяется отношением активностей этих двух форм, то окислительно-восстановтельный потенциал всей системы понижается. Если же восстановленная форма связывается в более сложный комплекс, то О-В потенциал системы увеличивается. При изменении рН раствора может изменяться диссоциация окислителей и восстановителей, изменяющая состав ионов или молекул. Например, ион  в кислой среде переходит в ион HS- и в молекулы H2S. С увеличением кислотности раствора уменьшается, поэтому концентрация сульфид-иона, уменьшается восстановительная способность раствора и потенциал системы увеличивается. При этом общая концентрация серусодержащих веществ равна концентрации
в кислой среде переходит в ион HS- и в молекулы H2S. С увеличением кислотности раствора уменьшается, поэтому концентрация сульфид-иона, уменьшается восстановительная способность раствора и потенциал системы увеличивается. При этом общая концентрация серусодержащих веществ равна концентрации  , HS-, H2S.
, HS-, H2S.
Вопрос 38
Окислительно-восстановительное действие электрического тока может быть во много раз сильнее действия химических окислителей и восстановителей. При электролизе на катоде к ионам присоединяются электроны, а на аноде ионы отдают электроны. Следовательно, электрический ток при электролизе производит на катоде восстановление, а на аноде — окисление. При химических реакциях процессы окисления обязательно одновременно сопровождаются процессами восстановления. Это положение остается в силе и в случае электролиза, но здесь одновременно протекающие процессы окисления и восстановления пространственно разделены окисление происходит на аноде, а восстановление на катоде. Окислительно-восстановительное действие электрического тока используется в технике для получения некоторых очень важных химических соединений. Инертный электрод применяется, если необходимо, чтобы был установлен простой электрический контакт с раствором без возникновения дополнительных химических реакций с участием материала электрода. К наиболее употребительным инертным электродам относятся благородные металлы, обычно платина, реже серебро или золото, в ряде случаев пригодны угольный, графитовый или вольфрамовый электроды.
Типичные инертные электроды - платина и углерод; в следующем разделе мы познакомимся также с некоторыми наиболее реакционно-способными металлами, которые являются реагирующими электродами.
Активный электрод также подвергается поляризации, но в значительно меньшей степени и в обратном направлении - в том смысле, что по мере работы элемента и увеличения концентрации ионов металла переход в раствор новых ионов замедляется, и потенциал электрода становится более положительным.
Активным электродом называется электрод, состоящий из химического элемента в чистом виде, который при погружении в раствор входит в химическое равновесие с ионами того же элемента, находящимся в растворе.
Вопрос 39
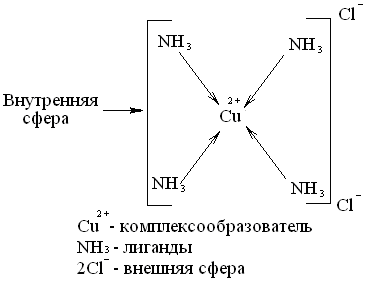
Комплексное (или координационное) соединение – соединение сложного состава, в котором можно выделить центральный атом (комплексообразователь) и непосредственно связанные с ним молекулы или ионы (лиганды).Строение комплексных соединений
Основу координационной теории Вернера составляют следующие положения:
- Центральное место в комплексных соединениях занимает комплексообразователь - обычно положительно заряженный ион (чаще всего металл)
- Вокруг комплексообразователя расположены или координированы лиганды (старое название адденды), т.е. ионы противоположного знака или нейтральные молекулы.
- Комплексообразователь и лиганды образуют внутреннюю сферу комплексного соединения.
- Ионы, не вошедшие во внутреннюю сферу, составляют внешнюю сферу комплексных соединений.
- Согласно общепринятым обозначениям внутренняя сфера при написании отделяется от внешней квадратными скобками.
Так соединение [Cu(NH3)4]Cl2 может быть изображено:
КЧ зависит от электронного строения центрального атома, от его степени окисления, размеров центрального атома и лигандов, условий образования комплексного соединения, температуры и других факторов. КЧ может принимать значения от 2 до 12. Чаще всего оно равно шести, несколько реже – четырем.
Лигандами могут быть частицы, до образования комплексного соединения представлявшие собой молекулы (H2O, CO, NH3 и др.), анионы (OH-, Cl-, PO43- и др.), а также катион водорода.
Дентантность (координационная емкость) лиганда - это число координационных мест, которое может занимать данный лиганд.
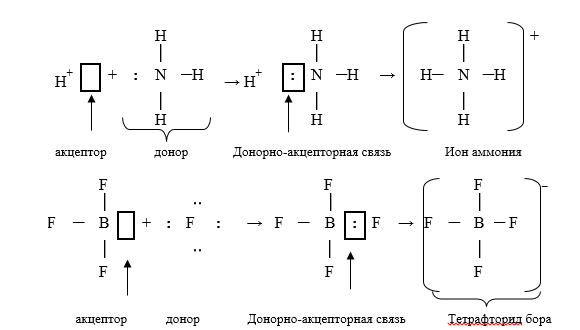
Механизм образования координационной (донорно-акцепторной) связи
Дата: 2019-02-19, просмотров: 437.