Попытку согласовать эмпирические закономерпности и ядерную модель атома Резерфорда предпринял датский ученый Бор (1885-1962), выдвинув два постулата (1913). Мы рассматриваем теорию Бора для водородоподобного атома, состоящего из ядра с зарядом Ze(Н, Не+, Li++ и др.) и одного электрона вращающегося вокруг него по круговой орбите.
Первый постулат (правило стационарных состояний):
Существуют стационарные состояния атома, находясь в которых он
не излучает энергию.
Этим стационарным состояниям соответствуют вполне определенные круговые орбиты, по которым движутся электроны. Орбиты электронов удовлетворяют условию квантования Бора: момент импульса электрона, движущегося по круговой орбите, должен быть целочисленно кратен приведенной постоянной Планка
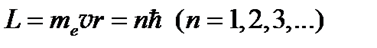 (55)
(55)
Заметим, что несмотря на движение с ускорением, электроны не излучают электромагнитных волн.
Второй постулат (правило частот):
При переходе атома из одного стационарного состояния в другое
испускается или поглощается квант электромагнитной энергии.
При переходе атома из состояния с большей энергией в состояние с меньшей энергией 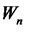 >
> 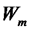 происходит излучение кванта энергии. Этот переход соответствует переходу от более отдаленной от ядра наболее ближнюю к ядру орбиту. При
происходит излучение кванта энергии. Этот переход соответствует переходу от более отдаленной от ядра наболее ближнюю к ядру орбиту. При 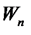 <
< 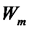 происходит поглощение фотона. Поглощению фотона соответствует переход от ближней к ядру орбиты на более отдаленную орбиту. Правило частот Бора может быть выражено в виде
происходит поглощение фотона. Поглощению фотона соответствует переход от ближней к ядру орбиты на более отдаленную орбиту. Правило частот Бора может быть выражено в виде
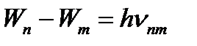 . (56)
. (56)
Правило частот Бора не подсказано никакими эмпирическими соотношениями, а является гениальной догадкой Бора. Это правило в соединении с формулой (54) позволило Бору рассчитать спектр атома водорода и водородоподобных систем и теоретически вычислить постоянную Ридберга.
Бор считал, что при движении электрона по круговой орбите силой, обуславливающей центростремительное ускорение,является его кулоновское притяжение к ядру
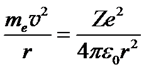 . (57)
. (57)
Исключив скорость 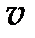 из (57) и (55), находим радиусы орбит
из (57) и (55), находим радиусы орбит
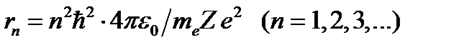 .
.
Радиусы орбит возрастают пропорционально квадратам номеров орбит.
При n = 1 для атома водорода (Z=1) находим
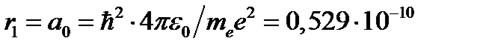 м.
м.
Этот радиус называется первым боровским радиусом.
Энергия электрона равна сумме его кинетической энергии и потенциальной энергии в электрическом поле ядра
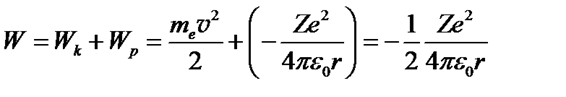 .
.
Подставив r в это выражение, получим
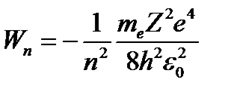 . (56)
. (56)
Для атома водорода (Z=1)
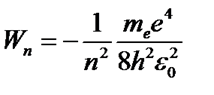 (57)
(57)
Используя (57) в формуле (55) находим
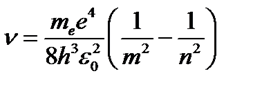 . (58)
. (58)
Из формулы (58) следует, что постоянная Ридберга равна
R= 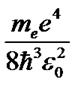 . (59)
. (59)
Вычисленное по формуле (59) значение постоянной Ридберга хорошо согласуется с его эмпирическим значением.
Из формулы (57) следует, что энергетические состояния атома водорода образуют последовательность энергетических уровней, изменяю-щихся в зависимости от числа n(рис.48). Энергетическое состояние с n= 1называется основным или нормальным (невозбужденным) состоянием. Все состояния с n> 1 называются возбужденными. При возрастании n
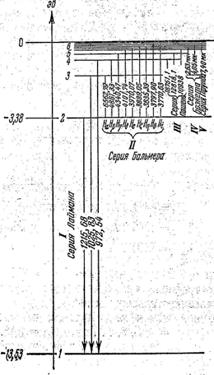
Рис.48
энергетические уровни сближаются к границе, соответствующей n= ∞, причем W∞=0. Знак минус в формуле (57) указывает, что электрон связан с ядром силой притяжения. Поэтому абсолютное значение Wn является энергией связи электрона в атоме, находящемсяв состоянии n. Состояние сn= ∞ соответствует ионизации атома, т.е. отрыву из него электрона. На рис показано также образование спектральных серий атома водорода в результате переходов между энергетическими уровнями. Очевидно, что серия Лаймана это результат переходов электронов с возбужденных энергетических уровней n =2, n =3,… на уровень n =1; серия Бальмера это результат переходов электронов с возбужденных энергетических уровней атома n =3, n =4,… на уровень n =2 и т д.
Теория Бора сыграла огромную роль в создании атомной физики. Особенно велика ее роль в атомной спектроскопии, в которой был с помощью теории Бора систематизирован огромный экспериментальный материал. Тем не менее, наряду с успехами, в теории Бора имелись существенные недостатки. Главное из них ее внутренняя противоречивость: сочетание классических принципов с искусственными квантовыми постулатами вряде случаев приводил к существенным трудностям. Она не смогла объяснить интенсивности спектральных линий. Она оказалась непригодной для объяснения спектральных свойствмногоэлектронных атомов. Даже при объяснении спектра атома гелия, содержащего два электрона, она оказалась непригодной. Имея успех при объяснении одних фактов, и, оказываясь бессильной при объяснении целого ряда других фактов, теория Бора явилась переходным этапом присоздании более последовательной квантовой (волновой) механики.
Теория Бора непоследовательна. С одной стороны, она отвергает описание атома на основе классической физики, так как постулирует наличие стационарных состояний и правила квантования, непонятных с точки зрения механики и электродинамики. С другой стороны, классические законы второй закон Ньютона и закон Кулона используются для записи уравнения движения электрона по круговой орбите13.
Теория Бора не смогла дать адекватное описание самого простого после водорода атома гелия. Подавно не могло быть и речи о распространении теории Бора на более сложные атомы14.
Даже в самом атоме водорода теория Бора смогла описать не всё. Например, дав выражения для частот спектральных линий, модель Бора не объясняла различие в их интенсивностях. Кроме того, неясен оставался механизм образования молекулы водорода из двух атомов.
Несмотря на свои недостатки, теория Бора стала важнейшим этапом развития физики микромира. Полуклассическая-полуквантоваямодель Бора послужила промежуточным звеном между классической физикой и последовательной квантовой механикой, построенной десятилетием позже в1920-хгодах.
Дата: 2019-02-19, просмотров: 443.