СПЕКТРОМ электромагнитного излучения (ЭМИ) называется совокупность электромагнитных волн, излучаемых или поглощаемых атомами (молекулами) данного вещества.
ЛИНЕЙЧАТЫЙ спектр состоит из отдельных компонент (линий), близких к гармоническим. Расстояние между линиями (по шкале длин волн или частот) много больше ширины линий. Такой спектр излучают атомарные газы.
Кроме линейчатого выделяют еще ПОЛОСАТЫЙ спектр, который излучают молекулярные газы и СПЛОШНОЙ спектр, излучаемый нагретыми твердыми телами.
ПЛАНЕТАРНАЯ МОДЕЛЬ атома: в центре атома расположено очень малое положительно заряженное ядро, вокруг которого по определенным (разрешенным) стационарным орбитам движутся электроны, масса которых во много раз меньше массы ядра. При движении по орбите электрон не испускает электромагнитного излучения (ЭМИ). При поглощении ЭМИ (фотона) электрон переходит на более «высокую» разрешенную орбиту, на которой его энергия становится больше на величину DЕЭЛ, равную энергии поглощенного фотонаЕФ. При обратном переходе электрон испускает фотон с такой же энергииЕФ= |DЕЭЛ|.
КВАНТОВАЯ модель атома отличается от планетарной в первую очередь тем, что в ней электрон не имеет точно определенной координаты и скорости, поэтому бессмысленно говорить о траектории его движения. Можно определить (и нарисовать) только границы области его преимущественного движения (орбитали).
УРАВНЕНИЕ ШРЕДИНГЕРА для движения электрона в кулоновском поле ядра атома водорода используется для анализа квантовоймодели атома. В результате решения этого уравнения получаетсяволновая функция, которая зависит не только от координаты 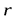 и времениt, но и от 4-х параметров, имеющих дискретный набор значений и называемых квантовыми числами. Они имеют названия: главное, азимутальное, магнитное и магнитное спиновое.
и времениt, но и от 4-х параметров, имеющих дискретный набор значений и называемых квантовыми числами. Они имеют названия: главное, азимутальное, магнитное и магнитное спиновое.
Главноеквантовое числоnможет принимать целочисленные значения 1, 2, ... . Оно определяет величину энергии электрона в атоме
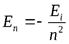 , гдеЕi - энергия ионизации атома водорода (13.6 эВ).
, гдеЕi - энергия ионизации атома водорода (13.6 эВ).
АЗИМУТАЛЬНОЕ (ОРБИТАЛЬНОЕ) квантовое число lопределяетмодуль моментаимпульса электрона при его орбитальном движении 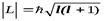 . Оно принимает целочисленные значенияl= 0, 1, 2, ...n-1 .
. Оно принимает целочисленные значенияl= 0, 1, 2, ...n-1 .
МАГНИТНОЕ квантовое число mlопределяетпроекцию вектора момента импульса орбитального движения электронаLZ на направление внешнего магнитного поля 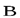 . Оно принимает положительные и отрицательные целочисленные значения, по модулю меньшие или равныеl.
. Оно принимает положительные и отрицательные целочисленные значения, по модулю меньшие или равныеl. 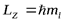 , гдеml = 0,±1,±2, ... ,±l .
, гдеml = 0,±1,±2, ... ,±l .
МАГНИТНОЕ спиновое квантовое число mSопределяетпроекцию вектора собственного момента импульса электрона(СПИНА 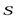 ) на направление внешнего магнитного поля
) на направление внешнего магнитного поля 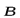 :
:
SZ= 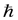 mS и принимает только 2 значения:mS = +1/2, -1/2. Для модуля спина
mS и принимает только 2 значения:mS = +1/2, -1/2. Для модуля спина 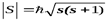 , гдеs– спиновое квантовое число, которое у каждой частицы имеет только одно значение. Например, для электронаs=
, гдеs– спиновое квантовое число, которое у каждой частицы имеет только одно значение. Например, для электронаs= 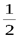 (аналогично, для протона и нейтрона). Для фотонаs= 1.
(аналогично, для протона и нейтрона). Для фотонаs= 1.
ВЫРОЖДЕННЫМИ называются состояния электрона с одинаковой энергией.
КРАТНОСТЬ ВЫРОЖДЕНИЯ равна количеству состояний с одной и той же энергией.
КРАТКАЯ запись состояния электрона в атоме: ЦИФРА, равная главному квантовому числу, и буква, определяющая азимутальное квантовое число:
ПРАВИЛО ОТБОРА азимутального квантового числа Dl =±1. Электрон в атоме может переходить только между состояниями, удовлетворяющему указанному правилу.
СПЕКТРАЛЬНОЙ СЕРИЕЙ называется совокупность линий излучения, соответствующих переходу электрона в атоме на один и тот же нижний уровень энергии:
Вопрос о спектрах представляется одним из центральных в современной физике: сюда относятся, например, такие обширные отделы современной физики, как учение о строении атома и молекул, учение об изотопах и др.
Линейчатые спектры состоят из ряда тонких прямых линий, которые могут быть расположены как в видимой, так и в инфракрасной и в ультрафиолетовой частях спектра. В видимой части они представляются светлыми линиями на темном фоне, причем цвет линии одинаков с цветом того места сплошного спектра, которые они занимают.
Линейчатый спектр показывает, что данное вещество испускает лучи не всевозможных длин волн / хотя бы в определенных пределах, но только лучи как бы избранные по каким–то правилам или законам. В течение долгого времени ученые тщетно старались найти какие–либо закономерности в распределении спектральных линий различных элементов, т.е. найти зависимость длины l или частоты n от какого–либо параметра.
Такую зависимость установил в 1885 году Бальмер для спектра водорода. Спектр водорода в видимой части из пяти линий: красной, зеленой, синей, фиолетовой 1 и фиолетовой 2.
Бальмер эмпирически установил, что длина волны спектральных линий водорода с большой точностью определяется формулой:
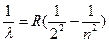 или n = cR или n = cR 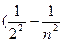 ), ),
| (2) |
где R – постоянное число, получившее название постоянной Ридберга
R= 10967758 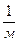 ; сR = 3,29 × 1015 1/сек;
; сR = 3,29 × 1015 1/сек;
n – целые числа, начиная с 3–х;
l – длина волны;
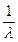 – получило название в о л н о в о е число
– получило название в о л н о в о е число  ;
;
n – частота колебаний;
С – скорость распространения света в вакууме.
Подставляя в формулу (2) n = 3 получим значение длины волны для красной линии водорода; при n = 4 – для зеленой; при n = 5 – для синей и т.д.
Ряд спектральных линий, для которых l (или n ) связаны между собой одной формулой, называется серией спектральных линий, а сама формула с е р и а л ь н о й.
Серия водородных линий, определяемых формулой (2), называется серией Бальмера. Она продолжается в ультрафиолетовой части спектра. Всего в ней было найдено 29 линий ( от n=3 до n=31).
Были получены и другие сериальные формулы водородных линий. В общем случае сериальная формула для водорода имеет вид:
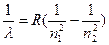 или n = сR ( или n = сR ( 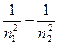 ) )
| (2/) |
Известны серии Лаймана при n1=1, для линий в ультрафиолетовой части спектра. Серия Пашена при n1 = 3, для линий в инфракрасной части спектра. Известны и другие серии при
n1 = 4, n1 = 5, n1 = 6.
Р. Ридберг показал, что в линейчатых спектрах не только водорода, но и других элементов, наблюдаются спектральные серии, причем частоты n всех линий данной серии удовлетворяют соотношение:
| n = Т (n1) – Т (n2) | (3) |
где n1 и n2 – целые числа, причем n2 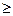 n1+1. Для данной серии n1 имеет постоянное значение. Изменение числа n дает все линии данной серии. Функции T (n1) и T (n2) называются спектральными т е р м а м и. В. Ритц установил справедливость положения названного комбинационным принципом Ритца: частоты спектральных линий излучения любого атома могут быть представлены в виде разности двух термов; составляя различные комбинации термов можно найти все возможные частоты спектральных линий этого атома. Например, беря разность термов для зеленой и красной линии водорода, получим:
n1+1. Для данной серии n1 имеет постоянное значение. Изменение числа n дает все линии данной серии. Функции T (n1) и T (n2) называются спектральными т е р м а м и. В. Ритц установил справедливость положения названного комбинационным принципом Ритца: частоты спектральных линий излучения любого атома могут быть представлены в виде разности двух термов; составляя различные комбинации термов можно найти все возможные частоты спектральных линий этого атома. Например, беря разность термов для зеленой и красной линии водорода, получим:
R ( 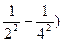 – R (
– R ( 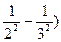 = R (
= R ( 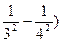
первую линию водорода серии Пашена. При неограниченном возрастании n частоты n всех серий спектра сходятся к соответствующим границам. Граничные частоты серии водородного спектра Т (n) = 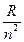 .
.
Все усилия физиков вывести сериальные формулы из общих законов электромагнитной теории света оказалась безуспешным. Не только вывод формул, но даже простое качественное описание возникновения линейчатых спектров оказалось не под силу старой классической физике, хотя предложенная Резерфордом ядерная модель строения атома и была, в основном, правильной.
Дата: 2019-02-19, просмотров: 474.