Общая характеристика экстракции. Экстракция — извлечение какого-либо вещества из одной фазы в другую (латинское слово ехtrago означает вытягиваю, извлекаю). В более узком смысле слова и в том, в котором мы будем его употреблять, экстракция — это жидкостная экстракция или процесс извлечения соединений металлов (и кислот) из водных растворов, где они содержатся в виде солей неорганических кислот, в органические, не смешивающиеся с водой растворы. Это общее определение позволяет обобщить все возможные случаи экстракции в технологии урана независимо от их механизма.
В настоящее время жидкостную экстракцию широко применяют в аналитической химии; в физико-химических исследованиях; в препаративной химии радиоактивных и стабильных нуклидов; для выделения радиоактивных нуклидов в специальных целях; для извлечения урана и тория из руд и их аффинажа; в технологии облученного ядерного топлива; в технологии извлечения и очистки цветных и редких металлов; в химической технологии неорганических и органических веществ.
В атомной промышленности, в химии и технологии ядерного топлива решение многих проблем достигнуто на основе разработки и внедрения экстракционной технологии. С использованием экстракционных методов эффективно решены сложные проблемы переработки комплексных урановых руд, разделения элементов с близкими физическими и химическими свойствами, получения конструкционных материалов и соединений высокой чистоты, а также создания современной технологии искусственных радиоактивных элементов. В урановом производстве в крупном промышленном масштабе экстракционную технологию применяют около 20 лет. За это время переработаны многие миллионы кубометров урановых растворов и получены многие тысячи тонн металлов.
Экстракция обладает многими преимуществами даже по сравнению с прогрессивной сорбционной технологией. Относительная простота экстракционной технологии, высокая эффективность и избирательность обеспечили ей быстрое внедрение и использование в промышленности.
Сущность метода экстракционного извлечения или разделения веществ заключается в том, что при определенных условиях соли некоторых элементов, например урана (VI), плутония (IV), тория и др. могут в заметном, часто значительном количестве переходить из водных растворов в не смешивающийся с водой органический растворитель, тогда как основная масса соединений других элементов остается в водном слое.
В простейшем оформлении экстракция выглядит так. Исходный раствор встряхивается в сосуде с органическим растворителем. Между фазами быстро устанавливается равновесие, -а затем происходит расслоение фаз. Определенное вещество переходит из водного раствора в органический слой, а прочие примеси остаются в водном растворе. Несмотря на то, что в промышленности применяют более сложные аппараты, процесс внешне представляется очень простым. Но в действительности экстракция — чрезвычайно сложный физико-химический процесс, связанный со сложными химическими реакциями комплексообразования в многокомпонентной двухфазной системе. Достаточно сказать, что до сих пор не существует полной теории экстракционных процессов.
Экстракционные процессы основаны на распределении веществ между двумя несмешивающимися фазами, чаще всего между водной и органической. В воде большинство растворенных неорганических веществ диссоциировано и образующиеся ионы гидратированы. В неполярной или малополярной органической жидкости (некоторым критерием неполярности служит низкое значение диэлектрической проницаемости) диссоциация растворенных веществ отсутствует или сильно подавлена. Переход ионов из воды в органическую фазу по энергетическим соображениям невыгоден, поэтому для получения экстрагируемого соединения необходимо образование (предварительное или в процессе экстрагирования вследствие реакции с экстрагентом) незаряженной электронейтральной молекулы или достаточно прочной ионной пары. Другое важное условие - «освобождение» экстрагируемого элемента (полное или частичное) от гидратной оболочки и образование более или менее гидрофобного соединения.
Полная дегидратация — не обязательное условие. В некоторых случаях вода является необходимой составной частью экстрагируемого комплекса (характерный пример - экстракция уранил-нитрата диэтиловым эфиром с образованием сольвата UO2(NO3)2.2(C2H5)2O.4H2O). Образовавшаяся тем или иным способом крупная незаряженная молекула или ионная пара, полностью или частично лишенная гидратной оболочки и других гидрофильных групп и имеющая в своем составе органическую часть, нарушает упорядоченную в результате образования водородных связей структуру воды, которая «выталкивает ее в органическую фазу.
Дегидратация экстрагируемых соединений имеет большое значение как для уменьшения взаимодействия соединений с водой, так и для освобождения координационных мест и присоединения гидрофобных (органических) лигандов.
Если органическая часть экстрагируемой молекулы дополнительно взаимодействует с органическим растворителем (например, с образованием водородных связей), это еще более способствует экстракции. Сказанное подчеркивает важную роль химического взаимодействия и большое значение химии координационных соединений для объяснения механизмов экстракции. Поэтому в данное время экстракцию рассматривают как химический процесс взаимодействия между распределяемым веществом, экстрагентом и водой.
В экстракционной практике принята следующая терминология. Органические соединения, способные вбирать в себя, извлекать из водной фазы металлы, их соединения или кислоты, называют экстрагентами. Их применяют или в чистом виде, или, особенно в последнее время, в смеси с другими органическими жидкостями. Органические жидкости, которые самостоятельно не экстрагируют исходные соли, но служат добавками при экстракции экстрагентами, называют разбавителями. Органический раствор, насыщенный извлекаемой солью, — экстракт, водный раствор, из которого извлекают вещество, — рафинат.
Применение правила фаз к экстракционным системам. Экстракционные процессы обычно протекают в гетерогенной, многофазной системе. В условиях фазового равновесия действует правило фаз Гиббса, устанавливающее соотношение между числом степеней свободы F, числом фаз j и числом независимых компонентов в системе K: F= K- j+2. В обычных условиях при экстракции число фаз равно 2, т. е. система двухфазна. Как известно, число компонентов определяется числом «независимых переменных» — самостоятельно существующих химических соединений, без числа уравнений, показывающих, как эти соединения связаны между собой.
При экстракции любой соли из ее водных растворов нейтральным экстрагентом система трехкомпонентна (вода, экстрагируемая соль, экстрагент). Если же в процессе экстракции образуются какие-либо соединения, то это не меняет числа независимых переменных, так как появляются уравнения, связывающие эти соединения. Например, при экстракции азотной кислоты трибутилфосфатом (ТБФ) из водного раствора протекает реакция
| Н2О | |
| ТБФорг + HNO3 водн ¾¾® [ТБФ . HNO3]орг | |
В равновесной системе содержатся четыре вещества: ТБФ, азотная кислота, вода и ониевая соль. Так как здесь связь между концентрациями компонентов выражается одним уравнением, то число компонентов будет на единицу меньше и равно числу исходных веществ, т. е. трем. В результате экстракционного процесса могут образоваться не одно, а два новых вещества. Например, экстрагент, работающий по катионообменному механизму, вначале находится в Н-форме и извлекает ион тория по уравнению
| Н2О | |
| 4RН + Th(NO3)4 ¾¾® ТhR4 + 4HNO3 водн | |
В этой находящейся в равновесии системе пять веществ, из которых два (продукты реакции) образуются в эквивалентных количествах. В результате мы имеем два уравнения, и число компонентов также будет равно трем (заметим, что при нарушении эквивалентности, например произвольной добавкой азотной кислоты, систему можно сделать четырехкомпонентной).
Согласно правилу фаз Гиббса, для трехкомпонентной двухфазной системы F=3-2+2= 3. Процессы экстракции обычно протекают при постоянном фиксированном давлении (атмосферное давление). Система становится бивариантной, т. е. независимыми параметрами являются температура и концентрация распределяемого компонента в одной из фаз. Концентрация вещества в другой фазе - зависимая величина. Функциональная зависимость этих величин может быть записана в виде общего термодинамического уравнения экстракционного извлечения:
Cорг = f(Cводн, Т)
При постоянных температуре и давлении это уравнение принимает вид изотермы экстракции Сорг= f(Сводн), а система становится моновариантной. Это означает, что можно произвольно выбрать одну концентрацию компонента (скажем, в водной фазе), тем самым уже определяя другую (в органической фазе), которую нельзя, следовательно, взять произвольно. Таким образом, при постоянной температуре должна существовать определенная зависимость Сорг = K(Сводн).
Закон распределения. Напомним закон распределения Нернста—Шилова, который был обоснован термодинамически В. Нернстом в 1891 г., а эмпирически установлен М. Бертло и Юнгфлейшем в 1871 г. Закон распределения гласит: для данной температуры отношение концентраций вещества, распределяющегося между двумя несмешивающимися жидкостями, — величина постоянная при различных его концентрациях.
Как видим, этот закон имеет прямое отношение к экстракции. Согласно ему, С’орг/С’водн = С’’орг/С’’водн = С’’’орг/С’’’водн = … = const, Сорг/Сводн = D (коэффициент распределения).
Таким образом, коэффициент распределения зависит от природы растворителя и распределяющегося вещества, от температуры, но не от концентрации вещества.
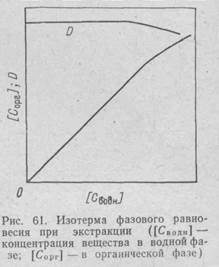 Закон распределения Нернста — Шилова — предельный закон справедливый при достаточно больших разведениях. С увеличением же концентрации наблюдаются существенные отклонения от этого закона: коэффициент распределения перестает быть постоянным, так как изменяются коэффициенты активности в фазах. Изотерма фазового равновесия при экстракции показана на рис. 61.
Закон распределения Нернста — Шилова — предельный закон справедливый при достаточно больших разведениях. С увеличением же концентрации наблюдаются существенные отклонения от этого закона: коэффициент распределения перестает быть постоянным, так как изменяются коэффициенты активности в фазах. Изотерма фазового равновесия при экстракции показана на рис. 61.
Кроме того, закон распределения справедлив лишь в том случае, когда растворенное вещество находится в обеих фазах в одной и той же форме. В большинстве реальных систем распределяемое вещество может диссоциировать, ассоциироваться, сольватироваться и гидролизоваться, образовывать полиядерные комплексы и т. п. Таким образом, закон распределения идеализирован и строго применим лишь в некоторых случаях.
Рассмотрим коэффициенты распределения Вг2 в воде и СCl4 (при 25° С) (табл. 21).
Таблица 21
Распределение Br2 между водной и органической фазами
| [Br2]водн, г/л | [Br2]орг, г/л | D = [Br2]орг /[Br2]водн |
| 14,42 | 545,2 | 37,8 |
| 7,9 | 252,8 | 32,0 |
| 2,05 | 58,3 | 28,4 |
| 0,77 | 21,5 | 27,9 |
| 0,576 | 15,7 | 27,3 |
| 0,4476 | 12,09 | 27,02 |
| 0,3803 | 10,27 | 27,00 |
| 0,2478 | 6,691 | 27,00 |
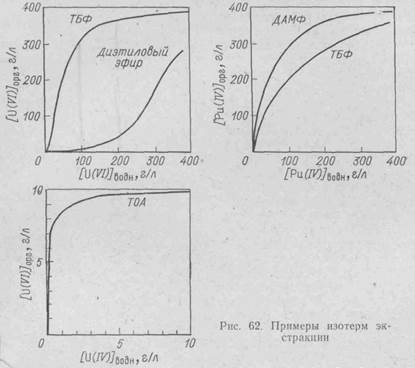
Как видно из таблицы, лишь в области разбавленных растворов закон Нернста — Шилова соблюдается достаточно точно. Приведем еще несколько диаграмм, на которых показаны изотермы экстракции некоторых систем, интересных для технологии урана (рис. 62).
Закон распределения вытекает из равенства химических потенциалов данного компонента в разных фазах при равновесии и может быть выведен строго термодинамически.
Из термодинамики известно, что при постоянных температуре и давлении в условиях равновесия парциальная моляльная энергия экстрагируемого вещества (для идентичного вещества в обеих фазах) одинакова в каждой фазе. Их химические потенциалы равны: m1=m2. Но m = m0 + RТ ln a, где m0 - химический потенциал в стандартном состоянии (обычно одномоляльный раствор со свойствами бесконечно разбавленного раствора); а - активность раствора с реальной концентрацией. Отсюда
m01 + RТ ln a1 = m02 + RТ ln a2 или а1 / a2 = exp[(m02 -m01) /RT]K,
т.е. отношение активностей компонента в двух фазах в состоянии равновесия и при постоянной температуре – величина постоянная К. Это точное выражение закона распределения для любых, а не только низких, концентраций. По определению
D = Cорг./Cвод.. = a1g2 / а2 g1 = K (g2 / g1)
где g1 и g2– коэффициенты активности вещества в водной и органической фазах соответственно. При бесконечном разбавлении g2 / g1 »1 и D®К, т.е. стремится к постоянному предельному значению.
Коэффициент распределения D имеет важное значение с точки зрения технологии экстракционных процессов.
1. Чем выше коэффициент распределения, тем большее количество вещества можно извлечь за одну операцию (контакт) экстрагирования. Поэтому желательно иметь экстрагенты с высокими коэффициентами распределения. Однако и при сравнительно невысоком D можно добиться хорошего извлечения повторением операций экстрагирования, что позволяет сколь угодно глубоко извлекать продукт в органическую фазу. При коэффициенте распределения, равном 10, уже при одном контакте извлечение составляет 90%. Даже для такого низкого коэффициента распределения, как 1, за пять контактов можно получить 97%-ное извлечение (0,50+0,25+0,125+0,063+0,032= =0,97 или 97%).
2. Различия коэффициентов распределения ценного компонента и примесей позволяют при экстракции эффективно избавиться от последних.
3. Даже небольшое различие коэффициентов распределения двух химически близких веществ дает возможность разделять их экстракционным методом и в конце концов селективно выделять их. Например, экстракция делает возможным разделение близких по свойствам Nb и Та, Нf и Zr, Ве и Аl, U и Рu и т. п.
Несмотря на то, что широкое промышленное применение экстракционных процессов - достижение середины XX века, возможность использования их на практике известна давно. Так, в литературе описано применение жидкостной экстракции еще в Древнем Риме для отделения золота и серебра от меди. Этот процесс был разработан еще в то время, когда ничего не было известно о коэффициентах активности, правиле фаз, законах массопередачи и т. п. Что касается урана, то способность уранил-нитрата избирательно извлекаться этиловым эфиром была описана Бухольцем еще в 1805 г., т. е. вскоре после открытия урана и почти за 40 лет до начала исследований свойств его соединений.
ТРЕБОВАНИЯ К ЭКСТРАГЕНТАМ В ТЕХНОЛОГИИ УРАНА
Экстракционную очистку урана от примесей использовал в своих опытах в 40-х годах прошлого столетия никто иной, как Э. Пелиго, о котором мы уже упоминали. Он установил большую растворимость уранил-нитрата в диэтиловом эфире. Эти наблюдения были использованы в ранних технологических схемах аффинажа урана. Позднее диэтиловый эфир стал применяться в качестве экстрагента и при переработке облученного ядерного топлива. Однако диэтиловый эфир - весьма специфическое, чрезвычайно неприятное вещество с точки зрения пожаро- и взрывоопасности. Поэтому усилия исследователей и технологов многих стран были направлены на подбор и синтез таких новых экстрагентов, которые, обладая достоинствами диэтилового эфира, в то же время не имели бы его недостатков. Лишь в течение последних 15 лет подобраны и синтезированы многие экстрагенты специально для технологии урана, а 1акже для переработки облученных ядерных материалов, удовлетворяющие требованиям производства.
Какие же требования предъявляют к экстрагентам, используемым в настоящее время в технологии урана?
1. Достаточно высокий коэффициент распределения урана, что является важнейшей характеристикой экстрагента.
2. Определенная селективность в отношении урана. Избирательность действия.
3. Быстрота и чистота разделения фаз после контакта.
4. Малая взаимная растворимость в системе водный раствор - экстрагент (в идеале - полная несмешиваемость).
5. Плотность экстрагента должна отличаться от плотности водного раствора. Следует учитывать, что в процессе экстракции плотность водной фазы уменьшается, а органической - увеличивается, что может затруднить разделение фаз после экстракции и даже вызвать их инверсию. Обычно плотность органической фазы снижают добавкой разбавителя. В некоторых случаях плотность органической фазы может быть намного больше плотности водной (разбавитель ССl4).
6. Химическая стойкость экстрагента к кислотам и окислителям (это же требование важно и для разбавителя).
7. Возможно меньшие летучесть, вязкость, токсичность.
8. Возможно более высокая температура вспышки, а еще лучше полная негорючесть экстрагента.
9. Радиационная стойкость (это особенно важно при переработке облученного урана).
10. Невысокая стоимость, доступность и простота синтеза.
11. Относительная легкость регенерации экстрагента, так как необходимо добиваться оборачиваемости экстрагента в процессе.
Следует отметить, что уран из-за своих физико-химических свойств является наиболее подходящим объектом для применения экстракционных процессов по сравнению с другими редкими, радиоактивными, цветными и благородными металлами. Поэтому не случайно экстракция в крупном промышленном масштабе была первоначально использована в гидрометаллургии урана.
Дата: 2019-02-25, просмотров: 377.