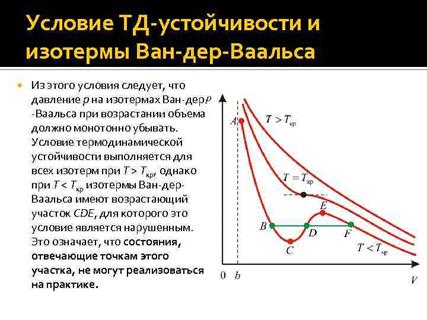
На участке АСВ изотермы Т1 давление растет с увеличением объема (dP/dV) > 0. Данное состояние неустойчиво, поскольку здесь должны усиливаться малейшие флуктуации плотности. Поэтому область ВСА не может устойчиво существовать. В областях DLB и AGE давление падает с увеличением объема (dP/dV)Т < 0 – это необходимое, но не достаточное условие устойчивого равновесия. Эксперимент показывает, что система переходит из области устойчивых состояний GE (газ) в область устойчивых состояний LD (жидкость) через двухфазное состояние (газ – жидкость) GL вдоль горизонтальной изотермы GCL.
При квазистатическом сжатии, начиная с точки G, система распадается на 2 фазы – жидкость и газ, причем плотности жидкости и газа остаются при сжатии неизменными и равными их значениям в точках L и G соответственно. При сжатии количество вещества в газообразной фазе непрерывно уменьшается, а в жидкой фазе – увеличивается, пока не будет достигнута точка L, в которой все вещество перейдет в жидкое состояние.

45. Фазовые переходы. Диаграмма состояния.
Фазой называется термодинамическое равновесное состояние вещества, отличающееся по физическим свойствам от других возможных равновесных состояний того же вещества. Переход вещества из одной фазы в другую – фазовый переход - всегда связан с качественными изменениями свойств тела. Примером фазовых переходов могут служить изменения агрегатного состояния. Но понятие «фазовый переход» шире, т.к. оно включает и переход вещества из одной модификации в другую при сохранении агрегатного состояния (полиморфизм), например, превращение алмаза в графит.
Различают два вида фазовых переходов:
Фазовый переход 1 рода – сопровождается поглощением или выделением теплоты, изменением объема и протекает при постоянной температуре.Примеры: плавление, кристаллизация, испарение, сублимация (возгонка) и др.
Фазовые переходы 2 рода – протекают без выделения или поглощения тепла, с сохранением величины объема, но скачкообразным изменением теплоемкости.Примеры: переход ферромагнитных минералов при определенных значениях давления и температуры в парамагнитное состояние (железо, никель); переход некоторых металлов и сплавов при температуре близкой к 00К в сверхпроводящее состояние (ρ = 0 Ом∙м) и др.
Диаграммы состояния представляют собой графическое изображение фазового состояния сплавов в зависимости от температуры и концентрации компонентов. Диаграммы состояния строят для условий равновесия, т. е. такого состояния сплава, которое достигается при очень малых скоростях охлаждения или длительном нагреве. Диаграммы состояния сплавов в равновесном состоянии являются теоретическими диаграммами, так как истинное равновесие в практических условиях достигается редко. В большинстве случаев сплавы находятся в метастабильном состоянии, т. е. в состоянии с ограниченной устойчивостью.
Дата: 2018-12-28, просмотров: 678.