241. Начальные концентрации веществ, участвующих в гомогенной реакции СО + Н2О = СО2 + Н2, были равны (моль/л): [СО] = 0,3; [Н2О] = 0,4; [СО2] = 0,4; [Н2] = 0,05. Определите концентрации всех участников реакции после того как прореагировала половина монооксида углерода?
242. Начальные концентрации веществ, участвующих в реакции N2 + 3Н2 = 2NH3, равны (моль/л): N2 – 0,2; Н2 – 0,3; NH3 – 0. Определите концентрации азота и водорода в момент, когда концентрация аммиака станет равной 0,1 моль/л?
243. Определите, во сколько раз изменится скорость прямой гомогенной газовой реакции 4HCl + O2 → 2H2O + 2Cl2, если общее давление в системе увеличить в 3 раза.
244. Скорость реакции 2NO + O2 → 2NO2 при одинаковых концентрациях NO и O2, равных 0,6 моль/дм3, составляет 0,18 моль / (дм3·мин). Вычислите константу скорости реакции.
245. Во сколько раз изменится скорость реакции 2А(г) + В(г) = С(г), если: а) концентрацию каждого из реагирующих веществ увеличить в 2 раза; б) общее давление увеличить в 3 раза; в) объём газовой смеси увеличить в 2 раза?
246. В некоторый момент протекания гомогенной газовой реакции А + 2В = D концентрации участников химического процесса были равны (моль/л): сА = 2,5; сВ = 1,5; с D = 0,5. Какими были исходные концентрации веществ А и В? Какими станут концентрации веществ А и D, когда прореагирует 80 % вещества В? Во сколько раз при этом уменьшится скорость реакции по сравнению с начальной скоростью?
247. Две реакции между простыми веществами протекают с такой скоростью, что за 1 мин образуется в первой реакции 6 г сероводорода, а во второй – 20 г йодоводорода. В каком случае средняя скорость реакции больше?
248. Константа скорости реакции А + 2В ® 3D равна 0,6 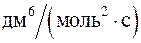 . Начальные концентрации веществ А и В равны соответственно 5 и 4 моль/дм3. Вычислите скорость реакции, когда концентрация вещества D достигнет 1,5 моль/дм3.
. Начальные концентрации веществ А и В равны соответственно 5 и 4 моль/дм3. Вычислите скорость реакции, когда концентрация вещества D достигнет 1,5 моль/дм3.
249. Константа скорости реакции А + 2В ® 2D равна 1,3 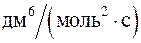 . Определите начальную скорость реакции, если к некоторому моменту времени концентрации веществ А, В и D оказались равными соответственно 0,2; 0,1 и 0,5 моль / дм3.
. Определите начальную скорость реакции, если к некоторому моменту времени концентрации веществ А, В и D оказались равными соответственно 0,2; 0,1 и 0,5 моль / дм3.
250. Для процесса 2N2O®O2 + 2N2 константа скорости реакции равна 5 × 10–5 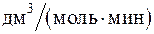 . Начальная концентрация реагента равна 3,2 моль/дм3. Определите скорость реакции, когда разложится 25 % исходного вещества.
. Начальная концентрация реагента равна 3,2 моль/дм3. Определите скорость реакции, когда разложится 25 % исходного вещества.
251. Константа скорости реакции получения йодоводорода из простых веществ равна 0,16 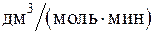 . Исходные концентрации йода и водорода равны соответственно 0,04 и 0,05 моль/дм3. Определите скорость реакции в момент времени, когда израсходуется половина водорода.
. Исходные концентрации йода и водорода равны соответственно 0,04 и 0,05 моль/дм3. Определите скорость реакции в момент времени, когда израсходуется половина водорода.
252. Изучали скорость реакции взаимодействия между веществами А и В. При постоянной концентрации А увеличение концентрации В в 3 раза приводит к повышению скорости реакции в 9 раз. При повышении концентраций обоих компонентов в 2 раза скорость реакции увеличивается в 16 раз. Запишите кинетическое уравнение реакции.
253. Во сколько раз увеличится скорость гомогенной газовой реакции между веществами А, В и D при повышении давления в 2 раза, если при изучении кинетики данной реакции были получены следующие сведения:
1) при повышении концентрации А в 4 раза скорость реакции возрастает в 4 раза;
2) при повышении концентрации В в 3 раза скорость реакции увеличивается в 27 раз;
3) при повышении концентрации D в 2 раза скорость реакции не изменяется.
254. Константа скорости реакции при температуре 9,4 °С равна 2,37 мин–1, а при температуре 14,4 °С она составляет 3,204 мин–1. Вычислите энергию активации и температурный коэффициент скорости реакции.
255. Энергия активации реакции кислотного гидролиза сахарозы при 37 °С равна 102 кДж/моль, а в присутствии фермента энергия активации снижается до 35 кДж/моль. Во сколько раз быстрее протекает реакция гидролиза сахарозы в присутствии фермента?
256. Вычислите энергию активации реакции спиртового брожения глюкозы в растворе в интервале 30–70 °С при γ = 2.
257. Во сколько раз возрастет скорость реакции при повышении температуры от 25 до 85 °С, если энергия активации равна 100 кДж/моль? Рассчитайте температурный коэффициент этой реакции.
258. Во сколько раз изменится скорость реакции, имеющей энергию активации 155 кДж/моль, при увеличении температуры от 350 до 400 К?
259. При 330 К константы скорости двух параллельных реакций одинаковы. Температурные коэффициенты Вант-Гоффа для них соответственно равны: γ1 = 2,1; γ2 = 3,6. Какой должна быть температура, чтобы константа скорости первой реакции стала бы в 100 раз меньше, чем второй?
260. Определите, на сколько градусов была повышена температура, если скорость реакции возросла в 1000 раз, а температурный коэффициент скорости равен 3,3?
261. Скорость горения кокса в токе воздуха описывается уравнением
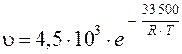 .
.
Вычислите скорость реакции при температуре 700 °С.
262. Энергия активации реакции равна 186,4 кДж/моль. Вычислите константу скорости реакции при 700 К, если константа скорости данной реакции при 450 К равна 0,942 ´ 10–6 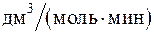 .
.
263. Константа скорости реакции при 1173 К равна 2,18 ´
´ 10 –4 с –1. Определите константу скорости реакции в присутствии катализатора, который понижает энергию активации реакции на 20 кДж/моль.
264. В металлургии для изготовления тиглей, электродов и других изделий применяют пироуглерод (пирографит) – продукт высокотемпературного разложения углеводородов. Скорость взаимодействия пироуглерода с воздухом определяется уравнением
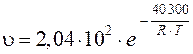 .
.
Вычислите скорость реакции при температуре 1000 °С.
265. Константа скорости реакции при 340 К равна 0,31 мин –1. Введение катализатора понижает энергию активации данной реакции на 95 кДж/моль. Определите константу скорости реакции в присутствии катализатора.
266. Энергия активации реакции равна 105 кДж/моль. При 300 К введение в систему катализатора ускоряет процесс в 10 000 раз. Определите энергию активации реакции в присутствии катализатора.
267. Во сколько раз увеличится скорость растворения железа в 5 % -ном растворе соляной кислоты при повышении температуры на 58 К, если температурный коэффициент скорости реакции равен 2,8?
268. Константы скорости реакции при 283 и 293 К равны 2,15 и 4,23 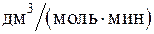 . При введении в систему катализатора скорость реакции возрастает в 25 000 раз. Определите энергию активации реакции в присутствии катализатора при 293 К.
. При введении в систему катализатора скорость реакции возрастает в 25 000 раз. Определите энергию активации реакции в присутствии катализатора при 293 К.
269. Константа скорости реакции при 9,4 °С равна 2,37 мин -1. Вычислите константу скорости реакции при температуре 0,4 °С, если энергия активации реакции равна 41 кДж/моль.
270. Две реакции при температуре 293 К протекают с одинаковой скоростью. Температурный коэффициент первой реакции равен 2, а второй – 4. Найдите соотношение скоростей данных реакций при температуре 500 К.
ХИМИЧЕСКОЕ РАВНОВЕСИЕ
271. В замкнутом объёме смешаны NO и О2. Константа равновесия для реакции: 2NO + O2 = 2NO2 равна 2,2. После установления равновесия концентрация монооксида азота равна 0,02 моль/л, а диоксида азота – 0,03 моль/л. Определите исходную концентрацию кислорода.
272. В сосуд объёмом 0,1 м3 введено 10 г водорода и 84 г азота. К моменту достижения равновесия в системе образовалось 34 г аммиака. Определите константу равновесия реакции.
273. Вычислите константу равновесия реакции
СО + Сl2 = СОСl2,
если исходные концентрации [СО] = 6 моль/л; [Cl2] = = 8 моль/л, а равновесие установилось, когда образовалось 3 моль/л СОСl2.
274. Для реакции Н2 + I2 = 2НI константа равновесия равна 36, а исходные концентрации Н2 и I2 одинаковые и равны 0,02 моль/л. Вычислите равновесные концентрации Н2, I2 и HI.
275. Вычислите константу равновесия обратимой реакции: СО2(г) + Н2(г) = СО(г) + Н2О(г), если при равновесии концентрации всех веществ оказались следующими (моль/л): [СО2] = 0,02; [Н2] = 0,005; [СО] = 0,015; [Н2О] = 0,015.
276. Реакция СО + Сl2 = СОСl2 протекает в объёме, равном 10 л. Состав равновесной смеси: 14 г СО, 35,5 г Сl2 и 49,5 г СОСl2. Вычислите константу равновесия данной реакции.
277. При некоторой температуре в системе
2NO2(г) = 2NO(г) + O2(г)
равновесная концентрация О2 составила 0,2 моль/л. Константа равновесия равна 12,8. Определите начальную концентрацию реагента.
278. Гетерогенная реакция С(графит) + СО2 (г) = 2 СО (г) определяет ход всех процессов карботермического получения металлов из оксидов. Рассчитайте константу равновесия Kр при общем давлении 0,1атм, если мольная доля СО в равновесной газовой смеси равна 0,52.
279. В реакторе объёмом 0,5 л протекает реакция
СН4(г) + Н2О(г) = СО(г) + 3Н2(г) .
Определите константу равновесия, если в начальный момент имелось 0,05 моль СН4 и 0,04 моль Н2О, а к моменту равновесия прореагировало 50 % начального количества метана.
280. При получении металлического магния электролизом расплавов, содержащих хлористый магний, протекает побочный процесс взаимодействия хлорида магния с кислородом воздуха
2MgCl2(т) + О2(г) = 2МgO(т) + 2Сl2(г).
Определите равновесные концентрации газообразных веществ для реакции, если константа равновесия K с = 1, а в начальный момент концентрации газов составляли: 0,9 моль/л для О2 и 0,2 моль/л для Cl2.
281. В гетерогенной химической системе при постоянных термодинамических параметрах установилось состояние равновесия. На основании закона действующих масс составьте выражения для констант равновесия реакций:
а) 2Mg(NO3)2(т) = 2МgO(т) + 4NO2(г) + О2(г);
б) 2Al(т) + 6Н2О(ж) = 3Н2(г) + 2Аl(OH)3(т);
в) FeO(кр) + СО(г) = Fe(кр) + СО2(г) .
282. Определите значения равновесных концентраций газообразных веществ для реакции Fe2O3(т) + 3СО(г) = 2Fe(т) + 3СО2(г), если константа равновесия K с = 0,125, а начальные концентрации газообразных веществ составляли 0,5 моль/л (СО) и 0,1 моль/л (СО2).
283. Закись железа FeO восстанавливается окисью углерода при 1000 °С и атмосферном давлении по реакции
FeO(т) + СО(г) = Fe(т) + СО2(г).
Определите состав равновесной газовой фазы, если Kр = 0,403, а исходная газовая смесь состояла из 20 % объем. СО и 80 % объем. СО2.
284. Выразите константу равновесия реакции СО2 + Ств« 2СО, используя константы равновесия реакций:
1) Ств + О2 « СО2, K1;
2) 2СО + О2 = 2СО2, K2.
285. Рассчитайте константу равновесия реакции восстановления твердого магнетита Fe3O4 водородом до вюстита FeO с образованием водяного пара, если равновесное давление водорода составило 39 мм рт. ст. при общем давлении в состоянии равновесия, равном 0,1 атм.
286. Константа равновесия реакции 4HCl + O2 « 2H2O+ 2Cl2 составляет 0,0562, а для реакции Н2О « Н2 + 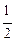 О2 она равна 2,5 × 10 –6. Вычислите константу равновесия реакции Н2 + Cl2« 2HCl.
О2 она равна 2,5 × 10 –6. Вычислите константу равновесия реакции Н2 + Cl2« 2HCl.
287. При постоянной температуре состояние равновесия реакции 2PbS(т) + 3О2(г) = 2PbO(т) + 2SO2(г) установилось при концентрации диоксида серы, равной 1,35 моль/л. Определите концентрацию О2 в некоторый момент протекания реакции, если концентрация SO2 в этот момент составляла 0,35 моль/л, а K с = 0,54.
288.В состоянии равновесия в системе А + В = 2D установились следующие концентрации: [А] = 0,4 моль/л; [В] = 0,2 моль/л; [D] = = 0,4 моль/л. Определите новые равновесные концентрации, если в систему дополнительно введено 0,3 моль/л вещества В. В какую сторону сместилось равновесие?
289. При некоторой температуре константа равновесия для реакции 2D(г) = А(г) + В(г) равна 5,0. До начала реакции исходная концентрация вещества D была равна 3,0 моль/л. После установления равновесия в систему добавили вещество А в количестве 1,0 моль/л. Определите равновесные концентрации до и после добавления вещества А.
290. В какую сторону сместится равновесие гомогенной газовой реакции А + 3В = 2С, если одновременно увеличить давление в системе в три раза и увеличить температуру на 20 градусов? Температурные коэффициенты прямой и обратной реакции соответственно равны 2 и 4. Каков знак изменения энтальпии для прямой реакции? Ответ подтвердите расчетами.
291. Химическое равновесие реакции СО2(г) + Н2(г) = СО(г) + + Н2О(г), протекающей при р, Т = const, установилось при следующих концентрациях реагирующих веществ (моль/л): [СО2] = 1; [Н2] = 1,5; [СО] = 2,25; [Н2О] = 2. Концентрация паров воды была увеличена до 2,5 моль/л. Рассчитайте новые равновесные концентрации реагирующих веществ.
292. При постоянной температуре состояние равновесия реакции FeO(т) + Н2(г) = Fe(т) + Н2О(г) устанавливается при концентрациях Н2 и Н2О, равных соответственно 0,47 и 2,24 моль/л. Затем концентрации увеличивают на 2,16 моль/л для Н2 и на 0,38 моль/л для Н2О, чем вызывают смещение равновесия. Рассчитайте новые равновесные концентрации газообразных веществ. В каком направлении смещается равновесие?
293. При постоянной температуре состояние равновесия реакции Fe2O3(т) + 3Н2(г) = 2Fe(т) + 3Н2О(г) установилось при концентрациях Н2 и Н2О соответственно 0,35 и 0,15 моль/л. После увеличения концентрации водорода на 1,5 моль/л произошло смещение равновесия. Рассчитайте новые значения равновесных концентраций газообразных веществ.
294. В металлургии цветных металлов реакциями, ведущими к получению металла, часто являются восстановление оксидов окисью углерода, водородом или углеродом. Вычислите равновесные парциальные давления газов при температуре 1000 К и общем давлении 1 атм для реакции
СоО(к) + СО(г) = Со(к) + СО2 (г),
если при 700 °С Kр = 42,7, а при 1100 °С Kр = 7,6.
295. При температуре 400 К константа равновесия реакции синтеза аммиака из азота и водорода равна 0,1 × 10-10 Па–2. Изменение энтальпии реакции равно –100 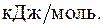 Вычислите константу равновесия данной реакции при 345 К.
Вычислите константу равновесия данной реакции при 345 К.
296. Вычислите DН реакции Feтв + Н2Огаз « FeОтв + Н2, если при температурах 1298 и 1173 К константы равновесия реакции равны 1,28 и 1,45 соответственно.
297. Какие меры следует предпринять для увеличения выхода монооксида углерода в обратимом процессе 2СО(г) « СО2(г) + С(т), если DН 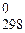 = –172,5 кДж/моль?
= –172,5 кДж/моль?
298. Константа равновесия Kр реакции С(т) + СО2 (г) = 2СО(г) при 1000 К равна 1,549 атм. Определите константу равновесия при температуре 1200 К, если среднее значение теплового эффекта реакции при постоянном давлении равно –172 кДж.
299. При какой температуре константа равновесия реакции СО + Н2Огаз = СО2 + Н2 будет равна 27,56, если при 1080 К константа равновесия Kр= 1, а изменение энтальпии реакции равно –9848 кал?
300. Для реакции MgCO3 (т) = MgO(т) + CO2 (г) равновесное парциальное давление СО2 при температурах 813 и 843 К равно 0,983 и 1,763 атм соответственно. Вычислите тепловой эффект реакции в данном интервале температур.
Литература
1. Задачи по общей и неорганической химии: Учеб. пособие для студентов высш. учеб. заведений / Р.А. Лидин, В.А. Молочко, Л.Л. Андреева; Под ред. Р.А. Лидина. М.: ВЛАДОС, 2004.
2. Задачи и упражнения по общей химии: Учеб. пособие / Б.И. Адамсон, О.Н. Гончарук, В.Н. Камышова и др.; Под ред. Н.В. Коровина. М.: Высш. шк., 2003.
3. Сборник задач и упражнений по общей химии: Учеб. пособие / С.А. Пузаков, В.А. Попоков, А.А. Филиппова. М.: Высш. шк., 2004.
4. Сборник задач и упражнений по общей химии: Учеб. пособие для нехим. спец. вузов / Л.М. Романцева, З.И. Лещинская, В.А. Суханова. 2-е изд., перераб. и доп. М.: Высш. шк., 1991.
5. Глинка Н.Л. Задачи и упражнения по общей химии: Учеб. пособие для вузов. М.: Интеграл-Пресс, 2001.
6. Литвинова Т.Н. Сборник задач по общей химии: Учеб. пособие для вузов. 3-е изд., перераб. М.: Оникс; Мир и Образование, 2007.
7. Задачник по общей химии для металлургов: Учеб. пособие для вузов / Под ред. Б.Г. Коршунова. М.: Высш. шк., 1977.
8. Михилев Л.А., Пасет Н.Ф., Федотова М.И. Задачи и упражнения по неорганической химии: Учеб. пособие для техникумов. СПб.: Химия, 1995.
9. Морачевский А.Г., Патров Б.В., Сладков И.Б. Сборник примеров и задач по физической химии. Л.: ЛПИ им. М.И.Калинина, 1974.
10. Курдюмов Г. М. 1234 вопроса по химии: Пособие для абитуриентов и студентов-первокурсников. М.: Мир, 2004. 192 с.
11. Свешникова Г.В. Основы химии в расчетах: Самоучитель решения расчетных химических задач. СПб: Химиздат, 2002. 240 с.
12. Семенов И. Н. Экспресс-учебник по решению химических задач. СПб: Химиздат, 2001. 128 с.
13. Волович П. М. Сборник задач по неорганической химии. М.: Рольф, 1999. 352 с. (Домашний репетитор).
14. Сборник задач и упражнений по общей и неорганической химии: пособие для вузов/Н. Н. Павлов, В. И. Фролов, С. В. Фролов и др.; под ред. Н. Н. Павлова. М.: Дрофа, 2005. 239, [1] с.
ПРИЛОЖЕНИЯ
П р и л о ж е н и е 1
Дата: 2019-02-02, просмотров: 569.