91. Молярная масса эквивалента четырехвалентного металла равна 29,7 г/моль. Определите название элемента.
92. Составьте формулу сульфида сурьмы, если молярные массы эквивалентов сурьмы и серы соответственно равны 24,35 г/моль и 16,0 г/моль соответственно.
93. Какова формула соединения, состоящего из марганца и кремния, если молярные массы эквивалентов Mn и Siсоответственно равны 27,5 г/моль и 7 г/моль.
94. Определите эквивалент и эквивалентную массу марганца в полуреакциях: а) MnO 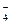 ®MnO2; б) MnO
®MnO2; б) MnO 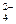 ®MnO
®MnO 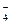 .
.
95. Сера образует два оксида. Запишите формулы оксидов и определите молярную массу эквивалента серы в этих оксидах.
96. Составьте формулы карбидов алюминия и циркония, если степень окисления углерода в данных соединениях минимальна, а молярные массы эквивалентов Al и Zr соответственно равны 9,0 г/моль и 22,8 г/моль.
97. Вычислите эквивалент и эквивалентную массу оксида магния и алюминия в следующих реакциях:
а) 2 НСl + MgO = MgCl2 + H2O;
б) 6 HNO3 + Al2O3 = 2 Al(NO3)3 + 3 H2O.
98. Вычислите молярные массы эквивалентов окислителя и восстановителя в окислительно-восстановительной реакции:
SO2 + Cl2 + 2H2O = H2SO4 + 2HCl.
99. Молярная масса эквивалента металла равна 30,64 г/моль. Определите название элемента, если его валентность В = 6.
100. Молярная масса эквивалента металла равна 18,61 г/моль. Определите название элемента, если его валентность В = 3.
101. Определите массовое содержание углерода в металлургическом коксе, если при сжигании 2,0 г кокса при температуре 1002 °С и давлении 750 мм рт. ст. было получено 16,6 дм3 двуокиси углерода.
102. Молярная масса эквивалента хлорида некоторого элемента равна 38,5 г/моль. Вычислите массовую долю хлора в данном хлориде. Рассчитайте объём кислорода (н.у.), который потребуется для окисления 25 г этого элемента до высшего оксида, если его валентность равна 4. Назовите этот элемент.
103.Сколько литров водорода (н.у.) потребуется для восстановления 112 г оксида металла, содержащего 71,43 % мас. металла? Вычислите молярную массу эквивалента металла?
104. Гидрид некоторого элемента в двухвалентном состоянии содержит 5,88 % мас. водорода. Какова массовая доля этого элемента в его оксиде, где валентность элемента равна шести? Назовите этот элемент.
105. Определите молярную массу эквивалента основания, если на нейтрализацию 1 г этого вещества израсходовано 2,14 г соляной кислоты.
106.1,37 г двухвалентного металла вытеснили из кислоты 0,5 л водорода при 18 °С и давлении 760 мм рт. ст. Вычислите молярную массу эквивалента металла, назовите металл.
107. Определите эквивалентное количество хлорида бария, участвующее в обменной реакции с серной кислотой, в которой образуется сульфат бария, если в реакцию вступило 0,125 моль серной кислоты.
108. Рассчитайте массу алюминия, вступившего в реакцию с разбавленной серной кислотой, если в результате реакции было собрано 10,24 л газа (н.у.).
109. Определите молярную массу эквивалента металла, если при взаимодействии 0,42 г этого металла с азотом образуют 0,7 г нитрида. Какой это металл, если его валентность равна 1?
110.Какую массу алюминия растворили в кислоте, если объём выделившегося водорода при температуре 291 К и парциальном давлении водорода 97,83 кПа равен 113 мл?
111. Рассчитайте молярную массу эквивалента металла, зная, что 28,5 г его при взаимодействии с водородом образуют 30 г водородного соединения.
112. Металл массой 0,5 г вытеснил из раствора кислоты 198 см3 водорода, собранного и измеренного над водой при температуре 298 К и давлении 99,3 кПа. Давление насыщенного пара воды при данной температуре составляет 23,5 кПа. Рассчитайте молярную массу эквивалента металла.
113. 0,43 г металла при реакции с кислотой вытеснили 123,3 мл водорода (н.у.). 1,555 г этого же металла вступают во взаимодействие с 1,415 г некоторого неметалла. Рассчитайте молярную массу эквивалента неметалла.
114. Молярная масса эквивалента металла составляет 56,2 г/моль. Вычислите массовое содержание металла в оксиде.
115. Металл образует оксид состава Me2O3, содержащий 68,4 % мас. металла. Вычислите атомную массу этого металла. Какой это металл?
116. Определите степень окисления золота в соединении, которое состоит из 64,9 % мас. золота и 35,1 % мас. хлора. Составьте формулу этого соединения и определите молярную массу эквивалента золота.
117. В раствор соляной кислоты погрузили металлическую пластинку массой 50 г. После выделения 336 мл водорода (н.у.) масса пластинки уменьшилась на 1,68 %. Чему равна молярная масса эквивалента металла? Какой это металл, если его валентность равна двум?
118. В закрытом сосуде, наполненном хлором, сожгли некоторое количество трехвалентного металла, в результате чего образовалось 32,5 г хлорида, а объём хлора уменьшился на 6,72 л (н.у.). Определите какой металл сожгли?
119. В одном из опытов раствор 1,450 г хлорида трехвалентного элемента обработали раствором нитрата серебра и получили при этом 2,298 г хлорида серебра. Какой это элемент?
120. 1 г металла соединяется с некоторой массой хлора, занимающей объем 336 мл при температуре 37 °С и давлении 98 кПа. Вычислите молярную эквивалентную массу металла.
СТРОЕНИЕ АТОМА И ПЕРИОДИЧЕСКАЯ
СИСТЕМА ЭЛЕМЕНТОВ
121. Найдите длину волны электрона, имеющего скорость 2 · 106 м/с.
122.Вычислите энергию, поглощаемую атомом водорода при переходе электрона из состояния n = 1 в состояние n = 2.
123. Определите длину волны α-частицы массой 6,64 · 10–27 кг, перемещающейся со скоростью 1 × 104 м/с.
124. Какова энергия электрона, если его масса равна 9 ·10–28 г, а скорость составляет 70 % от скорости света?
125. Вычислите, сколько фотонов с длиной волны 500 нм регистрируется глазом человека, если он воспринимает сигнал с энергией 1,6 ·10–17 Дж.
126. Какова длина волны де Бройля для электрона, если его кинетическая энергия 13,6 эВ?
127. Природный кремний имеет три изотопа, содержащие в ядрах 14, 15 и 16 нейтронов. Относительное содержание их соответственно 92,2; 3,7 и 3,9 % мас. Вычислите среднюю атомную массу кремния.
128. Природный бор имеет атомную массу 10,811 и состоит из изотопов 10В и 11В. Найдите относительное содержание этих изотопов, считая их атомные массы целочисленными.
129. Природный магний состоит из изотопов 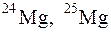 и
и 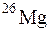 . Вычислите среднюю атомную массу природного магния, если содержание отдельных изотопов соответственно равно 78,6; 10,1 и 11,3 % атом.
. Вычислите среднюю атомную массу природного магния, если содержание отдельных изотопов соответственно равно 78,6; 10,1 и 11,3 % атом.
130. Массовое число атома некоторого элемента равно 181, в электронной оболочке атома содержится 73 электрона. Укажите число протонов и нейтронов в ядре и назовите элемент.
131. Какое количество энергии несет один квант света с длиной волны 7,5·10–7 м?
132. Вычислите энергию возбуждения электрона в атоме натрия, если при его возбуждении поглощается фотон с длиной волны 4340 · 10–10 м.
133. Определите энергию перехода электрона в атоме водорода, которой соответствует красная линия спектра испускания (l = = 656 нм).
134. Массовое число атома некоторого элемента равно 207, в электронной оболочке атома содержится 82 электрона. Укажите число протонов и нейтронов в ядре и назовите элемент.
135. Вычислите энергию возбуждения электрона в атоме лития, если при его возбуждении поглощается фотон с длиной волны 5440 · 10–10 м.
136. По символу изотопа элемента  указать название элемента, число протонов и нейтронов в его ядре и число электронов, содержащихся в электронной оболочке.
указать название элемента, число протонов и нейтронов в его ядре и число электронов, содержащихся в электронной оболочке.
137. Природный селен состоит из смеси шести устойчивых изотопов с массовыми числами 74, 76, 77, 78, 80 и 82. Массовая доля этих изотопов в смеси равна: 74Se – 0,0087; 76Se – 0,0902;
77Se – 0,0758; 78Se – 0,2352; 80Se – 0,4982; 82Se – 0,0919. Определите среднюю атомную массу природного селена.
138. Какую энергию надо сообщить невозбужденному атому водорода, чтобы он мог испускать излучение с длиной волны λ= = 1500 · 10–10 м?
139. Природный галлий состоит из изотопов  и
и 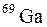 . Определите содержание отдельных изотопов в атомных процентах, если средняя атомная масса галлия равна 69,72.
. Определите содержание отдельных изотопов в атомных процентах, если средняя атомная масса галлия равна 69,72.
140. Вычислите длину волны де Бройля, которая соответствует электрону с массой 9,1 · 10–28 г, движущемуся со скоростью 6 · 106 м/с.
141. Запишите электронную конфигурацию иона Se2–. Изменяется ли радиус отрицательного иона селена по сравнению с нейтральным атомом селена и как?
142. Напишите электронные конфигурации валентных оболочек ионов: Br–; Al3+; Sn2+; Se2–; Р3+; Р 3–.
143. Напишите электронную формулу и составьте электронно-графическую схему элемента № 43. Определите валентный слой и семейство данного элемента.
144. Пользуясь правилом Гунда, покажите распределение электронов по квантовым орбиталям у атомов хлора, кобальта и азота.
145. Составьте электронную формулу элемента с порядковым номером 25. Распределите его валентные электроны по квантовым ячейкам и укажите для них значения четырех квантовых чисел.
146. Составьте электронную формулу атома аргона. Приведите примеры двух катионов и двух анионов с такой же электронной структурой. Расположите эти частицы в порядке возрастания их радиуса. Ответ мотивируйте.
147. Для каких элементов атомы имеют в невозбужденном состоянии только по два электрона на четвертом квантовом уровне? Напишите электронные формулы трех таких элементов. К каким электронным семействам относится каждый из них?
148. Напишите электронные формулы для атомов элементов, содержащих в ядре: а) 15 протонов и 16 нейтронов; б) 11 протонов и 12 нейтронов.
149. У атомов элементов VI (В) подгруппы наблюдается явление «провала» электрона. Запишите общую сокращенную электронную формулу атомов этих элементов без «провала» и с «провалом» электрона; чем обусловлен этот эффект?
150. Квантовые числа для электронов внешнего энергетического уровня атомов некоторого элемента имеют следующие значения:
| Номер электрона | n | l | ml | ms |
| 1 | 4 | 0 | 0 | + 1/2 |
| 2 | 4 | 0 | 0 | – 1/2 |
Напишите электронную формулу атома этого элемента и определите, сколько свободных 3d-орбиталей она содержит.
Дата: 2019-02-02, просмотров: 624.