151. Длина диполя молекулы НСl равна 0,22 · 10–8 см. Вычислите электрический момент диполя связи H – Cl.
152. Электрический момент диполя связи H – С в молекуле НСN равен 2,9 D. Найдите длину диполя данной связи.
153.Определите электрический момент диполя связи H – N, если длина диполя каждой связи в молекуле NH3 равна 0,3 · 10–8 см.
154. Вычислите эффективный радиус атома хрома, если плотность данного металла равна 7,16 г/см3.
155. Определите длину связи С – Сl в молекуле ССl4, если
l(С – С) = 1,54·10–10 м, аl(Сl – Сl) = 1,99 ·10–10 м.
156. Энергия диссоциации HI равна 298,4 кДж/моль. Можно ли разложить это вещество на атомы при облучении УФ-светом (l = = 2×10–7 м)?
157. Определите эффективный радиус атома алюминия, если плотность данного металла равна 2,70 г/см3.
158. Энергия связи в частице Н 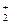 равна 256 кДж/моль. Рассчитайте длину волны света, достаточную для разрыва связи в частице.
равна 256 кДж/моль. Рассчитайте длину волны света, достаточную для разрыва связи в частице.
159. Плотности металлов бария и ванадия соответственно равны 3,5 и 6,11 г/см3. Определите эффективные радиусы атомов металлов в их кристаллических решетках, сделайте вывод о прочности связей и устойчивости к нагреванию данных кристаллов.
160. Энергия связи в молекуле Н2 равна 436 кДж/моль. Можно ли разложить данное вещество на атомы при облучении светом с длиной волны 2,5×10–8 м?
161. Длина связи С – С равна 0,154 нм, а связи S – S равна 0,192 нм. Вычислите длины связей H – S в H2S и C – H в CH4, если длина связи Н – Н составляет 0,074 нм.
162. Энергия диссоциации HI равна 298,4 кДж/моль. Какую энергию следует затратить, чтобы разложить на атомы 5 мг данного вещества?
163. Эффективный радиус атома золота в его кристаллической решетке равен 0,257 нм. Вычислите плотность данного металла.
164. Расположите в порядке возрастания прочности связи молекулы Cl2, I2 и Н2. Ответ объясните.
165. Рассчитайте эффективный радиус иона натрия в кристалле NaF, если константа решетки NaF равна 0,231 нм, а радиус иона
F– равен 0,133 нм.
166. Межъядерные расстояния в молекулах I2 и Cl2 соответственно равны 2,7 · 10 –10 м и 2,0 · 10 –10 м. Рассчитайте длину связи в молекуле IСl.
167. Как изменяется длина и энергия связи в ряду соединений LiF, BeF2, BF3, CF4, F2? Ответ объясните, используя данные об ЭО элементов.
168. Длины связи в молекулах HF, HCl, HBr и HI соответственно равны (в нм): 0,092; 0,128; 0,142 и 0,162. Укажите характер изменения энергии связи в данном ряду молекул. Какая из кислот наиболее сильная и почему?
169. Ковалентный радиус атома брома равен 0,114 нм, а атома водорода – 0,030 нм. Рассчитайте межъядерные расстояния в молекулах Br2 и HBr. Сделайте вывод о том, какая из молекул является более прочной.
170. Энергия связи в молекуле Н2 равна 436 кДж/моль, а в частице Н2+ – 256 кДж/моль. Сравните длину связи, ответ объясните. Определите, сколько молекул Н2 можно разложить на атомы, затратив 50 кДж энергии?
171. Сколько неспаренных электронов имеют атомы хлора и серы в нормальном и возбужденном состояниях? Распределите эти электроны по квантовым ячейкам. Чему равна валентность хлора и серы, обусловленная неспаренными электронами?
172. Вычислите разность электроотрицательностей атомов в соединениях HF, HI, РН3, СО, СS2, СаСl2, МgCl2 и определите тип связи.
173. Определите молекулу, в которой доля ионной связи максимальна: KCl, GeCl4, GaCl3, CaCl2. Ответ мотивируйте.
174. В каком из хлоридов доля ковалентной связи максимальна: TiCl4, ZrCl4? Объясните почему?
175. В каком из хлоридов доля ковалентной связи максимальна: HfCl4, MnCl4? Объясните почему?
176. С учетом одного из важнейших свойств ковалентной связи (насыщаемости) предложите доводы, согласно которым существуют молекулы Н2 и F2, но не образуются Н3, Н4, Н5 и F3, F4, F5.
177. H2S при обычной температуре – газ, а вода – жидкость. Чем можно объяснить это различие в физических свойствах?
178. Объясните, какое из веществ имеет более высокую температуру кипения: Н2О; HCl; НF?
179. Температуры кипения ВF3, BCl3, BBr3 и BI3 соответственно равны 172, 286, 364, 483 К. Объясните причину наблюдаемой закономерности.
180. Какое влияние оказывает водородная связь на свойства аммиака, фтороводорода и воды? Объясните, почему лёд легче жидкой воды.
Дата: 2019-02-02, просмотров: 540.