181. Вычислите изменение внутренней энергии при испарении 90 г воды при 100 °С, если на испарение 1 моль воды расходуется 40,7 кДж тепла. Пар считать идеальным газом, а объемом жидкой воды пренебречь.
182. Определите изменение внутренней энергии при испарении 50 г толуола при 30 °С, если на испарение 1 г толуола расходуется 348 Дж тепла. Пары толуола считать идеальным газом, а объемом жидкого толуола пренебречь.
183. Определите DU для реакции взаимодействия водорода и кислорода с образованием жидкой воды при стандартных условиях.
184. Растворение 1 моль цинка в разбавленной серной кислоте при 293 К сопровождается выделением 143,1 кДж тепла. Одновременно выделяется 1 моль водорода, причем против сил внешнего давления совершается работа. Определите изменение внутренней энергии. Объемом конденсированных фаз пренебречь.
185. Рассчитайте DU при испарении 1 кг воды при 423 К, если теплота, затрачиваемая на испарение 1 кг воды, равна 2110 кДж. Пар считать идеальным газом, а объемом жидкости пренебречь.
186. При температуре 300 К определите разность между значениями DH и DU для реакции образования метана из простых веществ.
187. Протекание реакции Agт + ½ Cl2, г = AgClт при давлении 1 атм и температуре 298 К сопровождается тепловым эффектом DН = = –126,7 кДж. Какое количество тепла выделится при изохорном протекании данной реакции при 298 К?
188. При растворении 10 г хлорида аммония в 243 г воды температура понизилась на 2,8 °C. Определите тепловой эффект растворения соли (в кДж/моль), если удельная теплоёмкость раствора составляет 4,18 Дж/(г·град).
189. Теплота сгорания углеводов и белков в организме человека составляет 4,1 ккал/г, жиров – 9,3 ккал/г. Среднесуточная потребность в белках, жирах и углеводах для студента составляет соответственно 113, 106 и 451 г. Рассчитайте суточную энергетическую потребность среднестатистического студента (в кДж).
190. В 100 г трески в среднем содержится 11,6 г белков и 0,3 г жиров. Рассчитайте (в кДж и ккал) энергию, которая выделится при усвоении порции трески массой 228 г. Калорийность белков составляет 17,1 кДж/г, жиров – 38,8 кДж/г.
191. Рассчитайте массу углеводов, необходимую для восполнения энергии, затраченной при выделении 800 г воды через кожу, если для испарения 1 моль воды через кожу требуется 44 кДж, а энергетическая ценность углеводов равна 4,1 ккал/г.
192. Вычислите теплоту сгорания газа (в кДж/моль), содержащего 60 % об. Н2 и 40 % об. СН4, если стандартные энтальпии сгорания водорода и метана равны –286 кДж/моль и –890 кДж/моль соответственно.
193. Восстановление оксида железа (III) водородом до свободного металла по уравнению Fe2O3(к)+ 3Н2(г) = 2Fe(к) + 3Н2О(г) сопровождается поглощением 96,2 кДж теплоты. Какое количество теплоты поглотится при взаимодействии 160 г Fe2O3 с 33,6 л Н2 (н. у.)?
194. По термохимическому уравнению рассчитайте стандартную энтальпию образования исходного вещества:
2КСlO3(к) → 2КСl(к) + 3О2(г); 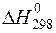 = – 75,4 кДж.
= – 75,4 кДж.
195. Для реакции 2NO + O2 → 2NO2 рассчитайте стандартные тепловые эффекты при постоянном давлении и постоянном объёме.
196. Стандартные энтальпии сгорания ацетилена и газообразного бензола равны соответственно –1300 и –3302 кДж/моль. Рассчитайте стандартную энтальпию реакции циклизации ацетилена.
197. Обычный кусочек сахара имеет массу 1,5 г. Определите тепловой эффект реакции его сгорания с образованием жидкой воды? На какую высоту можно подняться человеку массой 75 кг, если он съест 1,5 г сахара? Принять, что в полезную работу можно обратить 25 % энтальпии реакции.
198. Содержание углерода в различных сортах каменного угля колеблется от 60 до 95 % мас. В топочных газах обычно содержится10–15 % объем. СО2, 1–5 % объем. СО, остальное – азот и кислород. Вычислите теплоту сгорания 1 кг каменного угля, исходя из стандартных теплот образования СО2 и СО, если массовая доля углерода в каменном угле равна 0,84, а топочный газ содержит 13 % объем. СО2 и 1 % объем. СО.
199. Вычислите количество теплоты, которое выделится при восстановлении Fe2O3 металлическим алюминием, если было получено 335,1 г железа.
200. Сколько теплоты потребуется на разложение 200 г Na2CO3 до оксида натрия и диоксида углерода, если энтальпии реакций равны:
Na2CO3 + SiO2 = Na2SiO3 + СО2 ; DН 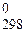 = 819,29 кДж;
= 819,29 кДж;
Na2O + SiO2 = Na2SiO3; DН 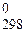 = –243,5кДж .
= –243,5кДж .
201. При сгорании 9,3 г фосфора выделяется 229,5 кДж теплоты. Вычислите DН 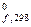 (Р2О5) .
(Р2О5) .
202. Сколько теплоты выделится или поглотится при превращении 1 кг красного фосфора в черный, если DН 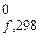 (Ркрасн) =
(Ркрасн) =
= –18,41 кДж/моль, а DН 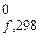 (Рчерн) = –43,2 кДж/моль?
(Рчерн) = –43,2 кДж/моль?
203. Вычислите тепловой эффект реакции восстановления оксида железа (II) водородом, исходя из следующих термохимических уравнений:
1) FeO(кр) + СО(г) = Fe(кр) + СО2(г) , 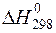 = – 13,18 кДж;
= – 13,18 кДж;
2) СО(г) + 1/2О2(г) = СО2(г) , 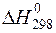 = – 283,0 кДж;
= – 283,0 кДж;
3) Н2(г) + 1/2О2(г) = Н2О(г) , 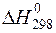 = – 241,83 кДж .
= – 241,83 кДж .
204. Определите стандартную энтальпию образования карбида вольфрама (WC) на основании следующих термохимических уравнений:
WC + 2,5O2 = WO3 + CO2DH1 = –1196,59 кДж;
C + O2 = CO2, DH2 = –397,77 кДж;
W + 1,5O2 = WO3, DH3 = –838,03 кДж.
205. Вычислите теплоту сгорания 1 кг каменного угля, исходя из стандартных теплот образования СО2 и СО, если массовая доля углерода в каменном угле равна 0,6, а топочный газ содержит 12 % объем. СО2 и 3 % объем. СО.
206. Пользуясь справочными данными, рассчитайте DН 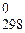 реакции Fe2O3 + 3CO = 2Fe + 3CO2 .
реакции Fe2O3 + 3CO = 2Fe + 3CO2 .
207. На основании представленных ниже термохимических уравнений определите тепловой эффект реакции
CaCO3 + CO2 + H2O = Ca(HCO3)2:
1) CaO + H2O = Ca(OH)2 ; 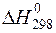 = –65,3 кДж
= –65,3 кДж
2) CaO + CO2= CaCO3; 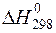 = –174,5 кДж
= –174,5 кДж
3) Ca(OH)2 + 2CO2 = Ca(HCO3)2; 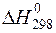 = –128,0 кДж.
= –128,0 кДж.
208. На основании представленных ниже термохимических уравнений определите тепловой эффект реакции
CuO + H2 = Cu + H2O:
1) CuO + CO = Cu + CO2 ; 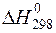 = –121 кДж;
= –121 кДж;
2) 2CO + O2= 2CO2; 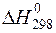 = –566 кДж;
= –566 кДж;
3) 2H2 + O2 = 2H2O; 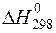 = –484 кДж.
= –484 кДж.
209. Определите работу расширения 100 г азота, находящегося при температуре 273 К, в процессе его изобарического расширения до двукратного объема.
210. Какая работа будет совершена 1 кг СО2 при повышении его температуры от 273 К до 373 К при постоянном давлении?
ВТОРОЙ ЗАКОН ТЕРМОДИНАМИКИ.
Дата: 2019-02-02, просмотров: 508.