ХИМИЯ
Контрольные задания для студентов
Заочной формы обучения
Часть 1
Учебно-методическое пособие
Череповец
2018
Рассмотрено на заседании кафедры химических технологий, протокол № 1 от 30.08.08.
Составители: О.А. Калько, канд. техн. наук, доцент;
Ю.С. Кузнецова, старший преподаватель
Рецензенты: В.В. Ермилов, канд. техн. наук, доцент (ЧГУ);
К.В. Аксенчик, канд. техн. наук, доцент (ЧГУ)
Научный редактор: А.В. Артамонов, канд. техн. наук, доцент (ЧГУ)
© Калько О.А., Кузнецова Ю.С., 2018
 © ФГБОУ ВО «Череповецкий
© ФГБОУ ВО «Череповецкий
государстнный университет», 2018
Содержание
Введение................................................................................................... 4
Требования к оформлению контрольной работы ................................... 4
Номенклатура, классификация и свойства неорганических соединений. 5
Основные количественные расчеты........................................................... 8
Газовые законы........................................................................................ 11
Эквивалент. Закон эквивалентов............................................................. 14
Строение атома и периодическая система элементов............................ 17
Химическая связь..................................................................................... 20
Первый закон термодинамики. Термохимия......................................... 22
Второй закон термодинамики. Направление химических реакций....... 26
Химическая кинетика и катализ.............................................................. 29
Химическое равновесие.......................................................................... 33
Литература............................................................................................... 38
Приложения............................................................................................. 39
ВВЕДЕНИЕ
Данное учебно-методическое пособие содержит формулировки заданий для выполнения домашней семестровой контрольной работы № 1 и охватывает следующие разделы дисциплины «Химия»: номенклатура, классификация и свойства неорганических соединений; основные законы химии; эквивалент, закон эквивалентов; строение атома и Периодическая система элементов; химическая связь и строение молекул; энергетика химических процессов; химическая кинетика и химическое равновесие, каталитические системы. В него также включены приложения, содержащие всю необходимую справочную информацию.
Пособие предназначено для студентов инженерно-технических направлений подготовки заочной формы обучения. Пособие также может использоваться преподавателями при составлении контрольно-измерительных материалов рейтинговой системы обучения студентов дневной формы обучения.
ТРЕБОВАНИЯ К ОФОРМЛЕНИЮ КОНТРОЛЬНОЙ РАБОТЫ
Контрольную работу по дисциплине «Химия» следует оформить в тетради (18 листов, клетка). На обложку тетради необходимо наклеить заполненный титульный лист. Номер варианта выбирается по двум последним цифрам шифра зачетной книжки (или студенческого билета)! Перечень задач, подлежащих решению по вашему варианту, выбирайте согласно таблице «Варианты контрольных заданий», которая расположена в конце данного учебно-методического пособия. Формулировку задачи обязательно перепишите в тетрадь.
Важно: задачи в Вашей тетради должны иметь тот же номер и следовать в том же порядке, что и в таблице «Варианты контрольных заданий». Менять задачи местами или изменять нумерацию категорически запрещено!
При выполнении контрольной работы № 1 рекомендуется пользоваться методическими пособиями:
1. Калько О.А. и др. Примеры решения задач по дисциплине «Общая и неорганическая химия». Ч. 1. Череповец: ЧГУ, 2005.
2. Калько О.А. и др. Примеры решения задач по дисциплине «Общая и неорганическая химия». Ч. 2. Череповец: ЧГУ, 2006.
Все методические указания можно получить в библиотеке ЧГУ или в электронном виде на кафедре химических технологий (пр. Победы 12, а. 426).
Важно: готовую контрольную работу следует сдать за 20 рабочих дней до начала сессии (примерная дата: до 10 декабря текущего учебного года) на кафедру химических технологий ФГБОУ ВО ЧГУ с обязательной регистрацией в журнале.
Помните: контрольная работа – это одна из важных составляющих Вашего допуска до экзамена (зачета). Студенты, не выполнившие контрольную работу по дисциплине «Химия», не будут допущены до экзамена (зачета).
ГАЗОВЫЕ ЗАКОНЫ ХИМИИ
61. В доменном производстве часть кокса заменяют коксовым или природным газом. Определите парциальные давления составных частей природного газа, содержащего (% объем.): СН4 – 60; С2Н6 – 36;
N2 – 4. Общее давление газа принять равным 920 мм рт. ст.
62. Для сжигания 1 кг углерода в горне доменной печи требуется 4,35 м3 сухого воздуха, взятого при н.у. Какой объем занимает этот воздух при входе в горн, если он подается через фурмы, нагретые до 1092 °С под давлением 2,5 атм?
63. При получении некоторых металлов применяют хлорирование природных руд. Используемый при этом процессе хлор хранят в баллонах вместимостью 164,2 л. При температуре 27 °С давление в баллоне составляет 150 атм. Определите объем хлора при нормальных условиях. Выше какой температуры нельзя хранить баллон с хлором, если предельное давление, которое выдерживает баллон, равно 200 атм?
64. В металлургии многие процессы проводят в атмосфере инертного газа. В баллоне вместимостью 6 м3 находится аргон при температуре 22 °С и давлении 180 атм. Вычислите, каким объемом аргона, заключенным в каждом баллоне, будет располагать цех в производственных условиях при температуре 962 °С и давлении 1,2 атм.
65. Резиновая пробка вылетает из заткнутой пробирки, если давление в ней превышает атмосферное в 1,7 раза. Пробирку заткнули пробкой при температуре 19,4 °С. До какой температуры следует нагреть воздух в пробирке, чтобы случился «ба-бах»?
66. Диоксид углерода, выделившийся в результате разложения карбоната кальция, при температуре 867,3 °С создает в объёме 54,8 мл давление 784,3 мм рт. ст. Приведите объём углекислого газа к нормальным условиям.
67. Масса 344 мл газа при 42 °С и давлении 772 мм рт. ст. равна 0,865 г. Вычислите молекулярную массу газа.
68. При некоторой температуре 5,6 дм3 газа находятся под давлением 900 мм рт. ст. Каким давлением будет обладать газ, если его объём изотермически увеличить до 7,2 л?
69. В баллоне вместимостью 40 л при давлении 800 мм рт. ст. находится 77 г диоксида углерода. Вычислите температуру газа.
70. Баллон вместимостью 20 л содержит 3 кг кислорода. Определите давление газа в баллоне при температуре 20 °С.
71. Вычислите, какой объём при нормальных условиях занимает газовая смесь, состоящая из 3,5 г азота, 640 г кислорода и 110 г углекислого газа?
72. Объёмные доли СО, СО2 и О2 в смеси, полученной после каталитического окисления монооксида углерода, составляют 0,005; 0,974 и 0,021 соответственно. Смесь газов выходит из аппарата под давлением 153 кПа. Определите парциальные давления газов.
73. Массовая доля железа в хлориде составляет 0,3446. При температуре 278 °С в объёме 75 мл находится 472,5 мг паров этого хлорида, которые создают давление 656,9 мм рт. ст. Определите формулу парообразного хлорида железа.
74. Масса газа объёмом 2 л равна 4,43 г. Газ находится при температуре 91 °С и давлении 166,2 кПа. Вычислите относительную плотность этого газа по кислороду и по азоту.
75. Для демонстрации горения фосфора чистым сухим кислородом заполнили цилиндр объёмом 148 мл. Атмосферное давление при этом составило 738 мм рт. ст., температура в комнате 18,7 °С. Найдите число моль кислорода в цилиндре.
76. Смесь метана с этаном имеет плотность по водороду 13,25. Определите объёмную долю каждого газа в смеси.
77. Пары хлороформа объёмом 350 мл при 91 °С и давлении 96,91 кПа имеют массу 1,34 г. Определите молекулярную массу хлороформа.
78. При некоторой температуре в сосуде вместимостью 10 л приготовили газовую смесь из метана объемом 2 л, находившегося под давлением 90 кПа, азота объёмом 4 л, находящегося под давлением 72 кПа, и кислорода объёмом 8 л, находившегося под давлением 120 кПа. Определите парциальное давление газов в смеси и общее давление газовой смеси.
79. При 0 °С в сосуде вместимостью 20 л содержится водород массой 20 г и оксид углерода (II) массой 56 г. Определите парциальное давление газов в смеси.
80. При 20 °С давление газа в замкнутом сосуде 87,2 кПа. Каким станет давление данного газа в сосуде, если его нагреть на 15 °С?
81. Газообразное вещество занимает объем 170 л при температуре 25 °С и давлении 90,8 кПа. Какой объем займет это вещество при нормальных условиях?
82. Стальной баллон наполнен кислородом под давлением 17 мПа при температуре 22 °С. Предельное давление, которое выдерживает баллон, равно 23 мПа. Какова максимальная температура, до которой можно нагреть баллон?
83. Вычислите массу газовой смеси объёмом 10 л, состоящей из оксида углерода (IV), кислорода и азота при 25 °С и давлении 97 кПа. Объёмные доли газов равны соответственно 40, 12 и 48 %.
84. При 20 °С смешаны этан объёмом 10 л, этилен объемом 30 л и ацетилен объёмом 40 л. Вычислите объёмные доли, массовые доли газов в смеси. Каковы их парциальные давления, если общее давление смеси равно 105 Па?
85. В сосуде вместимостью 8 л смешаны гелий объёмом 2 л и аргон объёмом 4 л, взятые при общем давлении 101,3 кПа. Определите парциальное давление газов в смеси.
86. При температуре 25 °С смешаны неон объёмом 5 л, хлор объёмом 8 л, оксид азота (I) объёмом 10 л. До смешения давление неона, хлора и оксида азота (I) составляло соответственно 86, 110 и 112 кПа. Вместимость сосуда со смесью составляет 11 л. Определите парциальное давление каждого газа в смеси и общее давление газовой смеси.
87. Масса газа объёмом 2 л равна 4,43 г. Газ находится при температуре 91 °С и давлении 166,2 кПа. Вычислите относительную плотность этого газа по кислороду и по азоту.
88. Стальной баллон вместимостью 20,5 л наполнен кислородом. При температуре 17 °С давление в баллоне равно 8821 кПа. Определите массу кислорода в баллоне.
89. Вычислите относительную молекулярную массу газа, если масса его объёмом 123 мл при температуре 25 °С и давлении 101,325 кПа равна 0,085 г.
90. Имеется газовая смесь, состоящая из водорода с массовой долей 40 % и оксида углерода (IV) с массовой долей 60 %. Определите объёмные доли газов в смеси, считая условия нормальными.
ВТОРОЙ ЗАКОН ТЕРМОДИНАМИКИ.
ХИМИЧЕСКОЕ РАВНОВЕСИЕ
271. В замкнутом объёме смешаны NO и О2. Константа равновесия для реакции: 2NO + O2 = 2NO2 равна 2,2. После установления равновесия концентрация монооксида азота равна 0,02 моль/л, а диоксида азота – 0,03 моль/л. Определите исходную концентрацию кислорода.
272. В сосуд объёмом 0,1 м3 введено 10 г водорода и 84 г азота. К моменту достижения равновесия в системе образовалось 34 г аммиака. Определите константу равновесия реакции.
273. Вычислите константу равновесия реакции
СО + Сl2 = СОСl2,
если исходные концентрации [СО] = 6 моль/л; [Cl2] = = 8 моль/л, а равновесие установилось, когда образовалось 3 моль/л СОСl2.
274. Для реакции Н2 + I2 = 2НI константа равновесия равна 36, а исходные концентрации Н2 и I2 одинаковые и равны 0,02 моль/л. Вычислите равновесные концентрации Н2, I2 и HI.
275. Вычислите константу равновесия обратимой реакции: СО2(г) + Н2(г) = СО(г) + Н2О(г), если при равновесии концентрации всех веществ оказались следующими (моль/л): [СО2] = 0,02; [Н2] = 0,005; [СО] = 0,015; [Н2О] = 0,015.
276. Реакция СО + Сl2 = СОСl2 протекает в объёме, равном 10 л. Состав равновесной смеси: 14 г СО, 35,5 г Сl2 и 49,5 г СОСl2. Вычислите константу равновесия данной реакции.
277. При некоторой температуре в системе
2NO2(г) = 2NO(г) + O2(г)
равновесная концентрация О2 составила 0,2 моль/л. Константа равновесия равна 12,8. Определите начальную концентрацию реагента.
278. Гетерогенная реакция С(графит) + СО2 (г) = 2 СО (г) определяет ход всех процессов карботермического получения металлов из оксидов. Рассчитайте константу равновесия Kр при общем давлении 0,1атм, если мольная доля СО в равновесной газовой смеси равна 0,52.
279. В реакторе объёмом 0,5 л протекает реакция
СН4(г) + Н2О(г) = СО(г) + 3Н2(г) .
Определите константу равновесия, если в начальный момент имелось 0,05 моль СН4 и 0,04 моль Н2О, а к моменту равновесия прореагировало 50 % начального количества метана.
280. При получении металлического магния электролизом расплавов, содержащих хлористый магний, протекает побочный процесс взаимодействия хлорида магния с кислородом воздуха
2MgCl2(т) + О2(г) = 2МgO(т) + 2Сl2(г).
Определите равновесные концентрации газообразных веществ для реакции, если константа равновесия K с = 1, а в начальный момент концентрации газов составляли: 0,9 моль/л для О2 и 0,2 моль/л для Cl2.
281. В гетерогенной химической системе при постоянных термодинамических параметрах установилось состояние равновесия. На основании закона действующих масс составьте выражения для констант равновесия реакций:
а) 2Mg(NO3)2(т) = 2МgO(т) + 4NO2(г) + О2(г);
б) 2Al(т) + 6Н2О(ж) = 3Н2(г) + 2Аl(OH)3(т);
в) FeO(кр) + СО(г) = Fe(кр) + СО2(г) .
282. Определите значения равновесных концентраций газообразных веществ для реакции Fe2O3(т) + 3СО(г) = 2Fe(т) + 3СО2(г), если константа равновесия K с = 0,125, а начальные концентрации газообразных веществ составляли 0,5 моль/л (СО) и 0,1 моль/л (СО2).
283. Закись железа FeO восстанавливается окисью углерода при 1000 °С и атмосферном давлении по реакции
FeO(т) + СО(г) = Fe(т) + СО2(г).
Определите состав равновесной газовой фазы, если Kр = 0,403, а исходная газовая смесь состояла из 20 % объем. СО и 80 % объем. СО2.
284. Выразите константу равновесия реакции СО2 + Ств« 2СО, используя константы равновесия реакций:
1) Ств + О2 « СО2, K1;
2) 2СО + О2 = 2СО2, K2.
285. Рассчитайте константу равновесия реакции восстановления твердого магнетита Fe3O4 водородом до вюстита FeO с образованием водяного пара, если равновесное давление водорода составило 39 мм рт. ст. при общем давлении в состоянии равновесия, равном 0,1 атм.
286. Константа равновесия реакции 4HCl + O2 « 2H2O+ 2Cl2 составляет 0,0562, а для реакции Н2О « Н2 + 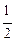 О2 она равна 2,5 × 10 –6. Вычислите константу равновесия реакции Н2 + Cl2« 2HCl.
О2 она равна 2,5 × 10 –6. Вычислите константу равновесия реакции Н2 + Cl2« 2HCl.
287. При постоянной температуре состояние равновесия реакции 2PbS(т) + 3О2(г) = 2PbO(т) + 2SO2(г) установилось при концентрации диоксида серы, равной 1,35 моль/л. Определите концентрацию О2 в некоторый момент протекания реакции, если концентрация SO2 в этот момент составляла 0,35 моль/л, а K с = 0,54.
288.В состоянии равновесия в системе А + В = 2D установились следующие концентрации: [А] = 0,4 моль/л; [В] = 0,2 моль/л; [D] = = 0,4 моль/л. Определите новые равновесные концентрации, если в систему дополнительно введено 0,3 моль/л вещества В. В какую сторону сместилось равновесие?
289. При некоторой температуре константа равновесия для реакции 2D(г) = А(г) + В(г) равна 5,0. До начала реакции исходная концентрация вещества D была равна 3,0 моль/л. После установления равновесия в систему добавили вещество А в количестве 1,0 моль/л. Определите равновесные концентрации до и после добавления вещества А.
290. В какую сторону сместится равновесие гомогенной газовой реакции А + 3В = 2С, если одновременно увеличить давление в системе в три раза и увеличить температуру на 20 градусов? Температурные коэффициенты прямой и обратной реакции соответственно равны 2 и 4. Каков знак изменения энтальпии для прямой реакции? Ответ подтвердите расчетами.
291. Химическое равновесие реакции СО2(г) + Н2(г) = СО(г) + + Н2О(г), протекающей при р, Т = const, установилось при следующих концентрациях реагирующих веществ (моль/л): [СО2] = 1; [Н2] = 1,5; [СО] = 2,25; [Н2О] = 2. Концентрация паров воды была увеличена до 2,5 моль/л. Рассчитайте новые равновесные концентрации реагирующих веществ.
292. При постоянной температуре состояние равновесия реакции FeO(т) + Н2(г) = Fe(т) + Н2О(г) устанавливается при концентрациях Н2 и Н2О, равных соответственно 0,47 и 2,24 моль/л. Затем концентрации увеличивают на 2,16 моль/л для Н2 и на 0,38 моль/л для Н2О, чем вызывают смещение равновесия. Рассчитайте новые равновесные концентрации газообразных веществ. В каком направлении смещается равновесие?
293. При постоянной температуре состояние равновесия реакции Fe2O3(т) + 3Н2(г) = 2Fe(т) + 3Н2О(г) установилось при концентрациях Н2 и Н2О соответственно 0,35 и 0,15 моль/л. После увеличения концентрации водорода на 1,5 моль/л произошло смещение равновесия. Рассчитайте новые значения равновесных концентраций газообразных веществ.
294. В металлургии цветных металлов реакциями, ведущими к получению металла, часто являются восстановление оксидов окисью углерода, водородом или углеродом. Вычислите равновесные парциальные давления газов при температуре 1000 К и общем давлении 1 атм для реакции
СоО(к) + СО(г) = Со(к) + СО2 (г),
если при 700 °С Kр = 42,7, а при 1100 °С Kр = 7,6.
295. При температуре 400 К константа равновесия реакции синтеза аммиака из азота и водорода равна 0,1 × 10-10 Па–2. Изменение энтальпии реакции равно –100 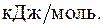 Вычислите константу равновесия данной реакции при 345 К.
Вычислите константу равновесия данной реакции при 345 К.
296. Вычислите DН реакции Feтв + Н2Огаз « FeОтв + Н2, если при температурах 1298 и 1173 К константы равновесия реакции равны 1,28 и 1,45 соответственно.
297. Какие меры следует предпринять для увеличения выхода монооксида углерода в обратимом процессе 2СО(г) « СО2(г) + С(т), если DН 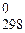 = –172,5 кДж/моль?
= –172,5 кДж/моль?
298. Константа равновесия Kр реакции С(т) + СО2 (г) = 2СО(г) при 1000 К равна 1,549 атм. Определите константу равновесия при температуре 1200 К, если среднее значение теплового эффекта реакции при постоянном давлении равно –172 кДж.
299. При какой температуре константа равновесия реакции СО + Н2Огаз = СО2 + Н2 будет равна 27,56, если при 1080 К константа равновесия Kр= 1, а изменение энтальпии реакции равно –9848 кал?
300. Для реакции MgCO3 (т) = MgO(т) + CO2 (г) равновесное парциальное давление СО2 при температурах 813 и 843 К равно 0,983 и 1,763 атм соответственно. Вычислите тепловой эффект реакции в данном интервале температур.
Литература
1. Задачи по общей и неорганической химии: Учеб. пособие для студентов высш. учеб. заведений / Р.А. Лидин, В.А. Молочко, Л.Л. Андреева; Под ред. Р.А. Лидина. М.: ВЛАДОС, 2004.
2. Задачи и упражнения по общей химии: Учеб. пособие / Б.И. Адамсон, О.Н. Гончарук, В.Н. Камышова и др.; Под ред. Н.В. Коровина. М.: Высш. шк., 2003.
3. Сборник задач и упражнений по общей химии: Учеб. пособие / С.А. Пузаков, В.А. Попоков, А.А. Филиппова. М.: Высш. шк., 2004.
4. Сборник задач и упражнений по общей химии: Учеб. пособие для нехим. спец. вузов / Л.М. Романцева, З.И. Лещинская, В.А. Суханова. 2-е изд., перераб. и доп. М.: Высш. шк., 1991.
5. Глинка Н.Л. Задачи и упражнения по общей химии: Учеб. пособие для вузов. М.: Интеграл-Пресс, 2001.
6. Литвинова Т.Н. Сборник задач по общей химии: Учеб. пособие для вузов. 3-е изд., перераб. М.: Оникс; Мир и Образование, 2007.
7. Задачник по общей химии для металлургов: Учеб. пособие для вузов / Под ред. Б.Г. Коршунова. М.: Высш. шк., 1977.
8. Михилев Л.А., Пасет Н.Ф., Федотова М.И. Задачи и упражнения по неорганической химии: Учеб. пособие для техникумов. СПб.: Химия, 1995.
9. Морачевский А.Г., Патров Б.В., Сладков И.Б. Сборник примеров и задач по физической химии. Л.: ЛПИ им. М.И.Калинина, 1974.
10. Курдюмов Г. М. 1234 вопроса по химии: Пособие для абитуриентов и студентов-первокурсников. М.: Мир, 2004. 192 с.
11. Свешникова Г.В. Основы химии в расчетах: Самоучитель решения расчетных химических задач. СПб: Химиздат, 2002. 240 с.
12. Семенов И. Н. Экспресс-учебник по решению химических задач. СПб: Химиздат, 2001. 128 с.
13. Волович П. М. Сборник задач по неорганической химии. М.: Рольф, 1999. 352 с. (Домашний репетитор).
14. Сборник задач и упражнений по общей и неорганической химии: пособие для вузов/Н. Н. Павлов, В. И. Фролов, С. В. Фролов и др.; под ред. Н. Н. Павлова. М.: Дрофа, 2005. 239, [1] с.
ПРИЛОЖЕНИЯ
П р и л о ж е н и е 1
Значения длины связи
| Связь | lА-А, нм | Связь | lА-А, нм | Связь | lА-А, нм |
| H–H | 0,074 | I–I | 0,267 | C–S | 0,182 |
| C–C | 0,154 | H–S | 0,133 | N–H | 0,101 |
| C=C | 0,133 | H–O | 0,096 | H–F | 0,092 |
| CºC | 0,120 | C–H | 0,109 | H–Cl | 0,127 |
| NºN | 0,109 | C–F | 0,140 | H–Br | 0,141 |
| O–O | 0,121 | C–Cl | 0,177 | H–I | 0,161 |
| F–F | 0,142 | C–Br | 0,191 | N–O | 0,137 |
| S–S | 0,192 | C–I | 0,212 | N=O | 0,122 |
| Cl–Cl | 0,199 | C–O | 0,143 | S–O | 0,143 |
| Br–Br | 0,228 | C=O | 0,121 | ||
П р и л о ж е н и е 3
ХИМИЯ
Контрольные задания для студентов
Заочной формы обучения
Часть 1
Учебно-методическое пособие
Череповец
2018
Рассмотрено на заседании кафедры химических технологий, протокол № 1 от 30.08.08.
Составители: О.А. Калько, канд. техн. наук, доцент;
Ю.С. Кузнецова, старший преподаватель
Рецензенты: В.В. Ермилов, канд. техн. наук, доцент (ЧГУ);
К.В. Аксенчик, канд. техн. наук, доцент (ЧГУ)
Научный редактор: А.В. Артамонов, канд. техн. наук, доцент (ЧГУ)
© Калько О.А., Кузнецова Ю.С., 2018
 © ФГБОУ ВО «Череповецкий
© ФГБОУ ВО «Череповецкий
государстнный университет», 2018
Содержание
Введение................................................................................................... 4
Требования к оформлению контрольной работы ................................... 4
Номенклатура, классификация и свойства неорганических соединений. 5
Основные количественные расчеты........................................................... 8
Газовые законы........................................................................................ 11
Эквивалент. Закон эквивалентов............................................................. 14
Строение атома и периодическая система элементов............................ 17
Химическая связь..................................................................................... 20
Первый закон термодинамики. Термохимия......................................... 22
Второй закон термодинамики. Направление химических реакций....... 26
Химическая кинетика и катализ.............................................................. 29
Химическое равновесие.......................................................................... 33
Литература............................................................................................... 38
Приложения............................................................................................. 39
ВВЕДЕНИЕ
Данное учебно-методическое пособие содержит формулировки заданий для выполнения домашней семестровой контрольной работы № 1 и охватывает следующие разделы дисциплины «Химия»: номенклатура, классификация и свойства неорганических соединений; основные законы химии; эквивалент, закон эквивалентов; строение атома и Периодическая система элементов; химическая связь и строение молекул; энергетика химических процессов; химическая кинетика и химическое равновесие, каталитические системы. В него также включены приложения, содержащие всю необходимую справочную информацию.
Пособие предназначено для студентов инженерно-технических направлений подготовки заочной формы обучения. Пособие также может использоваться преподавателями при составлении контрольно-измерительных материалов рейтинговой системы обучения студентов дневной формы обучения.
ТРЕБОВАНИЯ К ОФОРМЛЕНИЮ КОНТРОЛЬНОЙ РАБОТЫ
Контрольную работу по дисциплине «Химия» следует оформить в тетради (18 листов, клетка). На обложку тетради необходимо наклеить заполненный титульный лист. Номер варианта выбирается по двум последним цифрам шифра зачетной книжки (или студенческого билета)! Перечень задач, подлежащих решению по вашему варианту, выбирайте согласно таблице «Варианты контрольных заданий», которая расположена в конце данного учебно-методического пособия. Формулировку задачи обязательно перепишите в тетрадь.
Важно: задачи в Вашей тетради должны иметь тот же номер и следовать в том же порядке, что и в таблице «Варианты контрольных заданий». Менять задачи местами или изменять нумерацию категорически запрещено!
При выполнении контрольной работы № 1 рекомендуется пользоваться методическими пособиями:
1. Калько О.А. и др. Примеры решения задач по дисциплине «Общая и неорганическая химия». Ч. 1. Череповец: ЧГУ, 2005.
2. Калько О.А. и др. Примеры решения задач по дисциплине «Общая и неорганическая химия». Ч. 2. Череповец: ЧГУ, 2006.
Все методические указания можно получить в библиотеке ЧГУ или в электронном виде на кафедре химических технологий (пр. Победы 12, а. 426).
Важно: готовую контрольную работу следует сдать за 20 рабочих дней до начала сессии (примерная дата: до 10 декабря текущего учебного года) на кафедру химических технологий ФГБОУ ВО ЧГУ с обязательной регистрацией в журнале.
Помните: контрольная работа – это одна из важных составляющих Вашего допуска до экзамена (зачета). Студенты, не выполнившие контрольную работу по дисциплине «Химия», не будут допущены до экзамена (зачета).
НОМЕНКЛАТУРА, КЛАССИФИКАЦИЯ И СВОЙСТВА НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
1. Составьте уравнение реакции взаимодействия 1 моль оксида фосфора (V) с водой с образованием ортофосфорной кислоты и укажите в ответе число молей воды, участвующих в этой реакции.
2. Составьте уравнение реакции взаимодействия оксида азота (IV) с раствором гидроксида натрия и укажите в ответе сумму коэффициентов правой части уравнения.
3. Какой оксид образуется при дегидратации хромовой кислоты? Приведите в ответе значение его относительной молекулярной массы.
4. Какой оксид серы при взаимодействии с водой образует сильную кислоту? Укажите в ответе значение относительной молекулярной массы этого оксида?
5. Сколько оксидов образует железо? Составьте их формулы и приведите в ответе значение относительной молекулярной массы оксида, в котором железо имеет низшую степень окисления.
6. Какой оксид хлора при взаимодействии с водой образует хлорноватистую кислоту? В ответе укажите число атомов кислорода в его молекуле.
7. Имеются криптон, оксид углерода (IV), оксид натрия, соляная кислота и оксид кремния (IV). Какие из этих веществ способны реагировать между собой? Составьте уравнения таких реакций, указав в ответе их число.
8. С какими из перечисленных веществ будет реагировать: сажа: хлор, кислород, азот, кальций, оксид углерода (IV), оксид меди, оксид кальция, гидроксид натрия, серная кислота, соляная кислота, вода? Напишите уравнения реакций, укажите условия их протекания.
9. С какими из перечисленных веществ будет реагировать оксид углерода (IV): хлор, кислород, азот, магний, оксид меди, оксид кальция, гидроксид натрия, серная кислота, соляная кислота. Напишите уравнения реакций, укажите условия протекания.
10. Речной песок, состоящий по большей части из оксида кремния (IV) (кремнезема), в воде не растворим. Предложите систему химических реакций, позволяющих перевести кремнезем в кремниевую кислоту.
11. Имеется три соли угольной кислоты. Первая растворяется как в кислотах, так и в щелочах, вторая получается при реакции первой с гидроксидом натрия. Третья не растворяется в щелочах, но растворяется в кислотах. Определите возможные формулы солей.
12. В условиях ограниченного пространства кислород для дыхания получают регенерацией его из выдыхаемого углекислого газа при взаимодействии последнего с пероксидом калия или натрия. Запишите уравнение этой реакции с учетом того, что, кроме кислорода, в ней образуется только соль соответствующего металла. Эта реакция идет только в присутствии воды. Дайте объяснение этому факту. Какую роль выполняет вода в данном случае?
13. С помощью какого одного реактива можно различить хлориды натрия, цинка и алюминия? Напишите уравнения происходящих реакций.
14. Предложите систему реакций, в результате которых можно получить перекись водорода.
15. На оксиды каких элементов распадается карбонат магния при нагревании? Напишите уравнение данной реакции и приведите в ответе значение относительной молекулярной массы оксида неметалла.
16. Какой гидроксид хрома можно растворить и в кислотах, и в щелочах? Напишите уравнения данных реакций. Приведите в ответе значение относительной молекулярной массы этого гидроксида.
17. Предложите формулу соли, при реакции которой как с кислотой, так и со щелочью выделяется газ. Напишите уравнения происходящих реакций.
18. Предложите формулу вещества, при разложении которого образуются три сложных вещества. Напишите уравнения происходящих реакций.
19. Предложите формулу соединения, при реакции которого как с растворами кислот, так и с растворами щелочей выпадает осадок. Напишите уравнения происходящих реакций.
20. Гидрокарбонат натрия используется в кулинарии как разрыхлитель. Какое химическое свойство при этом используется? Запишите уравнение реакции.
21. Какой оксид фосфора при взаимодействии с водой образует метафосфорную кислоту? Приведите в ответе значение степени окисления фосфора в этом оксиде.
22. Составьте и назовите формулу пятиосновной кислоты, которую образует йод в своей высшей степени окисления. В ответе укажите число атомов в анионе кислоты.
23. Напишите формулу трехосновной кислоты, которую образует ванадий в своей высшей степени окисления. Назовите эту кислоту. Сколько атомов кислорода в молекуле этой кислоты?
24. Какой оксид образуется при дегидратации сернистой кислоты? В ответе укажите название и значение относительной молекулярной массы этого оксида.
25. Какой гидроксид, образуемый элементом третьего периода, способен взаимодействовать с углекислым газом с образованием растворимой в воде средней соли? Составьте соответствующее уравнение реакции и приведите значение относительной молекулярной массы этого гидроксида.
26. Сколько элементов третьего периода образуют оксиды, дающие при взаимодействии с водой двухосновные кислоты? Приведите уравнения соответствующих реакций.
27. Имеются оксид азота (II), уксусная кислота, неон, оксид калия и гидроксид натрия. Какие из этих веществ реагируют между собой? Ответ выразите в виде числа возможных реакций, составив их уравнения.
28. Даны бромоводородная кислота, оксиды рубидия и хрома (III), медь и неон. Какие из этих веществ реагируют между собой? Укажите в ответе число таких реакций, составив их уравнения.
29. Имеются оксид азота (II), оксид кальция, гелий, оксид серы (VI) и оксид алюминия. Определите, какие из данных веществ способны реагировать между собой. Ответ выразите в виде числа возможных реакций, составив их уравнения.
30. Напишите уравнение реакции, протекающей между гидроксидом железа (II) и кислородом воздуха в присутствии воды. В ответе приведите коэффициент перед формулой гидроксида железа (II).
Дата: 2019-02-02, просмотров: 395.