211. Определите изменение энтропии (в Дж/(моль ∙ К) при плавлении 1 моль следующих металлов: натрия (Тпл = 98,8 °С), ртути (Тпл =
= –38,9 °С), серебра (Тпл = 960,5 °С), если теплоты плавления этих металлов (в ккал/моль) соответственно равны: 0,63; 0,555; 2,73.
212. Рассчитайте стандартную энтропию исходного вещества данной реакции (при необходимости используйте справочные данные приложений)
4Nа2SO3(т) = 3Nа2SO4(т) + Nа2S(т); 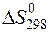 = –60 Дж/К.
= –60 Дж/К.
213. Для реакции 4FeO(т)+О2 (г) = 2Fe2O3(т) 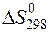 = –259 Дж / К. Определите стандартную энтропию триоксида железа (при необходимости используйте справочные данные приложений).
= –259 Дж / К. Определите стандартную энтропию триоксида железа (при необходимости используйте справочные данные приложений).
214. В каком направлении протекает реакция в изолированной системе С(графит) + СО2, (г) = 2СО(г) .
215. Теплота плавления нафталина С10Н8 равна 149 600 Дж/кг, а температура плавления 80,4 °С. Найдите изменение энтропии при плавлении 3,1 моль нафталина.
216. Изменение энтропии при плавлении 100 г меди равно 12,8 Дж/К. Вычислите мольную теплоту плавления меди, если температура плавления меди равна 1083 °С.
217. Удельная теплота плавления льда равна 33 480 Дж/кг. Определите изменение энтропии при плавлении 1 моль льда.
218. Вычислив 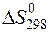 реакций, определите, какая из них протекает в прямом направлении в изолированной системе:
реакций, определите, какая из них протекает в прямом направлении в изолированной системе:
1) FeO + CO = Fe + CO2; 2) FeO + H2 = Fe + H2O(г) .
219. Рассчитайте изменение энтропии при испарении 250 г воды при 25 °С, если молярная теплота испарения воды при данной температуре равна 44,08 кДж/моль.
220. Известны две аллотропические модификации TiO2 – рутил и анатаз. Значения S 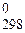 рутила и анатаза равны соответственно 50,33 и 49,92 Дж/(моль × К). Определите, в каком состоянии оксид титана (IV) имеет более неупорядоченную структуру. Ответ объясните.
рутила и анатаза равны соответственно 50,33 и 49,92 Дж/(моль × К). Определите, в каком состоянии оксид титана (IV) имеет более неупорядоченную структуру. Ответ объясните.
221. Значения S 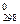 красного и желтого PbO равны соответственно 66,11 и 68,70 Дж/(моль × К). Укажите, какая модификация оксида свинца (II) обладает более упорядоченной кристаллической решеткой. Ответ объясните.
красного и желтого PbO равны соответственно 66,11 и 68,70 Дж/(моль × К). Укажите, какая модификация оксида свинца (II) обладает более упорядоченной кристаллической решеткой. Ответ объясните.
222.Не прибегая к расчетам укажите какой знак будет иметь DS 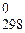 для реакции 2Н2О (г) + С (графит) = 2Н2 + СО2? Ответ поясните и сопоставьте вывод с результатами расчетов.
для реакции 2Н2О (г) + С (графит) = 2Н2 + СО2? Ответ поясните и сопоставьте вывод с результатами расчетов.
223. Вычислите DS 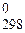 реакции разложения 0,5 кг нитрата аммония на простые вещества. В каком направлении протекает данная реакция в изолированной системе?
реакции разложения 0,5 кг нитрата аммония на простые вещества. В каком направлении протекает данная реакция в изолированной системе?
224. Укажите знак изменения энтропии при синтезе аммиака из N2 и H2. В каком направлении протекает данная реакция в изолированной системе?
225. Хром получают алюмотермическим способом по реакции
Cr2O3 + 2 Al = 2 Cr + Al2O3.
Определите возможность протекания данной реакции при 400 °С и 1500 °С. Как повлияло повышение температуры на термодинамическую вероятность протекания реакции в прямом направлении?
226. Определите направление самопроизвольного протекания реакции СO2 + 2H2 = С (графит) + 2H2O(г) при стандартных условиях. Ответ подтвердите расчетами.
227. Возможно ли получение цинка из оксида цинка (II) путем его восстановления графитом и при какой температуре?
228. Определите температуру равновероятного протекания некоторой реакции в прямом и обратном направлении, если DН = 38 кДж, а DS = 207 Дж / К.
229. Определите температуру равновероятного протекания реакции в прямом и обратном направлении, если DН = 138 кДж, а DS = = 105 Дж / К.
230. Можно ли при стандартных условиях восстановить водородом оксиды CuO и PbO? Ответ подтвердите расчетами.
231. Можно ли при стандартных условиях восстановить водородом оксиды ZnO и NiO? Ответ подтвердите расчетами.
232. Вычислите изменение DG реакции при 298 К
FeS + 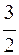 O2 = FeO + SО2.
O2 = FeO + SО2.
Действие какого фактора – энтальпийного или энтропийного – определяет знак DG данной реакции?
233. Определите стандартную энергию Гиббса реакции
СН4 + 2Н2О(г) = СО2 + 4Н2 при 298 К. Возможно ли самопроизвольное течение реакции в прямом направлении при данной температуре? При какой температуре направление протекания процесса изменится на обратное? Зависимостями 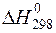 и
и 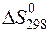 от температуры пренебречь.
от температуры пренебречь.
234. Установите, возможно ли при температуре 1000 К восстановление оксида железа (III) до свободного металла по уравнению Fe2O3(кр) + 3Н2(г) = 2Fe(кр) + 3Н2О(г). Зависимостями 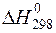 и
и 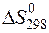 от температуры пренебречь.
от температуры пренебречь.
235. Рассчитайте стандартную энергию Гиббса химической реакции при 298 К и установите возможность её самопроизвольного протекания в прямом направлении
CuSO4(кр) + 2NH4ОН(ж) = Cu(ОН)2(кр) + (NH4)2SO4(кр).
236. Рассчитайте энтропийный и энтальпийный факторы при стандартных условиях для реакции 4НСl(г) + О2 = 2Н2О(г) + 2Сl2(г). Какой из рассчитанных факторов способствует самопроизвольному протеканию реакции в прямом направлении?
237. Рассчитайте температуру, при которой равновероятны оба направления протекания реакции 2SO2(г) + О2(г) = 2SO3(г).
238. Установите, как происходит восстановление водородом оксида меди (II) – до оксида меди (I) или до металла – при температуре 500 ºС. Ответ подтвердите расчетами.
239. Рассчитайте изменение энергии Гиббса при температуре 1230 К для реакции 2SO2(г) + О2(г) = 2SO3(г). Будет ли протекать реакция самопроизвольно в данных условиях?
240. По табличным данным вычислите 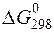 реакции разложения хлорида аммония на газообразные вещества: аммиак и хлороводород. В каком направлении протекает данная реакция при стандартных условиях?
реакции разложения хлорида аммония на газообразные вещества: аммиак и хлороводород. В каком направлении протекает данная реакция при стандартных условиях?
Дата: 2019-02-02, просмотров: 516.