1.Диоксид углерода (СО2), растворяясь в воде, частично вступает с ней во взаимодействие с образованием угольной кислоты Н2СО3.
Суммарную концентрацию СО2 и Н2СО3 принимают за концентрацию свободной угольной кислоты. Расчет содержания свободной углекислоты ведется на СО2 своб. (так как Н2СО2 = 1%). Концентрация свободной углекислоты в поверхностных водах определяется парциальным давлением диоксида углерода в атмосфере.
Концентрация свободной углекислоты:
- в поверхностных водах до 10-30 мг/л;
- в подземных водах до n∙ 100мг/л,
(с повышением t0 растворимость СО2 падает!).
2. Гидрокарбонаты (НСО 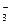 ) образуются: Н2СО3 ↔ Н+ + НСО
) образуются: Н2СО3 ↔ Н+ + НСО 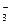 .
.
НСО 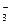 - поступают в воду в результате растворения карбонатных пород под действием СО2.
- поступают в воду в результате растворения карбонатных пород под действием СО2.
СаСО3 + СО2 + Н2О → Са (НСО3)2
Мg СО3 + СО2 + Н2О → Мg (НСО3)2
Гидрокарбонаты – наиболее распространенная форма содержание углекислоты в природных водах при средних значениях рН. Они обуславливают щелочность воды.
3. Карбонат – ионы (СО  ).
).
НСО3 - ↔ Н+ + СО 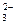 .
.
СО 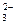 - содержаться только в щелочных водах (рН >8.4). В присутствии Са2+ содержание СО
- содержаться только в щелочных водах (рН >8.4). В присутствии Са2+ содержание СО 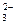 невелико, вследствие малой растворимость СаСО3. В присутствии СО2 растворимость СаСО3 увеличивается.
невелико, вследствие малой растворимость СаСО3. В присутствии СО2 растворимость СаСО3 увеличивается.
Содержание различных форм углекислоты в воде рассчитывают, исходя из констант диссоциации по 1-й и 2-й степени и ПР СаСО3.
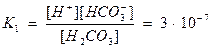
[H2CО3]- концентрация недиссоциированных молекул Н2СО3, СО2.

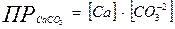
Содержание свободной углекислоты в воде при рН 5-8.3 вычисляют по формуле
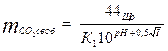 , где
, где
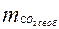 - содержание свободной углекислоты (мг/л).
- содержание свободной углекислоты (мг/л).
Що –общая щелочность воды (мг-экв/л).
I – ионная сила раствора.
В природных водах устанавливается динамическое равновесие
Н2О + СО2 ↔ Н2СО3 ↔ Н+ + НСО 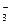 ↔ 2Н+ +СО
↔ 2Н+ +СО 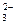 .
.
Одновременно все формы углекислоты присутствовать не могут. Устойчивыми системами являются следующие:
1. СО2+Н2О
2. СО2+НСО 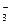
3. НСО 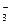
4. НСО 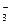 +СО
+СО 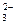
5. СО 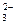 +ОН-
+ОН-
Основная карбонатная система:
Н2О + СО2 → Н2СО3 ↔ Н+ + НСО 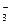 .
.
В природных водах рН зависит от соотношения различных форм углекислота:
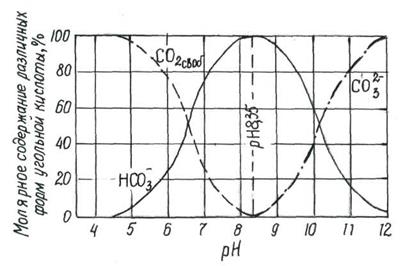
- при низких рН (рН<4,2) в воде присутствует только свободная угольная кислота,
- при повышении рН (4,2 до 8,3) в воде свободная углекислота и гидрокарбонаты;
- при рН =8,3 -8,4 в воде находятся только гидрокарбонаты (~98%);
- при рН > 8,4 – в воде появляются СО 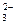 - в равновесии НСО
- в равновесии НСО 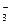 ;
;
- при рН > 12 СО 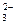 - преобладающая форма.
- преобладающая форма.
Существуют кривые по которым можно определить рН и углекислоту.
|
|
Рис.2 .Зависимость содержания различных форм угольной кислоты от рН.
Углекислота в форме карбонат – ионов называется связанной. Принято считать, что гидрокарбонаты состоят наполовину из связанной и полусвязаной угольной кислоты, так как при разложении дают карбонаты (связанную) и свободную углекислоту (полусвязаную).
2 НСО 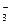 ↔ СО2 + СО
↔ СО2 + СО 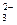 + Н2О.
+ Н2О.
Содержание полусвязаной угольной кислоты используется для вычисления концентрации агрессивной угольной кислоты в воде. Если в воде одновременно присутствуют свободная углекислота и гидрокарбонаты, то в состоянии равновесия определенному содержанию НСО 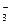 соответствует определенное содержание свободной углекислоты, которое называется равновесной углекислотой. Избыток свободной угольной кислоты над равновесной, растворяющей СаСО3, называется агрессивной углекислотой. Содержание равновесной угольной кислоты [СО2]р в состоянии равновесия рассчитывается по формуле:
соответствует определенное содержание свободной углекислоты, которое называется равновесной углекислотой. Избыток свободной угольной кислоты над равновесной, растворяющей СаСО3, называется агрессивной углекислотой. Содержание равновесной угольной кислоты [СО2]р в состоянии равновесия рассчитывается по формуле:
 , где
, где
γ / и γ// - коэффициенты активности соответственно ионов НСО 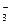 и Са2+;
и Са2+;
К1 и К2- константы диссоциации угольной кислоты по первой и второй ступеням.
[СО2]р – концентрация равновесной угольной кислоты мг/л.
Вода с одинаковым содержанием свободной углекислоты, но с различной концентрацией НСО 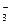 будут проявлять неодинаковую активность по отношению к карбонату кальция. Поэтому маломинерализованные воды, вследствие избытка свободной угольной кислоты, могут проявлять агрессивные свойства по отношению к бетону.
будут проявлять неодинаковую активность по отношению к карбонату кальция. Поэтому маломинерализованные воды, вследствие избытка свободной угольной кислоты, могут проявлять агрессивные свойства по отношению к бетону.
Стабильность воды
Воды, в которых соблюдается основное карбонатное равновесие, называются стабильными. Они не изменяют избыток свободной угольной кислоты над равновесной называются агрессивными. При контакте с бетоном или карбонатами такие воды вызывают растворение карбонатных составляющих.
СаСО3 + СО2 + Н2О ↔ СаНСО3
Са(ОН)2 + 2СО2 ↔ СаНСО3.
Воды, в которых имеется избыточное (над равновесным) содержание гидрокарбонатов, то есть повышенная щелочность, называются нестабильными. Для оценки агрессивных свойств воды сопоставляют количество свободной угольной кислоты, установленное анализом, с вычисленным по формуле:
 .
.
Определение агрессивной углекислоты проводится сопоставлением щелочности воды до и после контакта ее с карбонатом кальция,
СО2 + Н2О + СаСО3 → Са(НСО3)2
повышает щелочность
Стабильность воды оценивается по методу Ланжелье.
рНs = pK2 – pПР СаСО 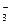 - lg [Ca2+] – lg Щ0 + 2,5
- lg [Ca2+] – lg Щ0 + 2,5 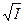 +7,6
+7,6
рНs - рН равновесного насыщения воды карбонатом кальция (то есть величина рН соответствующая равновесию свободной углекислоты с другими ее формами),
рК2 - отрицательный log. константы диссоциации 2 ступени угольной кислоты,
pПР СаСО 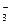 отрицательный log. ПР СаСО
отрицательный log. ПР СаСО 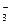
I – ионная сила раствора.
Характер свойств воды производится по «индексу насыщения» -Щ, который представляет собой разность между рН исследуемой воды и рНs:
Щ = рН иссл. - рНs
Если Щ – положительное (+), то рН иссл. > рНs. При этом вода будет нестабильной.
Если Щ – отрицательно (-), то рН иссл. < рНs , то есть вода имеет повышенную кислотность и является агрессивной.
Если рН иссл. = рНs , Щ =0, то вода стабильная. Стабильность характеризуется также показателем стабильности С (основным Сосн и вспомогательным Свсп).
Сосн = Щиссл / Щ нас ,
где Щиссл – исследуемой воды, Щ нас насыщенной карбонатом кальция.
Свсп =рНиссл / рНнас
Если С=1, то есть рНиссл =рНнас, то вода стабильна, при С<1 вода агрессивная.
Стабилизация воды, содержащей агрессивную углекислоту, производится веществами, вызывающими повышенную щелочность (известь, гидроксид и карбонат натрия).
NaOH + CO2 = NaHCO3
Ca(OH)2 + 2CO2 = Ca(HCO3)2
Na2CO3 + CO2 + H2O = 2NaHCO3
Обработка нестабильных вод заключается в обработке их кислотами.
NaHCO3 + HCl = NaCl + H2O + CO2
На некоторых очистных сооружениях используются мраморно – песчаные фильтры, которые позволяют получить не только осветленную, но и стабильную воду.
ПРИРОДНЫЕ ВОДЫ
Дата: 2019-02-02, просмотров: 349.