ПРЕДИСЛОВИЕ
В учебном пособии по химии воды затронуты теоретические вопросы курса, которые должны быть использованы при оценке качества природных вод и выборе способов и методов очистки сточных вод и доведения их до соответствующих кондиций. Затронутые вопросы помогут специалистам по водоснабжению и водоотведению оценить рациональность и эффективность методов водоподготовки.
Задачами данного курса являются:
- дать современные представления о физико-химических процессах, протекающих в природных и сточных водах;
- ознакомить с принципами анализа природных и сточных вод и использованием результатов анализа для оценки качества воды и для выбора методов ее очистки;
- изучение современных технологических методов обработки вод различного происхождения и назначения, способов их обеззараживания;
Данное пособие можно рассматривать как часть лекционного курса «Химия воды и микробиология», предусмотренного учебным планом специальности 270112 «Водоснабжение и водоотведение».
В пособие включены также тематические тесты по материалу курса и тесты для итогового контроля знаний студентов.
ВВЕДЕНИЕ
На всех стадиях развития человек был тесно связан с окружающим миром. Но с тех пор как появилось высокоиндустриальное общество, опасное вмешательство человека в природу резко увеличилось. В связи с научно-технической революцией и расширением сферы производства возникает потребность в потреблении больших объемов воды. Новые технологии диктуют жесткие требования к качеству воды, включаемой в технологические циклы. С другой стороны необходимость надежной защиты водоемов от загрязнения сточными водами промышленного происхождения диктует строгие нормы допустимого содержания примесей в этих водах. Разработка и внедрение в практику новых современных методов очистки природных и сточных вод, совершенствование методов контроля за качеством воды различного назначения увеличивает значимость подготовки специалистов по водоснабжению и диктует особые требования к преподаванию дисциплин химического профиля одной из которых является «Химия воды и микробиология».
Особого внимания заслуживает изучение физико-химических способов обработки сточных вод. При проведении в области очистки сточных вод промпредприятий необходимо исходить из предположения, что сброс в водоемы даже очищенных сточных вод допустим лишь в тех случаях, когда применение замкнутого цикла не может быть осуществлено.
Интересным и многообещающим является разработка способов химической обработки производственных стоков с использованием сырья и отходов производства данного предприятия или отходов других производств.
Все процессы водоподготовки, включая выбор источника водопользования, связаны с физико-химическими и микробиологическими исследованиями. Специалисты по водоснабжению, связанные с рациональным использованием водных ресурсов должны в совершенстве знать не только современные методы анализа природных и сточных вод, но и химические процессы, происходящие в природных и сточных водах. Это будет способствовать внедрению новых экономичных способов очистки, повышению эффективности и интенсификации применяемых методов; позволит сократить расход воды на технические нужды и возвратить в производство ценные отходы.
1. ВОДА (окись водорода) Н2О
Физические свойства воды
Чистая вода бесцветна, она не имеет ни запаха, ни вкуса. В более толстом слое вода кажется окрашенной в голубой цвет.
Температура, при которой жидкая и твердая фаза воды находятся в равновесии, то есть температура плавления, при 760 мм рт.ст. принята за 0 термометрической шкалы Цельсия. Температура кипения – 1000 той же шкалы. По отношению к воде даются определения других физических единиц.
Во многих отношениях вода является исключительной жидкостью. Температуры плавления и кипения воды, по сравнению с соответствующими температурами соединений водорода с соседними элементами в периодической таблице, необычайно высокие:
| СН4 | NH3 | H2O | HF | |
| Т пл., 0С | -184 | -78 | 0 | -83 |
| Т кип., 0С | -164 | -33 | +100 | +19,5 |
| SiH4 | PH3 | H2S | HCl | |
| Т пл., 0С | -185 | -133 | -85 | -115 |
| Т кип., 0С | -112 | -87 | -61 | -85 |
Плотность воды по мере повышения температуры не уменьшается постепенно, как у остальных жидкостей, а имеет при 4 0С максимальную величину. Выше этой температуры, что вполне нормально, плотность уменьшается; то же происходит и при охлаждении воды ниже 4 0С.
| Т, 0С | 0 | 4 | 10 | 15 | 20 |
| Р г/см3 | 0,999866 | 1,000 | 0,999727 | 0,999127 | 0,998230 |
При переходе в твердое состояние при 0 0С снова происходит изменение плотности. Плотность льда с температурой 0 0С равна 0,91, следовательно, его объем на 10% больше равного по весу объема воды той же температуры. Этим объясняется растрескивание сосудов, заполненных водой и попавших на мороз. При очень высоких давлениях (20 000 атм.) образуются другие формы льда, их объем меньше, чем объем жидкой воды.
Все эти аномалии физических свойств воды вызваны явлением ассоциации молекул воды.
Аномалии плотности воды имеют большое влияние на климат планеты и на жизнь животных и растений. Когда вода рек, озер и морей охлаждается ниже 4 0С, она становиться легче и не идет ко дну, а остается на поверхности, где и замерзает. Поэтому на большой глубине вода не замерзает и в ней сохраняется жизнь.
Если бы плотность льда была больше плотности воды, то по мере образования лед шёл бы ко дну, и океаны целиком замерзли, поскольку тепла, получаемого от солнца в теплое время, было бы недостаточно для их оттаивания.
Строение молекул воды
Молекула воды имеет форму треугольника (дипольный момент ≠ 0). Угол между прямыми соединяющими ядра водорода с ядром кислорода (валентный угол кислорода) = 105 0С. Расстояние О-Н в жидком и твердом состоянии равно 0,99 А.
Ассоциация молекул воды за счет водородных связей.
О … Н Н
/ \ \ /
Н Н … О
Изотопный состав воды
У водорода 3 изотопа 1Н (≈1); 2Н (D –дейтерий ≈2); 3Н (Т – тритий ≈3). Кислород имеет 3 изотопа с массовыми числами 16, 17, 18. Природная вода является смесью различных молекул. Вода состава Д216О, Д217О, Д218О – тяжелая вода; в состав которой входит Т – сверхтяжелая вода. Сверхтяжелая вода замерзает при 3,8 0С, кипит при 101,4 0С. Максимальная плотность при +11 0С. Растворимость в тяжелой воде ниже чем в обычной. Тяжелая вода оказывает тормозящее действие на жизненные процессы в растительных и живых организмах. Применяется в урановых котлах в качестве замедлителя ядерного распада.
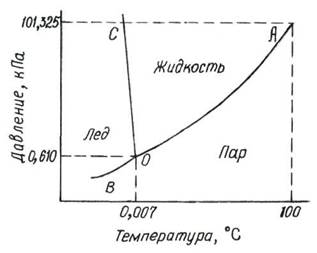
Диаграмма состояния воды
|
|
Диаграмма состояния представляет собой графическое изображение зависимости между различными величинами, характеризующими состояние системы. Для однокомпонентных систем обычно используют диаграммы состояния, показывающие зависимость между давлением и температурой (Р –Т).
Рис. 1. Диаграмма состояния воды.
Любой точке на диаграмме отвечают определенные значения температуры и давления. Диаграмма состоит из трех кривых, разграничивающих все возможные температуры и давления на 3 области, отвечающие льду, жидкости и пару.
Кривая ОА – называется кривой равновесия жидкость – пар или кривой кипения.
Точкам, лежащим на диаграмме состояния ниже или правее кривой ОА, отвечает область пара. Точкам, лежащим выше или левее кривой ОА отвечает область жидкого состояния.
Кривая ОС – кривая равновесия твердое состояние – жидкость, кривая плавления.
ОВ – кривая равновесия твердое состояние – пар – кривая сублимации.
Все три кривые пересекаются в точке О. Координаты этой точки – это единственная пара значений Т и р, при которых в равновесии могут находиться все три фазы: лед, жидкость и пар. Она носит название тройной точки.
Кривая ОА заканчивается в критической точке. При температуре отвечающей этой точке различие между жидким и парообразным состоянием исчезает. В точке О число степеней свободы (С):
С = К+2-Ф
С = 1+2-3 = 0,
то есть число степеней свободы = 0, то есть система инвариантна.
В точке К С =1+2-2=1, то есть система моновариантна.
В точке N С = 1+2-1=2, то есть система бивариантна, для нахождения этой точки необходимы две координаты температура и давление.
Растворимость газов
А) Газы, состоящие из полярных молекул, растворяются в воде лучше, чем неполярные соединения.
Б) В дистиллированной воде растворимость газов выше, чем в растворах электролитов. Растворимость газа зависит от концентрации электролита (формула Сеченова)
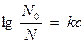
N0 – растворимость в чистой воде;
N – растворимость в электролите;
С – концентрация электролита;
к - постоянная, зависящая от природы газа, электролита и температуры.
Так, растворимость кислорода в воде с общим содержанием 40г/кг уменьшается на 25 %. Следовательно в соленых водах О2 меньше, чем в пресных.
В) Растворимость газов при повышении температуры падает. Уравнение Клапейрона – Клаузиуса:
 , где
, где
N1 и N2– растворимость при температурах Т1 и Т2;
Lисп - молярная теплота испарения;
R – универсальная газовая постоянная , равная Дж/моль ∙К.
Г) Зависимость растворимости от давления выражается законом Генри.
 , где
, где
С - концентрация растворенного газа;
р- давление газа над раствором;
к- коэффициент пропорциональности, зависящий от природы газа, растворитель и температура, но не зависящий от давления.
Если над раствором находится смесь газов, то растворимость каждого пропорциональна его парциальному давлению (закон Генри – Дальтона).
Свойства растворов
1. Закон Рауля (1887г.).
Относительное понижение давления насыщенного пара над раствором равно отношению числа молей растворенного вещества к сумме молей растворителя и растворенного вещества
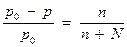
р0 – давление насыщенного пара чистого растворителя;
р- давление пара над раствором;
n – число молей растворенного вещества;
N - число молей растворителя.
Понижение давления насыщенного пара над раствором вызывает изменения температуры кипения и замерзания раствора по сравнению с чистым растворителем. Растворы кипят при более высокой температуре.
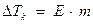 ,
,
∆Тк - повышение температуры кипения, 0С;
Е – эбуллиоскопическая константа растворителя (для воды равна 0,52 0С);
M – моляльная концентрация раствора.
Замерзают растворы при более низкой температуре, чем у чистого растворителя.
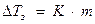 ,
,
К – криоскопическая константа (для Н2О К = 1,86 0С).
Поэтому морская вода замерзает при 19 0С.
Самопроизвольный переход молекул растворителя через полупроницаемую мембрану против градиента концентрации называется осмосом.
Гидростатическое давление, оказываемое молекулами растворителя на мембрану, называется осмотическим.
Величина осмотического давления для разбавленных растворов не зависит от химической природы растворителя и растворенного вещества, а определяется разностью концентраций растворов, разделенных мембраной. Чем больше эта разность, тем больше осмотическое давление.
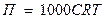 , где
, где
П – осмотическое давление, Па;
С- молярная концентрация моль/м3;
R - газовая постоянная = 8,31 Дж/моль∙К;
Т- термодинамическая температура раствора, К.
Вышеуказанные зависимости справедливы для растворов неэлектролитов, так как в электролитах (вследствие их диссоциации) присутствуют большее число частиц. Поэтому в вышеуказанные уравнения для электролитов вводится поправочный множитель (i) - изотонический коэффициент. Он рассчитывается по формуле
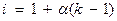 (для слабых электролитов)
(для слабых электролитов)
α – степень диссоциации;
κ – количество ионов образующихся при диссоциации молекул.
Теория сильных электролитов
При растворении электролитов происходит диссоциация их молекул. Способность вещества к образованию ионов выражается степенью диссоциации (α).
α = (число молекул распавшихся на ионы)/ (общее число молекул вещества).
Электролиты делятся на:
- слабые электролиты,
- сильные электролиты.
Процесс диссоциации слабых электролитов обратимый
Н2СО3 ↔ Н+ + НСО 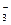
К1 =  .
.
Сильные электролиты не подчиняются закону действия масс. Константа диссоциации сильных электролитов зависит от концентрации, при повышенной концентрации она уменьшается.
П. Дебай и Э Хюккель (1923г.) - теория сильных электролитов: растворы сильных электролитов состоят только из ионов.
Ионы в растворе распределяются также как в кристаллах, но на большем расстоянии друг от друга. Их взаимное влияние ослабляется присутствием молекул растворителя. В сильно разбавленных растворах взаимное влияние их ионов слабо и кажущаяся степень диссоциации приближается к 100%. Увеличение концентрации вызывает увеличение взаимного влияния и кажущаяся степень диссоциации уменьшается. При увеличении концентрации раствора подвижность ионов снижается, поэтому растворы сильных электролитов характеризуются величиной активной концентрацией (а), которая меньше истинной.
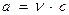
а - активная концентрация, моль/л;
с – истинная концентрация, моль/л;
ν – коэффициент активности.
Если в растворе находится смесь электролитов, то электростатическое действие ионов друг на друга характеризуется ионной силой раствора (I)
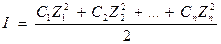 , где
, где
С1, С2, …, Сn - истинные концентрации отдельных ионов.
Z1, Z2, …, Zn - заряды ионов.
2.6 Коэффициент активности (ν)
Коэффициент активности (ν) не зависит от химической природы иона и одинаков для всех равнозарядных ионов при определенной ионной силе раствора. В водах с малым солесодержанием (до 200 мг/л) ν- не принимают во внимание. При большой концентрации электролита необходимо учитывать ν. Для растворов с ионной силой до 0,01 ν рассчитывается по формуле:
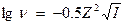 . При I - от 0,5 до 0,01, коэффициент активности рассчитывается по формуле:
. При I - от 0,5 до 0,01, коэффициент активности рассчитывается по формуле:
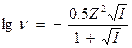
Эта формула применима для точного расчета коэффициента активности растворов с концентрацией до 50 ммоль/дм3.
Произведение растворимости
1. Для выражения растворимости практически нерастворимых веществ используется условная величина – произведение растворимости ПР.
При контакте воды с поверхностью практически нерастворимого вещества, например СаCO3 начинается выход в раствор незначительного количества ионов Ca2+ и CO  . Так как скорость растворения υ1 зависит от количества ионов на поверхности, то можно допустить, что с течением времени она не меняется, то есть:
. Так как скорость растворения υ1 зависит от количества ионов на поверхности, то можно допустить, что с течением времени она не меняется, то есть:
υ1 = κ1
При повышении концентрации ионов в растворе увеличивается υ2 - скорость перехода ионов из раствора на поверхность твердой фазы. υ2 зависит от активности ионов, а для сильно разбавленных растворов от концентрации ионов в растворе и выражается уравнением:
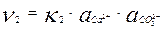
При определенной концентрации ионов в растворе скорости растворения и осаждения становятся равны, то есть υ1 = υ2. Следовательно
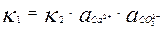 , отсюда
, отсюда 
Отношение  - величина постоянная, характеризует растворимость труднорастворимого электролита и называется произведением растворимости. В насыщенном растворе CaCO3 существует равновесие
- величина постоянная, характеризует растворимость труднорастворимого электролита и называется произведением растворимости. В насыщенном растворе CaCO3 существует равновесие
СаCO3 ↔ Ca2+ + CO 
твердая фаза раствор
ПР  = a
= a 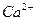 ∙ a
∙ a 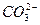 =4,8 ∙10-9 моль/л.
=4,8 ∙10-9 моль/л.
Если при диссоциации электролита, образуется несколько одинаковых ионов, то ПР равно произведению активностей ионов в степени, соответствующей количеству ионов.
Mg3 (PO4)2 ↔ 3Mg2+ + 2PO 
ПР 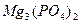 = a 3
= a 3 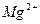 ∙ a 2
∙ a 2 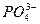 . Если произведение активностей ионов <ПР – раствор является ненасыщенным.
. Если произведение активностей ионов <ПР – раствор является ненасыщенным.
Если оно равно ПР, то раствор будет насыщенным .
Если произведение активностей ионов > ПР, то раствор является пересыщенным.
Представив вместо активностей ионов значения их концентраций, получим:
a 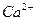 = γ
= γ 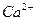 ∙ [Са2+]; a
∙ [Са2+]; a 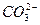 = γ
= γ 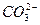 ∙[СО
∙[СО 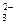 ], где
], где
γ – коэффициент активности, то есть отношение активности к истинной концентрации. Тогда
ПР  = γ
= γ 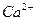 [Са2+]∙γ
[Са2+]∙γ 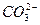 [СО
[СО 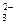 ]
]
Коэффициенты активности ионов с одинаковой величиной зарядов равны. Следовательно ПР  =γ2 [Са2+]∙γ[СО
=γ2 [Са2+]∙γ[СО 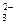 ], то есть [Са2+][СО
], то есть [Са2+][СО 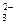 ]=ПР
]=ПР 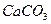 /γ2.
/γ2.
Так как концентрации ионов [Са2+] = [СО 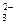 ], то концентрация каждого из них будет соответствовать молярной концентрации насыщенного раствора.
], то концентрация каждого из них будет соответствовать молярной концентрации насыщенного раствора.
[Са2+] = [СО 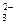 ]=
]=  .
.
В сильноразбавленных растворах, когда γ = 1
С(моль/л) = 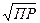 , где
, где
С – молярная концентрация насыщенного раствора бинарного электролита. При введении в насыщенный раствор труднорастворимого электролита другого электролита, не содержащего с ним одноименных ионов, наблюдается повышение растворимости. Это явление называется солевым эффектом.
ГИДРОЛИЗ СОЛЕЙ
Гидролизом называется взаимодействие вещества с водой, при котором составные части вещества соединяются с составными частями воды.
Гидролизу подвержены соединения разных классов, мы будем рассматривать гидролиз солей.
В реакции гидролиза вступают соли образованные: слабой кислотой и слабым основанием; слабой кислотой и сильным основанием; сильной кислотой и слабым основанием.
3.1 Механизм протекания реакций гидролиза
1. Соль образована одноосновной кислотой и одновалентным металлом.
СН3СООNa + Н2О → СН3СООН + NaОН
СН3СОО- + Н2О → СН3СООН + ОН-
Из уравнения видно, что гидролизу подвергается анион соли и освобождается ОН-. Но поскольку ионное произведение воды [H+] [OH-] – величина постоянная, то при накоплении ионов ОН- концентрация ионов Н+ уменьшается. Следовательно: растворы солей, образованные слабой кислотой и сильным основанием имеют щелочную реакцию.
2. Аналогично в случае соли, образованной сильной кислотой и слабым основанием, гидролизу подвергается катион соли и освобождаются ионы водорода.
NH4Cl + H2O ↔ NH4OH + HCl
NH4+ + H2O ↔ NH4OH + H+
В этом случае реакция среды кислая.
3. Соль образована слабой многоосновной кислотой или слабым основанием многовалентного металла. Гидролиз таких солей протекает ступенчато.
1) Na2CO3 + H2O ↔ NaHCO3 + NaOH
CO3 2- + H2O ↔ HCO3- + OH –
2) NaHCO3 + H2O → NaOH + H2CO3
HCO3- + H2O →H2CO3 + OH –
Аналогично для солей образованных слабым основанием и сильной кислотой
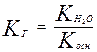
Для соли слабой кислоты и слабого основания
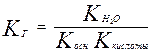
Запишем уравнение гидролиза в общем виде:
МА + Н2О ↔ НА + МОН
НА – кислота
МОН – основание
МА – соль.
Этому равновесию отвечает константа:
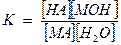
[Н2О] – величина постоянная. Тогда

К· [Н2О] - Кг (константа гидролиза), таким образом
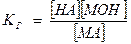
Для случая соли слабой кислоты и сильного основания
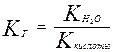
Отсюда следует, что Кг обратно пропорциональна Ккислоты, чем слабее кислота, тем сильнее гидролизуются ее соли.
При гидролизе по первой ступени образуется ион НСО3- . Его диссоциация характеризуется второй константой диссоциации угольной кислоты. Во второй ступени образуется Н2СО3, его характеризует первая константа диссоциации.
Поэтому,
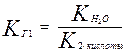 ;
;
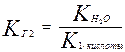 ;
;
так как К1 > К2, то КГ1 > КГ2.
Следовательно, гидролиз по первой степени всегда протекает в большей степени, чем по второй.
Аналогично проходит гидролиз соли образованный слабым основанием многовалентного металла.
CuCl2 + H2O ↔ CuOHCl +HCl
Cu2+ + H2O ↔ CuOH+ + H+
В ничтожно малой степени:
CuOHCl + H2O → Сu(OH)2 + HCl
Cu2+ + H2O → Сu(OH)2 + H+
Особенно глубоко протекает гидролиз солей образованных слабой кислотой и слабым основанием.
Al(CH3COO)3 + H2O ↔ Al(OH)(CH3COO)2 + CH3COOH
Al(OH)(CH3COO)2 + H2O ↔ Al(OH)2(CH3COO) + CH3COOH
Гидролиз катиона:
Аl3+ + H2O ↔ AlOH 2+ + H+
Гидролиз аниона:
СН3СОО- + Н2О ↔ СН3СООН + ОН-
При гидролизе катиона образуется Н+, при гидролизе аниона образуется ОН-. Реакция среды в этом случае зависит от отношения констант диссоциации. Если кислота и основание, образующие соль, не только слабые электролиты, но и малорастворимы или неустойчивы, то гидролиз часто протекает необратимо.
Гидролиз хлора
При растворении хлора в воде происходит его гидролиз по следующему уравнению.
Сl2 + H2О ↔ НОСl + HCl
Равновесие сильно смещено влево. При соединении хлора с водой образуются незначительные количества соляной и хлорноватистой кислоты.
Но равновесие хлора с водой можно сместить вправо добавлением щелочи.
Cl2 + 2KOH ↔KCl + KOCl + H2O
В растворе хлорной воды в виде ионов находится только соляная кислота, так как хлорноватистая – слабая, поэтому присутствие сильной кислоты подавляет ее действие почти нацело.
Сl2 + HOH ↔ H+ + Cl- + HOCl
Константа гидролиза будет равна
 = Кгидр = 4,5·10-4
= Кгидр = 4,5·10-4
Гидролиз хлорамина
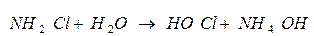

Буферные растворы
Буферными растворами называются растворы, рН которых не изменяется при прибавлении небольшого количества сильной кислоты или щелочи.
Основные виды буферов:
1. Слабая кислота и ее соль (ацетатная СН3СООН и СН3 СООNa), (карбонатная Н2СО3 и NaHCO3).
Пример.
Н2СО3 ↔ Н+ + НСО3-
NaHCO3 ↔ Na+ + HCO3-
NaHCO3 – сильный электролит.
Диссоциация Н2СО3 – подавлена вследствие наличия в воде НСО3- из соли. При введении в такой раствор кислоты ионы Н+ будут взаимодействовать с ионами НСО3- , образуя компонент буфера – Н2СО3
Н+ + НСО3- → Н2СО3
Если добавить щелочь, то введенные ионы ОН- взаимодействуют с малым количеством ионов Н+ из Н2СО3
Н++ ОН- → Н2О
Запишем выражение константы диссоциации Н2СО3
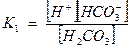 , так как диссоциация невелика, можно считать [Н2СО3] равной общей концентрации кислоты Скисл.
, так как диссоциация невелика, можно считать [Н2СО3] равной общей концентрации кислоты Скисл.
[HCO3-] =С соли.
Получаем 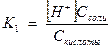 , откуда [H+] =
, откуда [H+] =  .
.
Так как [H+], а следовательно и рН зависит не от величин концентраций, а от их соотношения, то при разбавлении она остается постоянной.
Характеристикой буферных растворов служит величина буферной емкости. Она определяется числом г –экв. сильной кислоты или щелочи, которую необходимо прибавить к 1л буферного раствора для изменения рН на 1 единицу.
2. Слабое основание и его соль:
аммонийная (NH4OH и NH4Cl).
3. Две кислые соли:
фосфатная (Na2HPO4, NaH2PO4).
4. Кислая и средняя соль:
карбонатная (NaHCO3, NaCO3).
Таким образом постоянство рН буферных систем при добавлении кислоты или щелочи объясняется связыванием вводимых ионов Н+ и ОН-.
Кислые или щелочные стоки, попадающие в водоем могут быть нейтрализованы карбонатной буферной системой природных вод. (Н2СО3, NaHCO3).
В щелочных водах (при рН >8,5) буферность природных вод определяется другой карбонатной системой (NaHCO3, Na2CO3). Поддержание оптимальной величины рН при биологической очистке стоков необходимо для протекания биохимических процессов.
Буферные свойства иловой воды обуславливаются наличием карбонатной, аммонийной и фосфатной систем. Буферные растворы используются при проведении анализа - аммонийный при комплексометрическом определении жесткости воды и т.д.
Влияние концентрации.
Закон действия масс.
А+В = АВ V = К[A][B],
где К - константа скорости, моль/ л∙с;
[A][B] – мольные концентрации, моль/дм3.
В общем виде mA+mB = AmBn
V = K[A]m [B]n
Влияние катализаторов.
Катализаторы - вещества которые изменяют скорость реакции не принимая в ней участия и остаются химически неизмененными и в прежнем количестве.
Каталитические процессы широко распространены в природе.
Вода – универсальный катализатор.
Природные катализаторы – ферменты.
Стабильность воды
Воды, в которых соблюдается основное карбонатное равновесие, называются стабильными. Они не изменяют избыток свободной угольной кислоты над равновесной называются агрессивными. При контакте с бетоном или карбонатами такие воды вызывают растворение карбонатных составляющих.
СаСО3 + СО2 + Н2О ↔ СаНСО3
Са(ОН)2 + 2СО2 ↔ СаНСО3.
Воды, в которых имеется избыточное (над равновесным) содержание гидрокарбонатов, то есть повышенная щелочность, называются нестабильными. Для оценки агрессивных свойств воды сопоставляют количество свободной угольной кислоты, установленное анализом, с вычисленным по формуле:
 .
.
Определение агрессивной углекислоты проводится сопоставлением щелочности воды до и после контакта ее с карбонатом кальция,
СО2 + Н2О + СаСО3 → Са(НСО3)2
повышает щелочность
Стабильность воды оценивается по методу Ланжелье.
рНs = pK2 – pПР СаСО 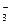 - lg [Ca2+] – lg Щ0 + 2,5
- lg [Ca2+] – lg Щ0 + 2,5 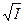 +7,6
+7,6
рНs - рН равновесного насыщения воды карбонатом кальция (то есть величина рН соответствующая равновесию свободной углекислоты с другими ее формами),
рК2 - отрицательный log. константы диссоциации 2 ступени угольной кислоты,
pПР СаСО 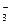 отрицательный log. ПР СаСО
отрицательный log. ПР СаСО 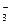
I – ионная сила раствора.
Характер свойств воды производится по «индексу насыщения» -Щ, который представляет собой разность между рН исследуемой воды и рНs:
Щ = рН иссл. - рНs
Если Щ – положительное (+), то рН иссл. > рНs. При этом вода будет нестабильной.
Если Щ – отрицательно (-), то рН иссл. < рНs , то есть вода имеет повышенную кислотность и является агрессивной.
Если рН иссл. = рНs , Щ =0, то вода стабильная. Стабильность характеризуется также показателем стабильности С (основным Сосн и вспомогательным Свсп).
Сосн = Щиссл / Щ нас ,
где Щиссл – исследуемой воды, Щ нас насыщенной карбонатом кальция.
Свсп =рНиссл / рНнас
Если С=1, то есть рНиссл =рНнас, то вода стабильна, при С<1 вода агрессивная.
Стабилизация воды, содержащей агрессивную углекислоту, производится веществами, вызывающими повышенную щелочность (известь, гидроксид и карбонат натрия).
NaOH + CO2 = NaHCO3
Ca(OH)2 + 2CO2 = Ca(HCO3)2
Na2CO3 + CO2 + H2O = 2NaHCO3
Обработка нестабильных вод заключается в обработке их кислотами.
NaHCO3 + HCl = NaCl + H2O + CO2
На некоторых очистных сооружениях используются мраморно – песчаные фильтры, которые позволяют получить не только осветленную, но и стабильную воду.
ПРИРОДНЫЕ ВОДЫ
Микроэлементы.
Элементы, содержание которых в воде составляет менее 1 мг/л, относятся к группе микроэлементов.
Выделяются следующие группы микроэлементов:
1. Типичные катионы (Zi+, Pb2+, Cr3+, Ba2+, Sr2+).
2. Ионы тяжелых металлов (Сu2+, Ag+, Ni2+, Cd2+ и др.).
3. Амфотерные комплексообразователи (Cr, Mo, V и др.).
4. Типичные анионы (I-, F-, Br- и др.).
5. Радиоактивные элементы.
I- и F- имеют важное гигиеническое значение.
При недостатке I- в воде возникает заболевание щитовидной железы эндемический зоб. Для профилактики люди получают нужное количество I с солью. В воде йод содержится в виде I- - иона.
F в воде встречается в виде F- - иона. Его содержание изменяется от сотых долей до десяти мг/л и более. Концентрация F- в водах России составляет от 0,01 до 12 мг/л. При недостатке F- наблюдается кариес зубов, а при избытке флюороз (пятнистая эмаль).
Все ионы могут быть естественными компонентами природных вод или появляться в водоемах в результате практической деятельности человека.
7.4 Основные показатели качества воды
Выбор и оценка качества источника водоснабжения базируется на результатах изучения его санитарного состояния.
Анализ воды проводится с соблюдением определенных правил отбора проб и включает в себя характеристику органолептических, химических и бактериологических показателей. Объем программы исследования водоема определяется специальным ГОСТ 2761-84. Оценка воды ведется по следующим показателям.
Мутность воды
Грубодиспергированные примеси (частицы диаметром более 100нм) обуславливают мутность воды.
Причины: наличие песка, глины, органические компоненты.
Величина мутности зависит от характера питания водоема, свойств береговых пород, климатических и погодных условий. Мутность определяют гравиметрическим нефелометрическим и визуальным методами.
1) гравиметрический – взвешивание фильтра после пропускания через него определенного объема воды;
2)фотоэлектрофолориметрический (нефелометр) – основан на рассеивании света взвешенными частицами;
3) визуальный - сравнение мутности образца со стандартами с известной мутностью.
Вода содержащая незначительное количество примесей прозрачна. Их количество характеризуется величиной обратной мутности – прозрачностью.
Прозрачность воды характеризуется высотой столба жидкости, через которое просматривается «крест», толщина менее 1 мм, нанесенный черной краской на белую фарфоровую пластинку. Вода для питьевого водоснабжения должна иметь прозрачность «по кресту» не менее 300см, а «по шрифту» не менее 30см.
Цветность воды
Гуминовые и фульвокислоты и их соли, водоросли, могут сообщать воде окраску.
Интенсивность окраски цветных вод характеризуется цветностью. Цветность определяется по платиново – кобальтовой шкале и выражается в градусах.
Один градус такой шкалы соответствует содержанию в 1 л раствора 2,49мг хлорплатината калия К2 [PtCl6] и 2,018 мг хлорида кобальта СоСl·6Н2О. Определение цветности производится колориметрическим методом. Согласно ГОСТ 2761 -84 цветность воды не должна превышать 20 0С по платиново – кобальтовой шкале. В отдельных случаях по согласованию с органами санитарного надзора, допускается цветность до 350С.
7.4.3. Запах и вкус воды обусловлен растворенными солями, газами, органическими соединениями, образующимися в процессе жизнедеятельности водных организмов.
В соответствии с происхождением запахи делятся на естественные и искусственные.
1. Естественные (рыбный, гнилостный, болотный, плесневый и др.).
Возникают они в результате жизнедеятельности водных организмов, а также при разложении органических веществ.
2. Искусственные запахи (фенольный, хлорфенольный и др.) появляются при загрязнении источников сточными водами.
Согласно ГОСТ 2761 -84, определение запаха проводится при t -20 0С и при подогреве до 60 0С. При этом делается качественная и количественная характеристика.
Жесткость воды
Катионы Са2+, Mg2+ и тяжелых металлов обуславливают жесткость воды.
Общая жесткость – это сумма концентраций Са2+ и Mg 2+ выраженная в мг – экв /л.
Один мг –экв. соответствует содержанию в воде 20мг/л Са2+ или 12мг/л Mg2+.По величине жесткости природные воды делятся на следующие группы:
вода очень мягкая (<1,5 мг-экв/л);
вода мягкая (1,5 -3,0 мг-экв/л);
вода средней жесткости (3-5,4 мг-экв/л);
вода жесткая (5,4 -10,7 мг-экв/л);
вода очень жесткая (> 10,7 мг-экв/л).
В воде ионы Са2+ и Mg 2+ могут быть связаны с различными анионами (HCO3, SO42-Cl-, CO32+ и т.д.).
Соответственно этому, жесткость воды, обусловленную наличием гидрокарбонатов и карбонатов Са и Mg, называется карбонатной жесткостью.
Сульфаты, хлориды, а также кальциевые и магниевые соли других кислот, гидроксиды кальция и магния характеризует некарбонатную жесткость.
Са(НСО3)2 и Mg(НСО3) – обуславливают устранимую или временную жесткость. Она устраняется кипячением:
Са(НСО3)2→СаСО3 ↓ + СО2 +Н2О
Mg(НСО3)→ Mg СО3 + СО2 +Н2О
Mg СО3 +Н2О → Mg (ОН)2 ↓+ СО2 +Н2О
Часть общей жесткости остающаяся после кипячения, называется постоянной жесткостью.
Обессоливание воды
Метод обработки воды, направленный на снижение общего солесодержания, называется обессоливанием.
Полной обессоливание – остаточное солесодержание 0,01, 0,1мг/л.
Частичное обессоливание - удаление отдельных ионов.
Опреснение – один из случаев обессоливания.
8.1.4.1. Метод ионного обмена.
Сущность метода заключается в последовательном пропускании воды через Н – катионитовый и ОН- - анионитовый фильтры.
RH +NaCl↔ NaR + HCl
2RH + Na2SO4 ↔ 2RNa + H2SO4
RH + NaHCO3 ↔ NaR +[CO2 +H2O]
При этом образуются свободная углекислота и эквивалентное количество НСl и H2SO4. Затем фильтруют через анионит.
ROH + HCl ↔ RCl + H2O
2ROH + H2SO4 ↔ R2SO4 + H2O
Рассмотрим схему полного химического обессоливания:
1 – катионитовый фильтр I ступени (сульфоуголь, КУ-2),
2 - анионитовый фильтр I ступени,
3 - катионитовый фильтр II ступени,
4 - декарбонизатор,
5 – резервный бак,
6 – анионитовый фильтр II ступени,
7 - катионитовый фильтр III ступени,
8 – анионитовый фильтр III ступени.
I ступень идет на Н – каионитовых и ОН – анионитовых фильтрах.
На катионите (сульфоуголь, КУ -2) происходит обмен основных катионов на ионы Н+. И переход гидрокарбоната в свободную угольную кислоту (регенерация серной или азотной кислотой).
На анионите (ЭДЭ -10П) анионы сильных кислот (SO42-, Cl-) на ОН-, анионы слабых кислот остаются в растворе, регенерация раствором NaOH.
II ступень обессоливания предназначается для обмена катионов и анионов, оставшихся после обработки воды на фильтрах I ступени. Перед подачей на анионит II ступени производится удаление свободной углекислоты физическими методами. На анионите II ступени идет обескремнивание воды и удаление оставшихся анионов угольной кислоты. Регенерация NaOH.
III ступень глубокого обессоливания служит для удаления ионов попавших с ионитов I и II ступени. Это буферные фильтры.
Химически обессоленная вода содержит небольшое количество органики. Часть их способна диссоциировать и вступает в реакции обмена с ионитами. Недиссоциирующая органика частично адсорбируется на поверхности зерен ионита. Если окисляемость исходной воды составляет более 15 -20 мг О 2/л, перед Н – каионитом ставят фильтр с активированным или другими адсорбентами. Полностью обессоленная вода (сверхчистая) имеет неустойчивое значение рН, так как в ней отсутствует буферная система. При концентрации СО2 1 мг/л вода имеет рН 5,5 -5,6. В такой воде растворяются труднорастворимые соединения: Fe(OH)3, CaCO3, Al(OH)3. К действию такой воды устойчивы: титан, луженые медь, латунь, полиэтилен, тефлон, полипропилен.
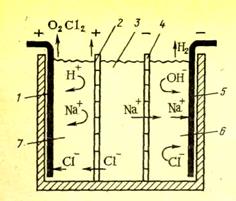
8.1.4.2. Метод электродиализа
Электродиализ – это процесс переноса ионов под действием постоянного электрического тока к электродам через полупроницаемую мембрану, помещенную в раствор электролита.
Электродиализатор состоит из трех камер: катодной, анодной и средней рабочей. Средняя отделена перегородками - мембранами.
Мембраны не пропускают коллоиды, но пропускают воду и ионы электролита.
В средней камере вода подлежащая обессоливанию. В катодную камеру поступают катионы: Na+, Ca2+, H+, Mg2+ и др.
Ионы водорода восстанавливаются на катоде до свободного состояния:
2Н+ + 2ē → Н2
В анодную камеру поступают анионы (Сl-, HCO3-, SO42- и др.) и гидроксид – иона.
4ОН- - 4ē →2Н2О + О2
2Cl- - 2ē → Cl2↑
|
|
Производительность можно увеличить использованием ионитовых мембран.
Рис. 3. Схема трехкамерной ячейки электродиализатора:
1 – анод; 2 – анионитовая мембрана; 3- камера обессоливания; 4- катионитовая мембрана; 5 – катод; 6 – катодная камера; 7 – анодная камера.
Использование трехкамерного диализатора нерентабельно. Чаще применяются многокамерные диализаторы. При этом количество энергии снижается с 60-70 до 1-2%.
Электродиализных установки применяются для обессоливания морских и минерализованных вод, а также в оборотных системах водоснабжения. Электродиализ используют при минерализации воды от 3,5 до 35 г/кг, и при остаточном солесодержания не менее 400 мг/л. Содержание взвешенных веществ не более 3 мг/л;
железа – 0,1 мг/л;
бора – 0,1 мг/л;
цветность – не выше 200С, окисляемость до 5 мг О2/л.
8.1.4.3. Гиперфильтрация (обратный осмос)
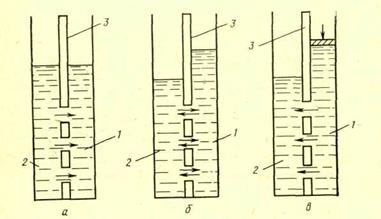
Основан на использовании осмотического переноса молекул воды через полупроницаемую мембрану. Такая мембрана проницаема для молекул воды, но не пропускает молекулы и ионы растворенных в воде веществ. Явление осмоса состоит в том, что при неодинаковых концентрациях раствора с разных сторон полупроницаемой мембраны молекулы воды будут диффундировать через нее из раствора с меньшей концентрацией в раствор с большей концентрацией. Величина возникающего осмотического давления зависит от разности концентраций растворов по обе стороны мембраны: чем она больше, тем выше осмотическое давление. При разности концентраций растворов, соответствующих солесодержанию морской воды (35 г/кг) и дистиллированной (10мг/л), осмотическое давление составляет 24∙102 кПа. Обратный процесс – диффузию молекул воды через мембрану в раствор с меньшей концентрацией можно осуществить, подавая концентрированный раствор на мембрану под давлением, превышающим осмотическое.
Перенос молекул воды через полупроницаемую мембрану из раствора с большей концентрацией в раствор с меньшей концентрацией под действием внешнего давления, превышающего осмотическое давление, называется обратным осмосом или гиперфильтрацией.
|
|
Рис. 4. Схема движения молекул воды через полупроницаемую мембрану:
а – состояние равновесия; б – осмотический перенос; в – обратный осмос;
1- соленая вода; 2- пресная вода; 3- мембрана.
Определяющими характеристиками полупроницаемых мембран являются селективность, проницаемость по воде, стабильность показателей во времени. Селективность мембран S характеризует степень задержания растворенных компонентов и рассчитывается по формуле
S= (Сисх – Сост) ∙100/Сисх ,
где Сисх - концентрация растворенных солей в опресняемой воде;
Сост - остаточная концентрация солей в опресненной воде.
Селективность мембран зависит от солесодержания исходной воды. В интервале концентраций раствора от 0,5 до 10 г/л селективность изменяется незначительно.
8.1.4.4. Газгидратный метод опреснения воды основан на том, что при определенной температуре и давлении некоторые газы образуют с водой кристаллогидраты, выпадающие в виде твердой фазы. Соединения, образующиеся в результате внедрения молекул газа в полости кристаллической решетки льда, называются газгидратами. При этом происходит внедрение молекул газа в полости кристаллической решетки льда, химическое взаимодействие при этом не происходит.
Формула газгидратов:
М∙nН2О, где
М- вещество (газ).
Газгидраты могут иметь структуры I и II. Элементарная ячейка структуры I содержит 46 молекул воды и 8 полостей.
8М∙46 Н2О
Элементарная ячейка структуры II содержит 136 молекул воды, 8 больших и 16 малых полостей.
8М∙136 Н2О
Газгидраты образуются только в малых полостях. Наилучшими гидратообразующими веществами являются:
-пропан C3H8,
-фреоны СF2Cl2.
Температура зависит от солесодержания, при этом температура увеличивается и систему необходимо охлаждать, на поверхности образуется слой рассола, необходима промывка.
8.1.4.5. Дистилляционный метод
При нагревании опресняемой воды до температуры кипения происходит интенсивное образование пара, который почти не содержит солей. Температура кипения исходной воды зависит от общего солесодержания.
Опреснение воды методом дистилляции осуществляется на испарительных установках различных конструкций с использованием разных источников тепловой энергии, стоимость которой составляет половину расходов на опреснение.
8.1.4.6. Опреснение воды вымораживанием
При замерзании минеральных вод соль и вода образуют отдельные структуры: сначала формируются кристаллы пресного льда, а на поверхности кристаллов сохраняется рассол. Наиболее приемлемые гидрофобные нетоксичные хладагенты: изобутан, бутан, фреоны, имеющие температуру кипения ниже 00 С.
8.1.4.7. Оценка качества опресненной и обессоленной воды
Вода должна соответствовать требованиям ГОСТ. Установление ПДК.
Минимальное солесодержание 100 мг/л. при употреблении воды с общим солесодержанием менее 50 мг/л – происходит нарушение водно – электролитного обмена и выведение из организма Cl-, Na+, K+, Ca2+. Оптимальное солесодержание 250 мг/л.
Обычно за эталон при подготовке питьевой воды из дистиллята берется вода Московского водопровода (общее солесодержание 250 мг/л).
Таблица 1
Обеззараживание воды
Для обеззараживания воду дезинфицируют действием реагентов, убивающих патогенные (болезнетворные) микроорганизмы.
Озонирование воды
Озон – аллотропическое видоизменение кислорода (О3). Он образуется из кислорода по уравнению
3О2 ↔ 2О3 -69ккал.
Растворимость озона в природных водах зависит от реакции среды и от количества веществ, растворенных в воде.
Бактерицидное действие озона связано с его высоким окислительным потенциалом и легкостью его диффузии через клеточные оболочки микроорганизмов.
Он окисляет органические вещества микробной клетки и приводит ее к гибели. Озон действует на бактерии быстрее, чем хлор и его расход меньше.
Например: вирус полимиелита погибает под действием 0,45 мг/л озона через 2 мин., а хлора через 3 часа, при дозе 2 мг/л.
Озонирование имеет ряд преимуществ:
1) улучшение органолептических свойств воды,
2) не требует дополнительных мероприятий для удаления избытка реагента,
3) легкость получения.
Недостатки:
1) затраты электроэнергии,
2) коррозионная активность, озон и его растворы разрушают сталь, чугун, медь, резину, эбонит.
Кроме этого применяются для обеззараживания:
1. ионы серебра (олигодинамия).
2. Ультрафиолетовые лучи.
3. Ультразвуковые волны.
9. СТОЧНЫЕ ВОДЫ И МЕТОДЫ ИХ ОЧИСТКИ
Сточные воды делятся на производственные, ливневые и бытовые.
Минеральные загрязнения:
- соли аммония;
- фосфаты;
- хлориды;
- гидрокарбонаты и др.;
- рН 7,2 -7,8.
Органические вещества: продукты разложения органики присутствуют в виде:
- взвешенных веществ;
- коллоидных растворов;
- ионных растворов.
При медленном движении и отстаивании из бытовых сточных вод выпадает твердая фаза:
- частицы песка;
- шлаки;
- волокна;
- органика различного происхождения.
Органические вещества бытовых сточных вод можно разделить на две группы:
- безазотистые, содержащие углерод, водород кислород;
- азотосодержащие вещества.
Безазотистые: углеводы и жиры – моно - , ди-, полисахариды СnH2nOn- простые, СnH2mOm – сложные. Из моносахаридов чаще всего встречается глюкоза С6H12O6 и лактоза, их дисахаридов сахароза С12H22O11, из полисахаридов полимеры (С6H10O5)n. Целлюлоза и крахмал нерастворимые в воде полисахариды.
Жиры – это сложные эфиры трехатомного спирта глицерина и высших карбоновых кислот (олеиновой, стеариновой, пальмитиновой и т.д.).
СН2 - ОН
|
CH-OH - глицерин
|
СН2 - ОН
Жиры хорошо растворимы во многих органических растворителях. В воде в присутствие ПАВ образуют устойчивые эмульсии.
Азотистые соединения - белки и продукты их гидролиза: аминокислоты, пептиды.
Белки - естественные полимеры аминокислот (NH2 –CH3COO). Если в белке присутствуют только остатки аминокислот, то они называются протеинами. Если присутствует и небелковая часть, то это протеиды.
В воде белки образуют коллоидные растворы, устойчивость которых зависит от рН, температуры, присутствия электролитов.
ПАВ – постоянный компонент бытовых сточных вод. Они приводят к образованию пены, это ухудшает процесс обработки воды.
Микроорганизмы - (бактерии, вирусы, яйца гельминтов). Обуславливают опасность в эпидемиологическом отношении.
Городские сточные воды образуются при смешении ливневых, бытовых и предварительно обезвреженных производственных сточных вод.
Поверхностные явления
С поверхностными явлениями, протекающими в гетерогенных системах на границе раздела фаз связаны смачивание, растекание, флотация, эмульгирование и т.д.
|
|
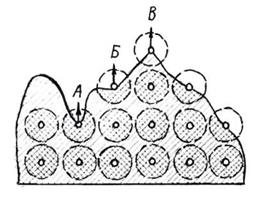
Протекание поверхностных процессов связано с уменьшением свободной поверхностной энергии. Рассмотрим причины возникновения поверхностной энергии у твердого вещества. Состояние молекул в твердом веществе неодинаково и зависит от их расположения в частице.
Рис.7. Поверхностная энергия твердого вещества.
Молекулы, расположенные внутри частицы не имеют свободного силового поля, так как межмолекулярные силы здесь полностью скомпенсированы. Молекулы на поверхности частицы имеют избыточное силовое поле, так как межмолекулярные силы у них компенсируются частично. Из рисунка видно что молекулы расположенные на «пиках» обладают наибольшим избытком свободной поверхностной энергии.
Следовательно, величина поверхностной энергии зависит от величины и формы поверхности, которая в свою очередь зависит от дисперсности частиц. Если вещество подвергать дроблению, то это ведет к увеличению его удельной поверхности. Чем более развита поверхность вещества, тем интенсивнее протекают процессы связанные с поверхностными явлениями, и в первую очередь адсорбция.
Адсорбция - это поглощение поверхностью вещества газов, паров и растворенных веществ за счет свободной поверхностной энергии. Вещество, адсорбирующее на своей поверхности другое вещество, называется адсорбентом.
Адсорбируемое вещество адсорбтивом.
Адсорбент должен обладать свободным силовым полем, за счет которого он может притягивать к себе частицы. Во многих случаях адсорбированный слой мономолекулярный.
Адсорбционное равновесие - это равновесие динамическое. Некоторые адсорбированные молекулы отрываются от адсорбента и переходят в окружающую среду. Это явление, обратное адсорбции, называется десорбцией. И наоборот, молекулы из окружающей среды могут осаждаться на адсорбент.
[ Адсорбент] + [ Адсорбтив] 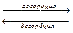 [Адсорбат]
[Адсорбат]
Адсорбат - адсорбент, насыщенный адсорбтивом при данных условиях.
Адсорбционное равновесие, как правило, устанавливается в течение нескольких секунд. Молекулы газообразного или парообразного вещества могут проникать в толщу адсорбента, образуя однородную массу. Процесс поглощения адсорбтива всей массой поглотителя называется абсорбцией.
Следовательно, адсорбция - явление поверхностное, а абсорбция – объемное. Пример абсорбции – процесс растворения любого газа в жидкости.
Если поглощаемое вещество химически взаимодействует с поглотителем, то такой процесс называется хемосорбцией. Например, образование тонкой поверхностной пленки на металлах предотвращает от коррозии.
Адсорбция, абсорбция и хемосорбция объединяются под общим названием – сорбция.
Коллоидные системы
Классификация золей
Дисперсная система с размером частиц от 1 до 100 нм, распределённых в той или иной среде, называются коллоидным раствором или золем. Коллоидные системы являются гетерогенными системами, состоящими из двух или более фаз.
Характеристикой коллоидного раствора является величина свободной межфазной энергии. Величина эта зависит от:
- удельной поверхности частиц S0;
S0= 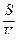 ,
,
где S - суммарная поверхность;
V - объём дисперсной фазы;
-степени дисперсности D;
D= 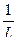 ,
,
где L – размер частиц.
Существует несколько классификаций коллоидных систем:
- классификация по агрегатному состоянию дисперсионной среды:
1. Аэрозоли - дисперсионная среда газообразная (дым, туман и т.д.).
2. Лиозоли – дисперсионная среда жидкость (гидрозоли).
3. Солиозоли – дисперсионная среда твёрдая (сплавы).
4. Пены – дисперсия газа в жидкости;
- классификация по межфазному взаимодействию:
1. Лиофильные – характеризуются сильным межмолекулярным взаимодействием между веществом дисперсной фазы со средой.
2. Лиофобные – слабое взаимодействие;
- классификация по внутренней структуре частиц:
1. Суспензоиды – высокодисперсные гетерогенные системы (лиофильные и лиофобные) неустойчивые и необратимые.
От суспензий они отличаются размерами частиц. Они не могут длительно существовать в отсутствии стабилизатора дисперсности (как и суспензии). Необратимые, т.к. осадки суспензоидов остающиеся при выпаривании таких коллоидов не образуют вновь золя при контакте с дисперсионной средой. К ним относятся золи металлов, их оксидов, гидроксидов, различных неорганических солей.
Свойства суспензоидов определяются очень сильной поверхностной энергией, это приводит к неустойчивости их без стабилизатора.
Высокомолекулярные соединения (белки, полипептиды, поливиниловый спирт и др.), добавляемые для стабилизации дисперсных систем называются защитными коллоидами.
Адсорбируясь на границе раздела фаз, они образуют в поверхностном слое структуры, создающие барьер, препятствующий объединению частиц дисперсной фазы.
2. Молекулярные коллоиды – гомогенные системы, устойчивые и обратимые. К ним относятся высокомолекулярные вещества с молекулярной массой от десяти тысяч до нескольких миллионов. Молекулы этих веществ имеют размеры коллоидных частиц, поэтому такие молекулы называются макромолекулами. Образование молекулярных коллоидных систем происходит в процессе набухания.
При неограниченном набухании полимер переходит в растворимое состояние с образованием гомогенной системы. Растворы молекулярных коллоидов легко превращаются в гетерогенные системы при незначительном изменении состава среды (белок, растворённый в воде, при добавлении спирта переходит в лиофобный золь).
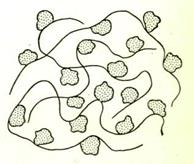
3. Мицеллярные коллоиды (полуколлоиды). Коллоиднодисперсные частицы этого типа возникают при высокой концентрации дифильных молекул низкомолекулярных веществ путем их ассоциации в агрегаты молекул (мицеллы) сферической или пластинчатой формы.
Дифильные молекулы состоят из углеводородного радикала, имеющего сродство к неполярным растворителям, и гидрофильной группы, имеющей сродство к воде.
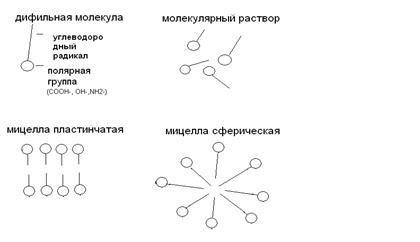
Рис. 9 . Образование мицелл из дифильных молекул
Мицеллы представляют собой скопление правильно расположенных молекул, удерживаемых дисперсионными силами. Образование мицелл характерно для водных растворов моющих веществ (мыла), некоторых органических красителей и т.д.
Свойства коллоидных систем.
Коллоиды – гетерогенные системы состоящие из двух (или более) фаз. Коллоиды занимают промежуточное положение между взвесями и истинными растворами. От взвесей отличаются тем, что осаждаются со временем, а от истинных растворов тем, что задерживаются специальными мембранами из коллодия или бычьего пузыря.
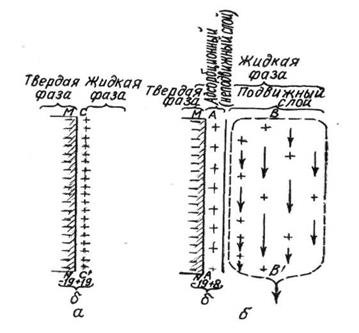
Строение коллоидной частицы
В основе мицеллы лежит нерастворимое в данной дисперсионной среде ядро. Поверхность ядра адсорбирует из окружающей среды ионы. Эти ионы называются потенциалообразующими, так как сообщают частице определённый заряд. Например для золя гидроокиси железа потенциалообразующим ионом будет хлорокись железа FeOCl образующая по уравнению
Fe(OH)3 + HCl = FeOCl + 2H2O
FeOCl = FeO+ + Cl-
Катионы FeO+ адсорбируются на поверхности ядра, заряжая его положительно.
Катион FeO+ сообщает частице положительный заряд, а в растворе находятся ионы Cl- -противоионы. Они испытывают действие двух сил:
- электростатическую, притягивающую их к ядру (адсорбционную);
- диффузионную, стремящуюся их рассеять.
В соответствии с этим ионы Cl- образуют плотный адсорбционный слой на ядре и диффузионный слой – ионную атмосферу частицы. Совокупность адсорбционного и диффузионного слоёв представляет собой двойной электрический слой. Ядро с адсорбционным слоем образует гранулу, а система, состоящая из гранулы и диффузионного слоя, называется мицеллой.
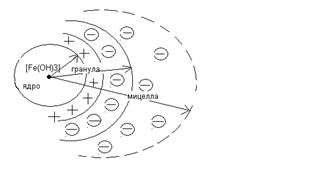
Рис. 10. Строение коллоидной частицы гидроксида железа.
Рассмотрим двойной электрический слой:
|
|
При диффузионном строении слоя потенциал твердой частицы компенсируется частично, так как около неё удерживается неподвижным слоем жидкости только часть противоионов. На границе подвижного и неподвижного слоёв возникает разность потенциалов – это, так называемый, электрокинетический потенциал. Следовательно, электрокинетический потенциал есть разность потенциалов на границе неподвижного (адсорбционного) слоя жидкости и подвижного (диффузионного).
Рис.11. Структура двойного электрического слоя:
а – адсорбционный слой; б –диффузное строение слоя.
Полное падение потенциала на границе, твёрдое вещество – растворённое до нулевого значения соответствует максимальной разности потенциалов твёрдого вещества и всех противоионов вместе взятых. Это термодинамический потенциал.
В вопросах очистки воды дзета-потенциал имеет большое значение. При разрушении дисперсных систем с помощью коагулянта происходит снижение дзета-потенциала до критической величины, то есть до изоэлектрического состояния коллоидной частицы.
Коагуляция электролитами наступает в результате сжатия диффузионного слоя, за счёт увеличения концентрации противоионов в диффузионном слое.
Таким образом, дзета-потенциал является мерой устойчивости коллоидных систем.
Если граница диффузионного слоя совпадает с границей адсорбционного, электрокинетический дзета-потенциал равен нулю. Это изоэлектрическая точка золя.
Обработка воды коагулянтами
В природных водах содержатся одновременно частицы по размерам соответствующие грубодисперсным системам и коллоидам. Грубодисперсные частицы удаляются отстаиванием. А коллоиды не отстаиваются.
Воды бывают мутные и цветные.
В мутных водах присутствуют: коллоидные частицы алюмосиликатов (глинистые), кремниевой кислоты, органоминеральных комплексов почвы.
Коллоидные частицы примесей природных вод, как правило, имеют отрицательный заряд.
Основу глинистых частиц образуют гидроалюмосиликаты.
Гумусовые соединения занимают промежуточное положение между коллоидами и ВМС. Они более устойчивы к действию электролитов и обладают защитными свойствами по отношению к коллоидным растворам гидроксидов металлов. Они затрудняют процессы очистки воды.
Метод обработки воды, направленный на удаление веществ – коллоидов с помощью химических реагентов называется коагулированием. Вещества, вызывающие разрушение коллоидов, называются коагулянтами.
Коагулирование применяется для осветления мутных и обесцвечивания цветных вод. Наряду с коллоидами при этом удаляются грубодисперсные примеси, планктон, бактерии и вирусы.
Коагулянты представляют собой соли слабых оснований и сильных кислот. Они гидролизуются :
Al3+ + H2O ↔ ( AlOH )2+ + H+
(AlOH )2+ + H2O ↔ Al (OH)2+ + H+
Al(OH)2+ + H2O ↔ Al(OH)3 + H+
Могут образоваться аквакомплексы, тогда гидролиз :
[Al (H2O)6]+3 + H2O = [ Al (H2O)5OH]+2 + H3O+
Эффективность действия коагулянта определяется полнотой гидролиза с образованием труднорастворимых гидроксидов.
Для увеличения степени гидролиза необходимо связывать ионы H+. Это достигается за счёт HCO3- ,CO32- ,OH- , присутствующих в воде (щелочной резерв).
Al2(SO4)3 + 3Ca(HCO3)2 + 6H2O → 2Al(OH)3 + 3CuSO4 + 6H2CO3
∕ \
H2O CO2
Гидроксид алюминия обладает амфотерными свойствами. Его образование начинается при pH >4,5, а при pH >8,5 происходит растворение Al(OH)3.
С образованием алюминатов
Al(OH)3 + Na OH = Na3[Al(OH)6]
гексагидроксоалюминат
натрия
В щелочной среде образуется анион метаалюминиевой кислоты AlO-2. В результате гидролиза:
AlO-2 + 2H2O → Al(OH)3 + OH-
На этом основано применение его как коагулянта. Гидроксид железа Fe(OH)3 образуется в более широком диапазоне pH. Коагулирование воды включает три стадии.
1.Образование коллоидного раствора гидроокиси металла в результате полного гидролиза коагулянта.
2.Коагуляцию образовавшегося золя коагулянта под действием анионов воды и его взаимодействие с коллоидными и грубодисперсными примесями воды.
3.Процесс хлопьеобразования, завершающийся седиментацией.
Коагуляция Fe(OH)3 или AL(OH)3 происходит за счёт сжатия диффузионного слоя коллоидных частиц. Противоионы диффузионного слоя переходят в адсорбционный, уменьшается электрокинетический потенциал (концентрационная коагуляция).
Скоагулировавшиеся частицы Fe(OH)3 и Al(OH)3 обладают хорошо развитой поверхностью и являются хорошими адсорбентами для коллоидных примесей воды.
Может иметь место взаимная коагуляция. Коагуляция коллоидов Al(OH)3 и Fe(OH)3 вызывается анионами (SO42-,HCO3-,Cl-) содержащимися в воде.
Процесс коагуляции идёт быстро, необходимо энергичное перемешивание. На процесс коагуляции влияет температура (устойчивость коллоидов увеличивается, т.к. увеличивается тепловое движение частиц).
Количество введённого в воду коагулянта (мг/л, мг-экв/л, г/м3, г-экв/м3) называется дозой коагулянта.
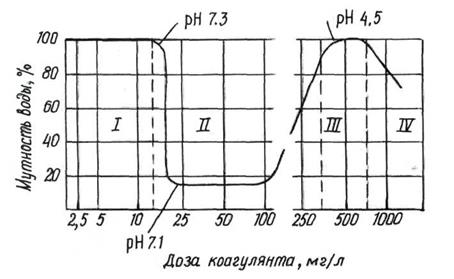
|
|
Минимальная концентрация коагулянта, отвечающая наибольшему осветлению или обесцвечиванию воды, называется оптимальной дозой коагулянта. Она определяется опытным путём и зависит от солевого состава, жесткости, щелочности и т.д.
Рис.12. Кривая коагуляции.
Оптимальной дозой считается минимальное количество коагулянта, которое при пробном коагулировании даёт крупные хлопья и максимальную прозрачность воды через 15-20 минут.
Во время паводка доза увеличивается на 50 %. При температуре ниже 4 0С дозу увеличивают в 2 раза.
Мягкие воды плохо коагулируются (мало анионов). Для цветных вод:
Д=4√Ц,
где Д – доза Al2(SO4)3 мг/л
Ц – цветность воды по платиново-кобальтовой шкале, град.
При малой щелочности и низкой температуре проводят коагуляцию с подщелачиванием. Обычно используют известь и соду. При этом:
2FeCl3 + 3Ca(OH)2 → 2Fe(OH)3 ↓+ 3CaCl2
Al2(SO4)3 + Na2CO3 + H2O → Al(OH)3 + Na2SO4 + H2CO3
Количество щёлочи определяют:
Дщ = Дк – Щ + 1 ,
где Дщ – доза щёлочи, мг-экв/л;
Дк – доза коагулянта, мг-экв/л;
Щ – щелочность воды, мг-экв/л;
1 – избыток щелочного реагента, мг-экв/л.
Характеристика коагулянтов
1.Сульфат алюминия (сернокислый глинозем) Al2(SO4)3∙18H2O применяется для осветления и обесцвечивания воды. При отсутствии щелочного резерва вызывает снижение pH до 4,5 и вода становится агрессивной по отношению к железу и бетону.
2.Основной хлорид алюминия Al2(OH)5Cl ∙ 6H2O
3.Алюминат натрия NaAlO2, используется если увеличение солесодержащих за счёт анионов коагулянтов нежелательно
4.Хлорид железа III FeCO3 ∙ 6 H2O, для осветления воды.
5.Сульфат железа III Fe2(SO4)3, обладает сильным коррозионным действием по отношению к железу и бетону.
6.Сульфат железа II FeSO4 ∙ 7H2O, коагулирование осуществляется в щелочной среде (с известью).
FeSO4 + Ca(OH)2 → Fe(OH)2 + CaSO4
4Fe(OH)2 + O2 + 2H2O → 4 Fe(OH)3
В этом случае из воды удаляется до 50 % органических примесей. Применяется для осветления технических вод.
Преимущества железных коагулянтов:
- меньшая зависимость от солевого состава и pH;
- меньшая зависимость от температуры;
- осаждение быстрее, так как хлопья имеют большую плотность;
- коагель Fe(OH)3 – хороший адсорбент для органических соединений, соединений меди, мышьяка, марганца и др.
Недостатки:
- высокая коррозийная активность;
- применение только для осветления.
Характеристика флокулянтов
Для интенсификации очистки воды методом коагулирования применяются дополнительные реагенты – флокулянты, позволяющие ускорить процесс хлопьеобразования.
Используются следующие классы:
- неорганические (активированная кремниевая кислота);
- органические ВМС;
- синтетические ВМС (полиакриламид, полиэтиленимин и т.д.).
Механизм действия основан на адсорбции макромолекул флокулянта скоагулировавшими или взвешенными частицами. Процесс флокуляции включает три стадии:
1.Адсорбцию.
2.Образование мостикоподобной структуры.
3.Собственно флокуляцию.
|
|
Рис.13.Схема образования хлопьев в присутствии высокомолекулярного флокулянта.
Если адсорбция макромолекул на поверхности частицы не сопровождается взаимодействием между образующимися агрегатами, то происходит стабилизация системы (явление защиты).
1.Полиакриламид (ПАА)
Полимер содержит полиамидные

-CH2-CH-
│
O= C-NH2
n
и кислотные звенья.

-CH2-CH-
│
COOH
n
2. Активированная кремниевая кислота.
Получают при взаимодействии жидкого стекла (Na2O ∙ n SiO2∙mH2O) с неорганическими кислотами. При этом получают оксиды кремния с различной степенью гидратации (SiO2 ∙ nH2O).
3.Катионный флокулянт ВА-2 это полимер с образованием активного катиона. Он является эффективным коагулянтом коллоидов имеющих отрицательный заряд.
 -CH2-CH2-
-CH2-CH2-
│

│
CH2-N+(CH3)3Cl- n
Катионы флокулянты ВА -212 и ВА -202, представляющие собой четвертичные аммониевые соли на основе полистирола и поливинилтолуола, разрешены для обработки питьевой воды. ПДК таких флокулянтов в воде составляют 2 мг/л.
ТЕМА 2. ТРЕБОВАНИЯ, ПРЕДЪЯВЛЯЕМЫЕ К ВОДЕ ХОЗЯЙСТВЕННО - БЫТОВОГО И ПРОМЫШЛЕННОГО ВОДОСНАБЖЕНИЯ
1. Указать правильное утверждение:
а) требования к воде промышленного водоснабжения определяются технологией производства;
б) требования к воде промышленного водоснабжения едины ко всем видам водопользования;
в) требования к воде промышленного водоснабжения обусловлены проблемой сброса вод в открытые водоемы.
2. Указать ПДК по железу для вод применяемых для охлаждения:
а) 0,01 мг/л;
б) 10 мг/л;
в) 0,1 мг/л.
3. Указать ПДК по сероводороду для воды, применяемой в качестве охлаждающей жидкости:
а) ПДК  ≤ 0,5 мг/л;
≤ 0,5 мг/л;
б) ПДК  ≥ 0,5 мг/л;
≥ 0,5 мг/л;
в) ПДК 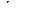 = 0,5 мг/л;
= 0,5 мг/л;
4. ПДК по жесткости на воду, применяемую для охлаждения:
а) 4 ммоль/дм3;
б) 0,17 ммоль/дм3;
в) 2,8 ммоль/дм3.
5. Требования к воде, идущей на питание паровых котлов:
а) Общая жесткость 0,017 ммоль/л; минимальные значения растворенного кислорода и солесодержания;
б) Общая жесткость 2,8 ммоль/дм3 ; минимальное солесодержание;
в) Карбонатная жесткость 0,017; минимальное значение растворенного кислорода; солесодержание не лимитируется.
6. Указать правильное утверждение: первая группа примесей воды, по отношению ее к дисперсной среде -…
а) это нерастворимые в воде примеси, образующие коллоидные растворы, подверженные седиментации;
б) это нерастворимые в воде примеси, образующие кинетически неустойчивые системы;
в) это растворимые в воде примеси, образующие кинетически устойчивые системы – истинные растворы.
7. Вторая группа примесей воды по отношению их к дисперсионной среде – это:
а) грубодисперсные системы, удаляемые флотацией и электрофорезом;
б) истинные растворы, к которым применимы реагентные методы;
в) коллоидные примеси, выделяемые из воды введением реагентов, вызывающих их коагуляцию.
8. Третья группа примесей воды по отношению их к дисперсной среде, это-
а) коллоидные растворы, удаляемые методом коагуляции;
б) грубодисперсные системы кинетически неустойчивые и склонные к содиментации;
в) молекулярные растворы, образующие гомогенные растворы и удаляющиеся химическими реагентами.
9. Какие примеси природных вод относятся к третьей группе по их отношению к дисперсионной среде:
а) газы, органические вещества, продукты жизнедеятельности водных организмов;
б) коллоидные растворы, продукты распада органики;
в) грубодисперсные системы – взвеси, эмульсии, зоо – и фитопланктон.
10. Какими методами удаляются примеси воды, относящиеся к четвертой группе по их соотношению к дисперсной среде?
а) флотация, электрофорез, адгезия;
б) электрофорез, коагуляция, адгезия;
в) ионный обмен, электродиализ.
11. Что такое адгезия?
а) прилипание частиц к поверхности сорбента;
б) разрушение частиц под действием электрического тока;
в) введение реагентов, вызывающих агрегирование частиц.
12. На каких методах основано удаление примесей воды, относящихся к первой группе по их отношению к дисперсионной среде?
а) электрофорез, коагуляция;
б) седиментация, адгезия;
в) ионный обмен, электродиализ.
13. Какие ионы обуславливают общую жесткость воды:
а) Са2+, Mg2+;
б) Na2+, K+;
в) Mg2+, Fe2+.
14. Какие соли обуславливают временную жесткость воды:
а) Ca(HCO3)2, CaCO3, MgCO3;
б) Mg(HCO3)2, Ca(HCO3)2;
в) MgCO3, Mg(HCO3)2.
15. Какие соли обуславливают постоянную жесткость воды:
а) Ca(HCO3)2, CaCl, CaSO4;
б) MgCO3, MgCl2, Mg(HCO3)2;
в) CaCl2, MgCl2, CaSO4, MgCO3.
16. Чему равен один миллиграмм – эквивалент ионов Са2+ ?
а) 20 мг;
б) 20 г;
в) 20∙ 10-3 мг.
17. Чему равна жесткость воды (моль/дм3) обусловленная содержанием Са2+ равным 20 мг/л.
а) 1 ммоль /дм3;
б) 20 ммоль /дм3;
в) 1∙ 10-3 ммоль/дм3.
18. Жесткость воды составляет 1,5 ммоль/дм3 .
а) это вода средней жесткости;
б) это мягкая вода;
в) это вода очень мягкая.
19. По какому критерию жесткость воды относится к карбонатной?
а) по существенному аниону;
б) по сопутствующему катиону;
в) по величине жесткости.
20. Как устраняется временная жесткость воды?
а) кипячением в течение часа;
б) применением железных и алюминиевых реагентов;
в) методом дегезации.
21. Указать продукты, образующиеся при термическом методе умягчения воды:
а)CaCO3, Mg (OH)2;
б)CaCl2, MgCl2;
в)Ca(OH)2, Mg(OH)2.
22. Какой газ образуется при термическом методе умягчения воды:
а) кислород;
б) углекислый газ;
в) сероводород.
23. На чем основаны реагентные методы умягчения воды:
а) перевод ионов Са2+, Mg2+ в газообразные соединения;
б) перевод ионов Са2+, Mg2+ в труднорастворимые соединения;
в) перевод ионов Са2+, Mg2+ в коллоидную фракцию с последующей коагуляцией.
24. От чего зависит остаточная концентрация Са2+ и М g2+ при применении реагентных методов умягчения воды:
а) от величины произведения растворимости образующихся соединений;
б) от величины константы гидролиза образующихся соединений;
в) от величины константы диссоциации и электродных потенциалов образующихся соединений.
25. Что такое известкование воды?
а) это перевод заметно растворяемых гидрокарбонатов кальция и магния в труднорастворимые соединения;
б) это образование хлоридов и сульфатов Са2+ и Mg2+ в целях умягчения воды;
в) это умягчение воды с образованием извести и последующем ее осаждении.
26. Какие соединения образуются при взаимодействии извести с гидрокарбонатом магния?
а) Гидроксид магния, карбонат кальция и вода;
б) Гидрокарбонат кальция, оксид магния и вода;
в) Оксид кальция, гидроксид магния и вода.
27. Какие соединения образуются при взаимодействии извести с гидрокарбонатом магния?
а) Гидроксид магния, карбонат кальция и вода;
б) Гидрокарбонат кальция, оксид магния и вода;
в) Оксид кальция, гидроксид магния и вода.
28. Какие цели достигаются при известковании воды?
а) снижаются: постоянная жесткость, величина рН, меняется углекислое равновесие;
б) снижаются: карбонатная жесткость, общее солесодержание, концентрация свободной угольной кислоты;
в) снижаются: общая жесткость, величина рН, концентрация растворенного кислорода.
29. Какие приемы используются для более полного умягчения воды.
а) повышение давления, увеличение рН, увеличение температуры;
б) повышение температуры, перемешивание, создание избытка извести;
в) повышение температуры, создание избытка извести, введение катализатора.
30. Как связаны между собой окисляемость воды и формирование осадка при известковании воды.
а) чем выше окисляемость воды, тем хуже кристаллизация осадка;
б) чем ниже окисляемость , тем хуже кристаллизация осадка;
в) формирование осадка при известковании воды не зависит от величины окисляемости воды.
31. Указать выражение для определения оптимальной дозы извести:
а) Ди = 28[ЖК + 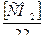 + 0,5]
+ 0,5]  ;
;
б) Ди = 28[Ж + 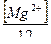 + 0,5]
+ 0,5] 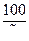 ;
;
в) Ди = 28[ЖК + 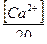 + 0,5]
+ 0,5] 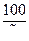 .
.
32. Сущность содово – известкового метода умягчения воды:
а) обработка воды карбонатом натрия и гидроксидом кальция;
б) обработка воды карбонатом магния и гидроксидом магния;
в) обработка воды гидроксидом кальция и карбонатом кальция.
33. Какая реакция протекает при добавлении в воду соды?
а) CaSO4 + Na2CO3 = CaCO3 ↓ + Na2SO4 ;
б) CaSO4 + 2NaCl = CaCl2 + Na2SO4;
в) CaSO4 + 2NaOH = Ca(OH)2 + Na2SO4 ;
34. Указать выражение, по которому рассчитывается доза соды при содово - известковом методе умягчения воды.
а) Дс = 53 [ЖНК + 1]  ;
;
б) Дс = 53 [Жобщ + 1] 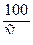 ;
;
в) Дс = 53 [Ж + 1]  ;
;
35. Преимущества термохимического метода умягчения воды.
а) образование крупных хлопьев, уменьшение дозы извести, степень умягчения воды 0,2 -0,3 мг –экв/л.;
б) уменьшение солесодержания, понижение величины жесткости до нуля, нейтральная реакция среды;
в) уменьшение дозы извести, улучшение органолептических свойств воды, снижение содержания газов.
36. Недостатками реагентных методов умягчения воды являются:
а) недостаточная степень умягчения, расход продуктов, сложность технологического осуществления;
б) расход энергии, сложность технологического осуществления, высокая степень умягчения;
в) расход реагентов, расход энергии, сложность осуществления.
37. Достоинства ионообменного метода умягчения воды.
а) не образуется осадка, не нужно дозирование реагента, уменьшение содержания;
б) дозировка реагента, плотный осадок, регуляция солесодержания;
в) улучшение органолептических свойств воды, снижение содержания газов.
38. Статистически объемная емкость – это:
а) число мг –эквивалентов ионов, обменивающихся при контакте раствора с определенным количеством ионитов;
б) определяется количеством ионов, поглощенных объемом набухшего ионита в процессе фильтрования до появления этих ионов в фильтрате;
в) характеризуется общим числом активных групп ионита в единице объема смолы.
39. Катионит универсальный КУ -2 , это:
а) сополимер метилметакрилата с дивинилбензолом.
б) сульфированный сополимер стирола с дивинилбензолом.
в) продукт обработки бурого угля серной кислотой.
40. Что такое обессоливание воды?
а) Метод обработки воды, направленный на снижение общего солесодержания.
б) Частный случай опреснения воды.
в) Метод обработки воды приводящий к осветлению и обесцвечиванию воды.
ТЕМА 4. ХИМИЧЕСКИЕ МЕТОДЫ
ОЧИСТКИ СТОЧНЫХ ВОД.
1. Какие методы используются при очистке сточных вод от тяжелых металлов:
а) осаждения;
б) окисления;
в) гидролиза.
2. Указать схему процесса удаления из сточных вод ионов цинка:
а)Zn2+ + 2 OH- = Zn(OH)2
б) Zn+ SO4 2- = ZnSO4
в) Zn+ 2Cl - = ZnCl2
3. Указать схему процесса удаления из сточных вод ионов никеля:
а) Ni 2+ + 2 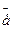 = Ni 0
= Ni 0
б) Ni + PO43+= Ni 3(PO4)2
в) Ni 2++ 2 OH- = Ni(OH)2
4. Указать схему процесса удалении из сточных вод ионов меди:
а) Сu2+ + 2 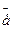 = Cu 0
= Cu 0
б) )Сu2+ + 2 OH- = Cu(OH)2
в) Zn 2++ Cl2 = CuCl2
5. Какие соединения образуются при действии соды на сточные воды, содержащие ионы тяжелых металлов:
а) труднорастворимые карбонаты;
б) труднорастворимые фосфаты;
в) нерастворимые гидроксиды.
6. Указать схему процесса (в ионом виде) удаления из сточных вод меди действием соды:
а) 2Cu2++CO32- +2OH-→ (CuOH)2CO3;
б) Cu2+ +Na2CO3 → CuCO3+ 2Na+;
в) Cu2+ + Na2CO3+ H2O → (CuOH)2+2NaHCO3;
7. Указать схему процесса (в ионом виде) удаления из сточных вод никеля действием соды:
а) Ni2++CO32- +2OH-→ NiCO3 ;
б) Cu2+ +Na2CO3 → NiCO3+ 2Na+;
в) 2Ni2+ +CO32- +2OH- → (NiOH)2CO3;
8. Указать схему процесса (в ионом виде) удаления из сточных вод никеля действием соды:
а) Zn2++CO32- +2OH-→ ZnCO3;
б) Zn2+ +Na2CO3 → ZnCO3+ 2Na+;
в) 2Zn2+ +CO32- +2OH- → (ZnOH)2CO3.
9. На какие группы делятся сточные воды?
а) производственные, ливневые и бытовые;
б) производственные, поверхностные и подземные;
в) бытовые, поверхностные и ливневые.
10. Указать правильное утверждение:
а) производственные сточные воды образуются в результате практической жизнедеятельности людей;
б) Бытовые сточные воды образуются в результате практической деятельности и жизнедеятельности людей;
в) Бытовые сточные воды являются результатом производственной деятельности людей.
11. . Какой зависимости подчиняется концентрация загрязнений бытовых сточных вод (С):
а)  ;
;
б) 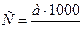 ;
;
в) C= q∙1000∙ a.
12..Указать минеральные загрязнения сточных вод:
а) соли аммония, фосфаты, хлориды;
б) фосфаты, хлориды жирные кислоты;
в) ПАВ, соли аммония, хлориды, сульфаты.
13. Что представляет из себя твердая фаза, выпадающая при медленном движении и отстаивании бытовых сточных вод:
а) коагулирующие коллоидные системы – гели;
б) частицы песка, шлаки, волокна, органика различного происхождения;
в) шлаки, волокна, гидроксиды и карбонаты металлов.
14. На какие две группы можно разделить органические вещества бытовых сточных вод?
а) серусодержащие и непредельные углеводороды;
б) безазотистые и азотсодержащие вещества;
в) углеводороды и жироподобные соединения.
15. Каким способом достигается наиболее полное осаждение ионов Zn2+:
а) обработкой сульфидом натрия;
б) обработкой сульфатом натрия;
в) обработкой тиасульфатом натрия.
16. Каким способом достигается наиболее полное осаждение ионов ртути:
а) обработкой хлоридом серебра;
б) обработкой сульфидом серебра;
в) обработкой нитратом натрия.
17. Какие вещества образуются при обработке воды сульфидом натрия в присутствии в воде ионов цинка и ртути:
а) HgS и ZnS;
б) HgSO4 и ZnSO4;
в) HgS и ZnSO4.
18. Что является недостатком метода удаления из сточных вод металлов с помощью сульфида натрия:
а) образование тонкодисперсного осадка;
б) образование сероводорода при понижении рН;
в) образование сероводорода при повышении рН.
19. Какие методы используют для удаления цианидов?
а) окисление хлором и хлорной известью;
б) восстановление сульфидами и тиасульфатом натрия;
в) осаждение гидроскидами и известкование воды.
20. Какие вещества образуются на завершающей стадии удаления цианидов из сточных вод методом окисления хлором в щелочной среде:
а) NaCNO, NaCl, H2O;
б) (NH4)2CO3, Na2CO3;
в) NaCNO, Na2CO3, H2O.
21. Какой метод применяют при очистке сточных вод от шестивалентного хрома:
а) окисление и осаждение в виде гидроксида трехвалентного хрома;
б) восстановление и осаждение в виде гидроксида трехвалентного хрома;
в) окисление и осаждение в виде гидроксида шестивалентного хрома.
22. Какие методы используются для доочистки сточных вод от органических соединений:
а) окислительные;
б) восстановительные;
в) ионный обмен.
23. Какие вещества применяются при очистке сточных вод от органических загрязнений:
а) Na2S2O3 , O3 , KMnO4;
б) Cl2, O3 , KMnO4;
в) Ca(OH)2, Na2CO3, KMnO4.
24. Указать правильное утверждение:
а) химические методы являются конденсационными;
б) химические методы очистки сточных вод являются регенеративными;
в) химические методы очистки сточных вод являются деструктивными.
25. Формы нахождения железа в природных водах:
а) Fe(HCO3), FeSO4;
б) FeS2, FeCl3;
в) Fe(HCO3)2, FeCO3.
26. Указать правильное утверждение.
а) при выходе подземных вод на поверхность происходит окисление Fe2+ до Fe3+;
б) при выходе подземных вод на поверхность трехвалентное железо восстанавливается до двухвалентного;
в) подземные воды при выходе на поверхность под действием атмосферы восстанавливаются с образованием Fe(OH)3.
27. ПДК по железу в питьевой воде:
а) 0,3 мг/л
б) 0,1 мг/л
в) 0,03 мг/л
28. Какие процессы протекают при обезжелезивании воды?
а) окисление и гидролиз;
б) восстановление и окисление;
в) гидролиз и восстановление.
29. Какой продукт образуется в результате насыщения воды кислородом с целью обезжелезивания воды:
а) Fe(OH)2;
б) Fe(HCO3)2;
в) Fe(OH)3.
30. ПДК по марганцу для питьевой воды:
а) 0,3 мг/л;
б) 0,05 мг/л;
в) 0,1 мг/л.
31. Формы марганца в природной воде:
а) гидрокарбонат и сульфат марганца, органические соединения;
б) органические соединения марганца, хлорид и карбонат марганца;
в) гидрокарбонат, сульфат, хлорид и сульфид марганца.
32. Методы деманганирования воды:
а) обработка содой и известью;
б) известкование и аэрация;
в) восстановление и аэрация.
33. Какое соединение марганца образуется при деманганировании воды с применением окислителей:
а) MnO2;
б) Mn(OH)4;
в) KMnO4.
34. Указать процесс, протекающий при деманганировании воды с применением в качестве окислителя озона:
а) Mn(OH)2 + O3 +H2O↔Mn(OH)4 ↓ +O2;
б) MnSO4 + O3 + H2O ↔ MnO2 ↓ + O2 + H2SO4;
в) MnSO4 + O3 + 3H2O ↔ Mn(OH)4 ↓ + H2SO4 +O2.
35. Указать процесс, протекающий при деманганировании воды с применением в качестве окислителя диоксида хлора:
а) Mn(OH)2 + 2ClO2 +H2O=Mn(OH)4 ↓ + Cl2 +1,5O2;
б) MnSO4 + ClO2 + H2O = MnO2 ↓ +HCl+ H2SO4;
в) KMnO4 + ClO2 + 2H2O = Mn(OH)4 ↓ + KCl + 2O2.
36. Указать процесс, протекающий при деманганировании воды с применением в качестве окислителя перманганата калия:
а) 2MnSO4 + 2KMnO4 + H2O = 4MnO2 ↓ +K2SO4+ H2SO4;
б) KMnO4 + MnO+ H2O = KOH +2 Mn(OH)4↓;
в) MnSO4 + 2 KMnO4+ 6H2O = 3Mn(OH)4 ↓ + K2SO4.
37. Фторирование воды производится с применением реактивов:.
а) NaF, Na2SiF6, H2SiF6;
б) NaF, F2, AgF;
в) H2SiF6, AgF.
38. В каком виде присутствует в воде свободная кремниевая кислота:
а) SiO2 ∙2H2O;
б) SiO2 ∙CaO;
в) SiO3 ∙7H2O.
39. Методы удаления сероводорода:
а) с помощью восстановителей SO2, Na2SO3;
б) известкованием с применением Ca(OH)2, NaOH;
в) с помощью хлора Cl2.
40. Кислород удаляется:
а) с помощью восстановителей SO2, Na2SO3
б) с помощью окислителей KMnO4, O3.
в) при хлорировании воды.
ИТОГОВЫЕ ТЕСТЫ
1. Почему молекулы воды могут взаимодействовать друг с другом?
а) т.к. молекулы воды имеют дипольные моменты;
б) т.к. в воде наблюдаются аномами плотности;
в) т.к. у воды высокая диэлектрическая проницаемость.
2. Дисперсная система с размерами частиц дисперсной фазы более 100 нм это:
а) коллоидный раствор;
б) грубодисперсная система;
в) истинный раствор.
3. Указать правильное утверждение:
а) при увеличении температуры растворимость кристаллических тел уменьшается;
б) температура не влияет на растворимость кристаллических тел;
в) при увеличении температуры растворимость кристаллических тел увеличивается.
4. Насыщенный раствор это:
а) раствор, находящийся в динамическом равновесии с избытком растворимого вещества;
б) раствор с высокой концентрацией растворимого вещества;
в) раствор в котором избыточное вещество выкристаллизовывается при встряхивании или внесении в раствор центров кристаллизации.
5. Молярность выражается:
а) числом молей вещества в 1 литре растворителя;
б) числом молей в 1 литре раствора;
в) числом молей в 1 кг (1000 г) растворителя.
6. Что является причиной того, что морские бактерии и рыбы не могут жить в пресной воде:
а) явление осмоса;
б) органические свойства воды;
в) физические свойства воды.
7. Для реакции А + В ↔ С + Д  > 0 ; в каком направлении будет протекать реакция:
> 0 ; в каком направлении будет протекать реакция:
а) в прямом;
б) в обратном;
в) устанавливается термодинамическое равновесие.
8. Указать выражение константы диссоциации для процесса диссоциации, протекающий по уравнению СН3СООН ↔ СН3СОО- + Н+:
а) 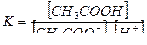 ;
;
б) 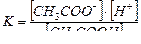 ;
;
в) 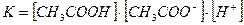 .
.
9. Указать выражение для ионного произведения воды (КВ):
а)  ;
;
б) 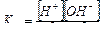 ;
;
в) 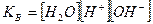 .
.
10. Определить величину рН если [ OH-] = 1 ∙ 10-2 моль/л:
а) 1 ∙ 1014;
б) 12;
в) 2.
11. Для выражения общей кислотности служит:
а) водородный показатель (рН);
б) нормальность раствора;
в) молярность раствора.
12. Указать буферные растворы:
а) CH3COOH и H2CO3;
б) NH4OH и NaOH;
в) NH4OH и NH4Cl.
13. Указать реакцию среды раствора ZnCl2:
а) щелочная;
б) слабокислая;
в) кислая.
14. Для золя сульфата бария, полученного сливанием одинаковых объемов сильноразбавленного раствора хлорида бария и концентрированной серной кислоты потенциалобразующим ионом будет:
а) 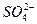 ;
;
б) Ba2+;
в) Cl-.
15. Мерой устойчивости коллоидной системы является:
а) электрохимический потенциал;
б) термодинамический потенциал;
в) двойной электрический слой.
16. Процесс обратный коагуляции:
а) пептизация;
б) диссоциация;
в) седиментация.
17. Для электроположительного золя AgJ наиболее эффективными ионами коагуляторами будут:
а) SO  ;
;
б) Al3+;
в) Сl-.
18. Метод определения мутности воды:
а) нефелометрия;
б) титрование;
в) рН – метрия.
19. На величину ХПК оказывают влияние:
а) CH3COOH и С6Н6;
б) С2Н5ОН и NaNO3;
в) H2SO4 и NaCl.
20. Назвать флокулянт:
а) Полиакриламид;
б) сульфат алюминия;
в) фенолформальдегидные смолы.
21. Веществами, обладающими бактерицидными свойствами является:
а) NaCl, NaOCl;
б) NaOCl, СlO2;
в) СaCl2O, HCl.
22. Для устранения хлорфенольных запахов применяется:
а) хлор-медный метод;
б) хлорирование с аммонизацией;
в) дехлорирование.
23. Олигодинамия это:
а) обеззараживание воды ионами серебра;
б) обработка воды ультрафиолетовыми лучами;
в) обеззараживание воды физическими методами.
24. Временная жесткость обуславливается солями:
а) СаСО3, CaCl2;
б) Сa(HCO3)2, Mg(HCO3)2;
в) MgCO3, CaSO4.
25. Какой процесс лежит в основе умягчения воды:
а) образование нерастворимых соединений кальция и магния;
б) образование газообразных продуктов;
в) коагуляция.
26. Какие соединения образуются при добавлении в воду Cа(ОН)2:
а) СаСО3, MgCO3;
б) СаО, MgO;
в) Mg(OH)2, Ca(HCO3)2.
27. Указать схему, соответствующую умягчению воды методом ионного обмена:
а) R – H + Ca2+ = R2Ca + H+;
б) Mg(HCO3)2 + Ca(OH)2 = Mg(OH)2 + Ca(HCO3)2;
в) R – OH + Сl- = R – Cl + OH-.
28. Бактерии, способные развиваться в бескислородной среде:
а) аэробы;
б) анаэробы;
в) прокариоты;
29. Условно-патогенный организм:
а) кишечная палочка;
б) инфузория;
в) коловратка.
30. Бактерии, использующие углерод неорганических соединений:
а) автотрофы;
б) гетеротрофы;
в) сапрофиты.
31. Указать правильное утверждение:
а) ХПК это часть БПК;
б) БПК это часть ХПК;
в) ХПК и БПК равны между собой.
32. На величину БПК оказывают влияние:
а) H2SO4, NaCl;
б) СН3СООН, NaCl;
в) С2Н5ОН, СН3СООН.
33. Из общей массы гидросферы доля пресных вод составляет:
а) до 1%;
б) от 2% до 5%;
в) от 20%.
34. К главным ионам, доля которых в любых природных поверхностных водах превышает 95% от общей массы катионов или анионов, относятся следующие группы анионов и катионов (выберите правильный набор):
а) Na+, K+, Ca2+, Mg2+, Fe3+;
б) Na+, K+, Fe3+, SiO  ;
;
в) Na+, K+, Ca2+, Fe3+.
35. Как правильно называются морские воды в соответствии с классификацией природных вод:
а) сульфатно-кальциевые, 3-й группы;
б) сульфатно-натриевые, 3-й группы;
в) хлоридно- натриевые, 3-й группы.
36. Значение щелочности природных вод определяется суммой концентраций ионов:
а) СО  и SO
и SO 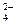 ;
;
б) HCO 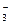 , ОН- и удвоенной концентрации СО
, ОН- и удвоенной концентрации СО 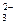 ;
;
в) HCO 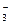 , ОН- и удвоенной концентрации ОН-.
, ОН- и удвоенной концентрации ОН-.
37. Каким может быть содержание растворенного кислорода у дна глубоко озера на территории с умеренным климатом в конце периода стратификации?
а) равно нулю;
б) больше чем у поверхности;
в) составляет 50-70% от насыщения.
38. Каково содержание растворенного кислорода у дна океана в любое время года:
а) составляет 50-70% от значений, являющихся равновесными для соответствующих условий;
б) в полтора раза выше чем у поверхности;
в) равно нулю.
39. Какое из утверждений правильно характеризует грунтовые воды?
а) грунтовыми называются подземные воды, расположенные на первом от поверхности земли водоупорном слое, имеющим значительную площадь распространения;
б) основную опасность для загрязнения грунтовых вод соединениями тяжелых металлов представляют выбросы автотранспорта;
в) грунтовые воды лежат в зоне аэрации и лежат между двумя водоупорными слоями.
40. Выберите правильный набор катионов, определяющих жесткость природной воды:
а) Na+, K+, Ca2+;
б) Fe2+, Ca2+, Na+;
в) Сa2+, Mg2+.
41. Каково значение щелочности Мирового океана:
а) 2,29 ∙ 10-3 моль/л;
б) 140 м2/л;
в) 2,29 моль/л.
42. Эвторификация водоемов приводит:
а) к улучшению гомеостаза экосистемы;
б) к росту биомассы синезеленых водорослей, приводящему к уменьшению концентрации кислорода.
в) к уменьшению количества растворенного кислорода в результате связывания его с молекулами загрязняющих веществ.
43. Какие природные источники поступления главных ионов в подземные воды Вы знаете:
а) хозяйственная деятельность человека;
б) растворение минералов и грунтов залегания;
в) атмосферные осадки.
44. Биологическая очистка основана на том что:
а) мелкораздробленная взвесь, коллоидные и растворенные вещества разрушаются в процессе жизнедеятельности аэробных микроорганизмов;
б) микроорганизмы воды уничтожаются бактерицидными веществами;
в) бактериальные формы удаляются с помощью процесса химической коагуляции.
45. Назвать гетеротрофные микроорганизмы:
а) хламидомонада;
б) спирогира;
в) амеба обыкновенная.
46. Естественная кислотность обусловлена:
а) содержанием слабых органических кислот природного происхождения (например, гуминовых);
б) содержанием серной и соляной кислот;
в) содержанием летучих оснований.
47. Типы химического состава воды определяет:
а) концентрации органических веществ;
б) соотношение концентраций в воде главных ионов (мг∙экв/л);
в) щелочность и кислотность воды.
48. На чем основан метод определения массовой концентрации сульфат-анионов?
а) на реакции сульфат-анионов с катионами бария с образованием сульфита бария;
б) с раствором нитрата серебра (взаимодействие);
в) на взаимодействие с хроматом серебра.
49. Переход аммонийных соединений в нитриты обусловлен:
а) деятельностью нитратобразующих бактерий в аэробных условиях;
б) микробиологическим разложением белков животного происхождения;
в) микробным разложением белков растительного происхождения.
50. Определению соединений фтора в воде мешают:
а) соединения Са и Mg;
б) соединения Al, Fe и органических веществ;
в) сульфаты.
51. Тяжелые металлы по характеру биологического воздействия делятся на:
а) микроэлементы и биогенные элементы;
б) токсиканты и биогенные элементы;
в) токсиканты и микроэлементы.
52. Токсиканты представлены следующими соединениями:
а) кадмий, свинец, ртуть;
б) марганец, медь;
в) кобальт, марганец.
53. ПДК для фенолов в питьевой воде уменьшается с 0,1 до 0,001 мг/л в связи с образованием соединений при:
а) озонировании;
б) хлорировании;
в) фторировании.
54. Сумма приведенных концентраций рассчитывается:
а) для всех загрязняющих веществ;
б) отдельно для органических и неорганических веществ;
в) для веществ с одинаковым лимитирующим показателем вредности.
55. Классы качества воды определяют по:
а) индексу загрязненности воды;
б) содержанию тяжелых металлов;
в) степени минерализации.
56. Если содержание солей в воде 100 – 200 мг/л, то это воды:
а) ультрапресные;
б) повышенной минерализации;
в) маломинерализованные;
57. Растворимость в воде О2 возрастает:
а) с уменьшением t и минерализации и увеличения р;
б) с увеличением t и минерализации и уменьшения р;
в) с уменьшением t и увеличения минерализации и р.
58. Какие еще соли относятся к солям жесткости кроме солей Mg и Са:
а) Na+ и Cu2+;
б) Sr2+ и Zn2+;
в) Fe2+ и Fe3+.
59. Цветность воды обусловлена присутствием:
а) ионов Са и Mg;
б) сульфатов и хлоридов;
в) гуминовых соединений и комплексных соединений железа.
60. Какими свойствами молекул воды объясняется аномально высокая температура кипения воды:
а) изотопный состав воды;
б) полярность молекул воды;
в) диэлектрическая проницаемость воды.
61. Дисперсные системы с размером частиц дисперсной фазы менее 1 нм это:
а) коллоидные растворы;
б) истинные растворы;
в) Указать правильное утверждение:
62. Указать правильное утверждение:
а) при увеличении температуры растворимость газов увеличивается;
б) при увеличении температуры растворимость газообразных веществ уменьшается;
в) изменение температуру не влияет на растворимость веществ.
63. Растворимостью вещества называется:
а) количество граммов вещества, насыщающее 100 г растворителя при данных условиях;
б) число молей вещества в 100 мл насыщенного раствора;
в) количество граммов вещества насыщающее 1 л растворителя.
64. Эквивалентная концентрация выражается:
а) числом молей вещества, эквивалентных 100 г растворителя;
б) число эквивалентов вещества в 1 литре раствора;
в) число эквивалентов вещества в 1 литре растворителя;
65. Указать формулу для расчета моляльной концентрации (С m):
а) Сm = mра-ля / 1000 ∙ Мв-ва;
б) Сm = mв-ва ∙ СМ ∙ Мв-ва;
в) Сm = 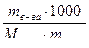 .
.
66. Указать правильное утверждение:
а) осмос это явление односторонней диффузии молекул растворителя через полупроницаемую мембран против градиента концентрации;
б) осмос это явление диффузии молекул растворенного вещества через полупроницаемую мембрану против градиента концентрации;
в) осмос это явление проникновения молекул вещества через полупроницаемую мембрану по градиенту концентрации.
67. Указать формулу для расчета осмотического давления:
а) 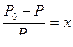 ;
;
б) р = СМRT;
в) р=kCм.
68. Возможно ли протекание процесса А + В = С, если  :
:
а) возможно;
б) невозможно;
в) в системе устанавливается состояние равновесия.
69. Указать правильное утверждение:
а) мольная доля компонента равна отношению числа молей этого компонента к сумме молей всех компонентов раствора;
б) мольная доля компонента это число моль данного компонента в 1 литре всего раствора;
в) мольная доля это отношение числа моль данного компонента к числу моль растворителя.
70. Указать формулу для расчета зависимости скорости реакции от температуры:
а) 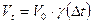 ;
;
б)  ;
;
в)  .
.
71. Какая из двух солей будет гидролизироваться сильнее Na2 CO3 или Na2 SO3?
а) Na2CO3;
б) Na2SO3;
в) гидролизу не подвергаются.
72. Какие соли не подвергаются гидролизу:
а) NaCl и NaNO3;
б) NaCl и Na2CO3;
в) NaNO3 и Na2SO3.
73. Определить рН раствора Na2 SO3:
а) среда кислая, рН < 7;
б) среда щелочная, рН > 7;
в) среда кислая, рН > 7.
74. Определить рН раствора соли NaCN:
а) среда щелочная, рН < 7;
б) среда кислая, рН < 7;
в) среда щелочная, рН > 7.
75. Концентрация ионов водорода составляет 10-7 моль/л. Определить реакцию среды и указать величину рН:
а) среда щелочная, рН = 7;
б) среда нейтральная, рН = 7;
в) среда кислая, рН = 7 .
76. Концентрация ионов ОН- равна 1 ∙ 10-5. Определить реакцию среды:
а) рН = 5, среда кислая;
б) рН = 9, среда щелочная;
в) рН = 2, среда кислая.
77. От чего зависит степень гидролиза соли:
а) температуры, концентрации раствора и рН среды;
б) температуры, рН среды и давления;
в) концентрации раствора.
78. Определить число степеней свободы (С) для системы, состоящей из чистой воды в твердой фазе:
а) С = 1;
б) С = 2;
в) С = 3.
80. Определить число степеней свободы (С) в точке х, лежащей внутри жидкой фазы (Диаграмма состояния воды):
а) С = 1;
б) С = 2;
в) С = 3.
81. Разность потенциалов подвижного и неподвижного слоев это:
а) термодинамический потенциал;
б) двойной электрический слой;
в) электрокинетический потенциал.
82. Максимальная разность потенциалов в мицелле золя на границе твердое вещество – раствор называется:
а) электрокинетический потенциал;
б) дзета – потенциал;
в) термодинамический потенциал.
83. Цветность природных вод обусловлена присутствием:
а) жирных кислот;
б) оксидов металлов;
в) гуматами и фульватами железа.
84. Цветность воды выражается:
а) в градусах;
б) в мг/л;
в) в баллах.
85. Сухой остаток характеризует:
а) нелетучие примеси воды;
б) солесодержащие и количество коллоидно растворенных примесей;
в) солесодержание и летучие примеси воды.
86. Окисляемость воды характеризует:
а) общее содержание в воде восстановителей;
б) общее содержание в воде органических восстановителей;
в) общее содержание в воде неорганических восстановителей.
87. Общую окисляемость определяют:
а) иодатным методом;
б) аргентометрия;
в) комплексометрия.
88. Частичная окисляемость определяется по реакции с:
а) бихроматом калия;
б) перманганатом калия;
в) иодидом калия.
89. Какие показатели качества воды коррелируют между собой:
а) мутность и щелочность воды;
б) ХПК и хлоремкость воды;
в) ХПК и электропроводность воды.
90. В каком соединении активного хлора будет больше?
а) HCl;
б) НОCl;
в) NaCl.
91. Снижение концентрации кислорода растворенного в воде свидетельствует о:
а) загрязнении воды окислителями;
б) загрязнение воды;
в) загрязнении воды восстановителями.
92. БПК характеризует загрязненность воды:
а) органическими веществами;
б) микроорганизмами;
в) органическими окислителями.
93. Определение оптимальной дозы коагулянта осуществляется:
а) расчетным путем;
б) экспериментальным путем;
в) сравнением цветности воды со стандартной шкалой цветности.
94. Подобрать наиболее эффективный коагулянт для электроотрицательного золя:
а) Al2(SO4)3;
б) Na3PO4;
в) FeCl2.
95. Какой заряд будет иметь мицелла золя AgJ, полученного при реакции;
AgNO3 + KJ = AgJ↓ + KNO3
KJ – в избытке:
а) отрицательный;
б) положительный;
в) заряд отсутствует.
96. Изоэлектрическое состояние мицеллы золя наблюдается в случае если:
а) электрокинетический потенциал равен 0;
б) термодинамический потенциал = 0;
в) дзета потенциал максимальный.
97. Интенсификация процесса коагулирования достигается за счет:
а) понижение температуры;
б) добавления флокулянтов;
в) добавления электронов.
98. Осаждение агрегатов мицелл в процессе коагуляции это:
а) пептизации;
б) диссоциация;
в) седиментация.
99. Указать вещества применимые для обесцвечивания и осветления воды:
а) сульфат алюминия и серная кислота;
б) сульфат алюминия и активированная кремниевая кислота;
в) полиакриламид и сода.
100. Указать реакцию лежащую в основе обеззараживания воды хлором:
а) Cl2 + H2O ↔ HCl + HOCl;
б) Cl2 + SO2 + H2O ↔ HCl + H2SO4;
в) Cl2 + Na2S2O3 + H2O ↔ 2HCl + Na2SO4 + S.
101.Импфирование воды заключается в:
а) перевода некарбонатной жесткости в карбонатную;
б) перевода карбонатной жесткости в некарбонатную;
в) перевода общей жесткости во временную.
102. Указать реакцию, выражающую химическую сущность импфирования воды:
а) Ca(HCO3)2 ↔ CaCO3 ↓ + CO2 + H2O;
б) MgCO3 + H2O ↔ Mg(OH)2 + CO2;
в) Са(HCO3)2 + 2HCl ↔ CaCl2 + 2H2O + 2CO2.
103. Указать процесс, соответствующий обезжелезыванию воды:
а) 4FeSO4 + 4Ca(OH)2 + 2H2O + O2 ↔ 4CaSO4 + 4Fe(OH)3;
б) FeCl3 + H2O = Fe(OH)3 ↓ + HCl;
в) FeSO4 + Ca(OH)2 ↔ Fe(OH)2 + CaSO4.
104. Удаление кремниевой кислоты можно осуществить:
а) подщелачиванием воды;
б) подкислением воды;
в) дегазацией воды.
105. Обескислороживание воды осуществляется с применением:
а) перманганата калия;
б) гидразина;
в) гидроксиламина.
106. Спорообразующие палочковидные формы бактерий называются:
а) кокки;
б) спириллы;
в) бациллы.
107. К извитым бактериям относятся:
а) спириллы и кокки;
б) кокки и бациллы;
в) вибрионы и спириллы.
108. Аккумулятором энергии в клетках бактерий являются:
а) ДНК, белки и углеводы;
б) углеводы;
в) АТФ.
109. Указать процесс денитрификации:
а) 4KNO3 + 5C → 2K2CO3 + 3CO2 + 2N2;
б) 2NH3 + 3O2 → 2HNO2 + 2H2O;
в) 2HNO2 + O2 → 2HNO3.
110. По способу питания эвглена зеленая относится к:
а) автотрофам;
б) гетеротрофам;
в) в зависимости от условий может использовать оба способа.
111. Укажите правильное утверждение:
а) бактериальная клетка имеет ядро, цитоплазму и оболочку;
б) бактериальная клетка имеет ядро, митохондрии и рибосомы;
в) бактериальная клетка не имеет оформленного ядра.
112. Органами движения у бактерий являются:
а) жгутики и реснички;
б) псевдоподии и жгутики;
в) псевдоподии и реснички.
113. Брожение это:
а) анаэробное разложение органики;
б) аэробное разложение белков;
в) анаэробное окисление жирных кислот.
114. Гомогенные примеси в воде, это:
а) взвешенные вещества;
б) ионные и молекулярные системы ;
в) мицеллы.
115. Буферные растворы обеспечивают:
а) постоянную t;
б) постоянную степень минерализации;
в) постоянное рН;
116. Бактерии и вирусы, находящиеся в воде образуют:
а) зоогели и зооколлоиды;
б) истинные растворы;
в) эмульсии.
117. Уравнение Лэнгмюра описывает сорбцию при концентрации примесей:
а) менее 0,01 моль/л;
б) более 0,5 моль/л;
в) менее 0,5 моль/л.
118. Величина удельной электропроводности примерно показывает:
а) суммарную концентрацию всех катионов;
б) концентрацию неэлктролитов;
в) суммарную концентрацию электролита.
119. Восстановительный тип геохимической обстановки в природных водах характеризуется величиной редокс потенциала:
а) Еn = 0 – 100 мВ;
б) Еn < 0;
в) Еn =100 – 150 мВ.
ПРИЛОЖЕНИЕ
Таблица 2
Ионная сила раствора
Таблица 3
Физические константы воды
| Молекулярная масса | 18,0154 |
| Плотность жидкой воды (250 С, 101,325 кПа), г/см3 | 0,9979751 |
| Теплота образования (-∆ Н при 250 С, 101,325 кПа), кДж/моль | |
| пар | 241,9845 |
| жидкая | 286,0313 |
| Теплота плавления (101,325 кПа), кДж/моль | 6,012 |
| Теплота испарения (101,325 кПа), кДж/моль | 44,041 |
| Удельная теплоемкость (101,325 кПа), кДж/(кг ∙ К) | |
| льда | 2,039 |
| жидкой воды | 4,187 |
| пара | 2,039 |
| Теплопроводность (101,325 кПа), Вт/(м ∙ К) | |
| льда (00 С) | ~2,34 |
| жидкой воды (200 С) | 0,598 |
| жидкой воды (450 С) | 0,645 |
| пара (1000 С) | 0,0231 |
| Скорость распространения звука при 250 С, (101,325 кПа), м/с | 1,4963 |
| Криоскопическая константа | 1,850 |
| Эбуллиоскопическая константа | 0,516 |
| Вязкость (250 С, 101,325 кПа), мПа ∙ с | 1,002 |
| Температура максимальной плотности (101,325 кПа), 0С | 3,98 |
| Диэлектрическая постоянная жидкой воды (170 С, 101,325 кПа, 60мГц) | 81 |
| Плотность льда (00 С, 101,325 кПа), г/см3 | 0,9168 |
| Диэлектрическая постоянная льда (-10 С, 101,325 кПа, 3000 Гц) | 79 |
| Поверхностное натяжение (20 0С, 101,325 кПа), Н/м | 72,5 ∙10-3 |
Таблица 4
| Показатели | Единицы измерения | Нормативы |
| Термотолерантные колиформные бактерии | Число бактерий в 100 мл 1) | Отсутствие |
| Общие колиформные бактерии 2) | Число бактерий в 100 мл 1) | Отсутствие |
| Общее микробное число 2) | Число образующих колоний бактерий в 1 мл | Не более 50 |
| Колифаги 3) | Число бляшкообразующих единиц (БОЕ) в 100 мл | Отсутствие |
| Споры сульфитредуцирующих клостридий 4) | Число спор в 20 мл | Отсутствие |
| Цислы лямблий 3) | Число цист в 50 л | Отсутствие |
Примечания:
1) при определении проводится трехкратное исследование по 100 мл отобранной пробы воды.
2) Превышение норматива не допускается в 95% проб, отбираемых в точках водоразбора наружной и внутренней водопроводной сети в течение 12 месяцев, при количестве исследуемых проб не менее 100 за год.
3) Определение проводится только в системах водоснабжения из поверхностных источников перед подачей воды в распределительную сеть.
4) Определение проводится при оценке эффективности технологии обработки воды.
Таблица 5
| Показатели | Единицы измерения | Нормативы, не более |
| Запах | Баллы | 2 |
| Привкус | - ,,- | 2 |
| Цветность | Градусы | 20(35) 1) |
| Мутность | ЕМФ (единицы мутности по формазину) или мг/л (по каолину) | 2,6(3,5) 1) 1,5 (2) 1) |
Примечание:
величина, указанная в скобках, может быть установлена по постановлению главного государственного санитарного врача по соответствующей территории для конкретной системы водоснабжения на основании оценки санитарно – эпидемиологической обстановки в населенном пункте и применяемой технологии водоподготовки.
Таблица 6
| Показатели | Единицы измерения | Нормативы (предельно – допустимые концентрации (ПДК), не более…) | Показатель вреднос- ти 1) | Класс опас- ности |
| Обобщенные показатели | ||||
| Водородный показатель | единицы рН | в пределах 6-9 | ||
| Общая минерализация (сухой остаток) | мг/л | 1000 (1500) 2) | ||
| Жесткость общая | ммоль/л | 7,0 (10) 2) | ||
| Окисляемость перманганатная | мг/л | 5,0 | ||
| Нефтепродукты, суммарно | мг/л | 0,1 | ||
| Поверхностно – активные вещества (ПАВ), анионо - активные | мг/л | 0,5 | ||
| Фенольный индекс | мг/л | 0,25 | ||
| Неорганические вещества | ||||
| Алюминий (Al3+) | мг/л | 0,5 | с. – т. | 2 |
| Барий (Ва2+) | -,,- | 0,1 | -,,- | 2 |
| Бериллий (Ве2+) | -,,- | 0,0002 | -,,- | 1 |
| Бор (В, суммарно) | -,,- | 0,5 | -,,- | 2 |
| Железо (Fe,суммарно) | -,,- | 0,3 (1,0) 2) орг | 3 | |
| Кадмий (Cd, суммарно) | -,,- | 0,001 | с. – т. | 2 |
| Марганец (Mn, суммарно) | -,,- | 0,1 (0,5) 2) | орг. | 3 |
| Медь (Cu), суммарно) | -,,- | 1,0 | -,,- | 3 |
| Молибден (Мо, суммарно) | -,,- | 0,25 | с. – т. | 2 |
| Мышьяк (Аs, суммарно) | -,,- | 0,05 | с. – т. | 2 |
| Никель (Ni, суммарно) | мг/л | 0,1 | с. – т. | 3 |
| Нитраты (NO3-) | -,,- | 45 | орг. | 3 |
| Ртуть (Hg, суммарно) | -,,- | 0,0005 | с. – т. | 1 |
| Свинец (Pb, суммарно) | -,,- | 0,03 | -,,- | 2 |
| Селен (Se, суммарно) | -,,- | 0,01 | -,,- | 2 |
| Стронций (Sr2+) | -,,- | 7,0 | -,,- | 2 |
| Сульфаты ( SO42-) | -,,- | 500 | орг | 4 |
| Фториды (F-) | ||||
| Для климатических районов | ||||
| -I и II | -,,- | 1,5 | с. – т. | 2 |
| - III | -,,- | 1,2 | -,,- | 2 |
| Хлориды (Cl-) | -,,- | 350 | орг. | 4 |
| Хром (Cr6+ ) | -,,- | 0,05 | с. – т. | 3 |
| Цианиды ( CN-) | -,,- | 0,035 | -,,- | 2 |
| Цинк (Zn2+ ) | -,,- | 5,0 | орг. | 3 |
| Органические вещества | ||||
| γ – ГХЦГ (линдан) | -,,- | 0,002 3) | с. – т. | 1 |
| ДДТ (сумма изомеров) | -,,- | 0,002 3) | -,,- | 2 |
| 2,4 -Д | -,,- | 0,03 3) | -,,- | 2 |
Примечания:
1) лимитирующий признак вредности, по которому установлен норматив: «с. –т.» - санитарно – технический, «орг.» - органолептический.
2) Величина, указанная в скобках, может быть установлена по постановлению главного государственного санитарного врача по соответствующей территории для конкретной системы водоснабжения на основании оценки санитарно – эпидемиологической обстановки в населенном пункте и применяемой технологии водоподготовки.
Таблица 7
| Показатели | Единицы измерения | Нормативы (предельно – допустимые концентрации (ПДК), не более…) | Показа-тель вреднос- ти 1) | Класс опас- ности |
| Хлор 1) | ||||
| - остаточный свободный | мг/л | В пределах 0,3-0,5 | орг. | 3 |
| - остаточный связанный | -,,- | В пределах 0,8-1,2 | -,,- | 3 |
| Хлороформ (при хлорировании воды) | -,,- | 0,2 2) | с.-т. | 2 |
| Озон остаточный 3) | -,,- | 0,3 | орг. | |
| Формальдегид (при озонировании воды) | -,,- | 0,05 | с.-т. | 2 |
| Полиакриламид | -,,- | 2,0 | -,,- | 2 |
| Активированная кремнекислота (по Si0 | -,,- | 10 | -,,- | 2 |
| Полифосфаты (по РО43-) | -,,- | 3,5 | орг. | 3 |
| Остаточные количества алюминий- и железосодержащих коагулянтов | -,,- | см. Показатели «Алюминий», «Железо» таблицы 5. |
Примечания:
1) при обеззараживании воды свободным хлором время его контакта с водой должно составлять не менее 30 минут, связанным хлором – не менее 60 минут.
Контроль за содержанием остаточного хлора производится перед подачей воды в распределительную сеть.
При одновременном присутствии в воде свободного и связанного хлора их общая концентрация не должна превышать 1,2 мг/л.
В отдельных случаях по согласованию с центром Госсанэпиднадзора может быть допущена повышенная концентрация хлора в питьевой воде.
2) Норматив принят в соответствии с рекомендациями ВОЗ.
3) Контроль за содержанием остаточного озона производится после камеры смешения при обеспечении времени контакта не менее 12 минут.
ОГЛАВЛЕНИЕ
| ПРЕДИСЛОВИЕ | 3 |
| ВВЕДЕНИЕ | 4 |
| 1. Вода (окись водорода) H2O 1.1 Распространенность в природе | 5 5 |
| 1.2. Физические свойства воды | 6 |
| 1.3 Строение молекулы воды | 7 |
| 1.4 Изотопный состав воды | 7 |
| 1.5 Понятие о системах, фазах и компонентах | 7 |
| 1.6. Диаграмма состояния воды | 8 |
| 2. Растворимость веществ в воде | 9 |
| 2.1 Растворимость газов | 9 |
| 2.2 Растворимость твердых веществ | 10 |
| 2.3 Взаимная растворимость жидкостей | 10 |
| 2.4 Свойства растворов | 10 |
| 2.5 Теория сильных электролитов | 11 |
| 2.6 Коэффициент активности (ν) | 12 |
| 2.7 Произведение растворимости | 13 |
| 3. Гидролиз солей | 14 |
| 3.1. Механизм протекания реакций гидролиза | 14 |
| 3.2 Гидролиз хлора | 16 |
| 3.3 Буферные растворы | 16 |
| 3.4 Диссоциация воды, активная реакция среды | 17 |
| 3.5 Активная и общая кислотность | 18 |
| 3.6 Общая и свободная щелочность | 19 |
| 4. Химическая кинетика и химическое равновесие | 20 |
| 5. Окислительно – восстановительные процессы | 21 |
| 6. Угольная кислота и формы ее содержания в воде | 23 |
| 6.1 Стабильность воды | 26 |
| 7. Природные воды | 27 |
| 7.1 Круговорот воды в природе. Мировые водные ресурсы | 27 |
| 7.2 Физико – химические характеристики природных вод | 28 |
| 7.3 Химические ингредиенты природных вод и их значение для оценки качества воды | 29 |
| 7.3.1. Главные ионы | 29 |
| 7.3.2. Растворенные газы | 30 |
| 7.3.3. Биогенные вещества | 30 |
| 7.3.4. Органические вещества | 31 |
| 7.3.5. Микроэлементы | 32 |
| 7.4 Основные показатели качества воды | 32 |
| 7.4.1. Мутность воды | 32 |
| 7.4.2. Цветность воды | 33 |
| 7.4.3. Запах и вкус воды | 33 |
| 7.4.4. Химические компоненты, влияющие на органолептические свойства воды | 33 |
| 7.4.4.1. Общее солесодержание | 33 |
| 7.4.4.2. Общее солесодержание нелетучих минеральных веществ | 33 |
| 7.4.4.3. Водородный показатель рН | 34 |
| 7.4.4.4.Жесткость воды | 34 |
| 7.4.5. Реагенты, применяемые при водоподготовке | 34 |
| 7.4.6. Бактериологические показатели качества воды | 35 |
| 7.5 Требования к воде промышленного водоснабжения | 35 |
| 8. Основы очистки природных и сточных вод | 36 |
| 8.1 Умягчение и обессоливание воды | 36 |
| 8.1.1. Жесткость воды | 36 |
| 8.1.2. Реагентные методы умягчения воды | 37 |
| 8.1.3. Метод ионного обмена и его применение при обработке воды | 39 |
| 8.1.4. Обессоливание воды | 43 |
| 8.1.4.1. Метод ионного обмена | 43 |
| 8.1.4.2. Метод электродиализа | 44 |
| 8.1.4.3. Гиперфильтрация (обратный осмос) | 45 |
| 8.1.4.4. Газгидратный метод опреснения воды | 46 |
| 8.1.4.5. Дистилляционный метод | 47 |
| 8.1.4.6. Опреснение воды вымораживанием | 47 |
| 8.1.4.7. Оценка качества опресненной и обессоленной воды | 47 |
| 8.2 Обеззараживание воды | 47 |
| 8.2.1. Обеззараживание хлором и хлорсодержащими веществами | 47 |
| 8.2.2. Хлорирование с аммонизацией | 49 |
| 8.3 Озонирование воды | 50 |
| 9. Сточные воды и методы их очистки | 51 |
| 9.1 Характеристика бытовых сточных вод | 51 |
| 9.2 Характеристика производственных сточных вод | 52 |
| 9.3 Основные показатели степени загрязненности сточных вод | 53 |
| 9.4 Методы очистки производственных сточных вод | 55 |
| 9.4.1. Физико – химические методы очистки производственных сточных вод | 55 |
| 9.4.2. Химические методы очистки сточных вод | 55 |
| 9.4.2.1. Тяжелые металлы | 55 |
| 9.4.2.2. Удаление из воды соединений железа | 57 |
| 9.4.2.3. Удаление из воды соединений марганца | 58 |
| 9.4.2.4. Фторирование и дефторирование воды | 59 |
| 9.4.2.5. Обескремнивание воды | 60 |
| 9.4.2.6. Удаление из воды растворенных газов | 60 |
| 10. Физико – химические основы удаления взвешенных и коллоидных примесей | 61 |
| 10.1 Поверхностные явления | 61 |
| 10.2 Коллоидные системы | 64 |
| 10.2.1. Классификация золей | 64 |
| 10.2.2. Методы получения коллоидных растворов | 66 |
| 10.2.3. Свойства коллоидных систем | 67 |
| 10.2.4. Строение коллоидной частицы | 68 |
| 10.2.5. Устойчивость и коагуляция коллоидных систем | 70 |
| 10.2.6. Механизм процесса коагуляции | 70 |
| 10.2.7. Обработка воды коагулянтами | 71 |
| 10.2.8.Характеристика коагулянтов | 74 |
| 10.2.9. Характеристика флокулянтов | 74 |
| 10.2.10. Безреагентные методы коагуляции | 76 |
| ТЕСТ: Тема 1 | 77 |
| Тема 2 | 81 |
| Тема 3 | 86 |
| Тема 4 | 90 |
| Тема 5 | 95 |
| ПРИЛОЖЕНИЕ | 112 |
СПИСОК ЛИТЕРАТУРЫ
1. Глинка, Н.Л. Общая химия / Н.Л. Глинка; под ред. А.И. Ермакова. – Изд. 30-е, испр.. – М.: Интеграл –Пресс, 2006. -727 с.: ил.
2. Ивчатов, А.Л. Химия воды и микробиология: учебник для сред. спец. учеб. заведений по специальности «Водоснабжение и водоотведение» /А.Л. Ивчатов, В.И. Малов. – М.: ИНФРА –М, 2006. - 216, [1] c.: ил..- (Среднее профессиональное образование).
3. Питьевая вода. Гигиенические требования к качеству воды централизованных систем питьевого водоснабжения. Контроль качества: Санитарные правила и нормы: СанПиН 2,1,4,559 -96. – М.: Информационно – издательский центр Госкомсанэпиднадзора России, 1996. -111с.
ПРЕДИСЛОВИЕ
В учебном пособии по химии воды затронуты теоретические вопросы курса, которые должны быть использованы при оценке качества природных вод и выборе способов и методов очистки сточных вод и доведения их до соответствующих кондиций. Затронутые вопросы помогут специалистам по водоснабжению и водоотведению оценить рациональность и эффективность методов водоподготовки.
Задачами данного курса являются:
- дать современные представления о физико-химических процессах, протекающих в природных и сточных водах;
- ознакомить с принципами анализа природных и сточных вод и использованием результатов анализа для оценки качества воды и для выбора методов ее очистки;
- изучение современных технологических методов обработки вод различного происхождения и назначения, способов их обеззараживания;
Данное пособие можно рассматривать как часть лекционного курса «Химия воды и микробиология», предусмотренного учебным планом специальности 270112 «Водоснабжение и водоотведение».
В пособие включены также тематические тесты по материалу курса и тесты для итогового контроля знаний студентов.
ВВЕДЕНИЕ
На всех стадиях развития человек был тесно связан с окружающим миром. Но с тех пор как появилось высокоиндустриальное общество, опасное вмешательство человека в природу резко увеличилось. В связи с научно-технической революцией и расширением сферы производства возникает потребность в потреблении больших объемов воды. Новые технологии диктуют жесткие требования к качеству воды, включаемой в технологические циклы. С другой стороны необходимость надежной защиты водоемов от загрязнения сточными водами промышленного происхождения диктует строгие нормы допустимого содержания примесей в этих водах. Разработка и внедрение в практику новых современных методов очистки природных и сточных вод, совершенствование методов контроля за качеством воды различного назначения увеличивает значимость подготовки специалистов по водоснабжению и диктует особые требования к преподаванию дисциплин химического профиля одной из которых является «Химия воды и микробиология».
Особого внимания заслуживает изучение физико-химических способов обработки сточных вод. При проведении в области очистки сточных вод промпредприятий необходимо исходить из предположения, что сброс в водоемы даже очищенных сточных вод допустим лишь в тех случаях, когда применение замкнутого цикла не может быть осуществлено.
Интересным и многообещающим является разработка способов химической обработки производственных стоков с использованием сырья и отходов производства данного предприятия или отходов других производств.
Все процессы водоподготовки, включая выбор источника водопользования, связаны с физико-химическими и микробиологическими исследованиями. Специалисты по водоснабжению, связанные с рациональным использованием водных ресурсов должны в совершенстве знать не только современные методы анализа природных и сточных вод, но и химические процессы, происходящие в природных и сточных водах. Это будет способствовать внедрению новых экономичных способов очистки, повышению эффективности и интенсификации применяемых методов; позволит сократить расход воды на технические нужды и возвратить в производство ценные отходы.
1. ВОДА (окись водорода) Н2О
Распространенность в природе.
Вода широко распространена в природе во всех трех состояниях.
1. В виде паров она обычно содержится в атмосфере даже при температуре ниже 0 0С. Эта атмосферная вода образуется в основном в результате испарения морей под действием солнечного тепла и транспирации растений.
Содержание воды в атмосфере изменяется в широких пределах. Воздух в районах с умеренным климатом содержит в среднем 2/3 паров воды, необходимых для насыщения. При охлаждении воздуха может достигаться его температура насыщения, при которой жидкая фаза отделяется в виде тумана и дождя или конденсируется на поверхности твердых тел (точка росы).
2. Большая часть земного шара покрыта льдом. В полярных районах вода замерзает на поверхности, образуя слой чистого льда, называемого ледяным затором. Плавающие горы (айсберги) отрываются от огромных льдин, находящихся у берегов Ледовитого океана.
3. Вода ни в одной из ее природных форм не бывает чистой, так как она растворяет часть соприкасающихся с ней веществ. Самая чистая вода – это метеорная (дождь, снег), но и она содержит растворенные газы и другие вещества, содержащиеся в атмосфере (О2, N2, CO2, нитрат, нитрит и карбонат аммония, следы перекиси водорода, следы органических веществ, различную пыль). Метеорная вода, попадая на Землю, может пройти через водопроницаемые слои (почву, песок), где образуются подземные озера. Подземная вода снова появляется на поверхности в виде родников или артезианских колодцев, образующих реки и так далее.
Состав такой воды зависит от земных слоев, через которые она проходила и от времени контакта с ними. Наименьшее количество растворенных веществ содержит вода горных источников, а также вода, образующаяся в результате таяния льда (≈50 мг/л).
Подземные воды обычно содержат большее количество веществ (≈2 г/л), а речная вода, помимо органических веществ, содержит во взвешенном состоянии и минеральные вещества.
Родниковая и речная вода всегда содержит растворенные атмосферные газы – кислород, азот и двуокись углерода, а также некоторые катионы (Са3+, Mg2+, Na2+) и анионы угольной (НСО3-), серной и соляной кислот, и в небольших количествах другие.
Самая важная соль - бикарбонат кальция. Вода, содержащая его в больших количествах, жесткая вода, не дает с мылом пену и не размягчает сваренные в ней овощи. Бикарбонат кальция, содержащийся в воде в значительных количествах, при выходе ее на поверхность, разлагается на СО2 и СаСО3 , который осаждается (образование сталактитов). То же происходит при кипячении воды (образование накипи).
Океанская вода имеет почти постоянный состав. Она содержит примерно 35 г солей в 1 л, из них 27 г хлорида натрия. Кроме этого в ней имеются Mg2+, K+, Br -, SO42-, а также незначительные количества йода и цветных металлов.
Концентрация солей во внутренних морях выше (Средиземное море) или ниже (Черное море), чем в океанах. Очень высокие концентрации в морях, не имеющих выхода в океан (Мертвое море).
Минеральные воды. Вода многих родников, проходя через различные слои почвы, растворяет большие количества твердых и газообразных веществ. В некоторых случаях вода родников имеет высокую температуру (термические источники), достигающую 100 0С, поэтому в ней содержаться большие количества солей.
Чистую воду получают из природной, путем перегонки.
Смесь 2 объемов водорода и 1 объема кислорода при соприкосновении с пламенем или пропускании электрической искры дает сильный взрыв с образованием воды:
2Н2 + О2 → 2Н2О.
Физические свойства воды
Чистая вода бесцветна, она не имеет ни запаха, ни вкуса. В более толстом слое вода кажется окрашенной в голубой цвет.
Температура, при которой жидкая и твердая фаза воды находятся в равновесии, то есть температура плавления, при 760 мм рт.ст. принята за 0 термометрической шкалы Цельсия. Температура кипения – 1000 той же шкалы. По отношению к воде даются определения других физических единиц.
Во многих отношениях вода является исключительной жидкостью. Температуры плавления и кипения воды, по сравнению с соответствующими температурами соединений водорода с соседними элементами в периодической таблице, необычайно высокие:
| СН4 | NH3 | H2O | HF | |
| Т пл., 0С | -184 | -78 | 0 | -83 |
| Т кип., 0С | -164 | -33 | +100 | +19,5 |
| SiH4 | PH3 | H2S | HCl | |
| Т пл., 0С | -185 | -133 | -85 | -115 |
| Т кип., 0С | -112 | -87 | -61 | -85 |
Плотность воды по мере повышения температуры не уменьшается постепенно, как у остальных жидкостей, а имеет при 4 0С максимальную величину. Выше этой температуры, что вполне нормально, плотность уменьшается; то же происходит и при охлаждении воды ниже 4 0С.
| Т, 0С | 0 | 4 | 10 | 15 | 20 |
| Р г/см3 | 0,999866 | 1,000 | 0,999727 | 0,999127 | 0,998230 |
При переходе в твердое состояние при 0 0С снова происходит изменение плотности. Плотность льда с температурой 0 0С равна 0,91, следовательно, его объем на 10% больше равного по весу объема воды той же температуры. Этим объясняется растрескивание сосудов, заполненных водой и попавших на мороз. При очень высоких давлениях (20 000 атм.) образуются другие формы льда, их объем меньше, чем объем жидкой воды.
Все эти аномалии физических свойств воды вызваны явлением ассоциации молекул воды.
Аномалии плотности воды имеют большое влияние на климат планеты и на жизнь животных и растений. Когда вода рек, озер и морей охлаждается ниже 4 0С, она становиться легче и не идет ко дну, а остается на поверхности, где и замерзает. Поэтому на большой глубине вода не замерзает и в ней сохраняется жизнь.
Если бы плотность льда была больше плотности воды, то по мере образования лед шёл бы ко дну, и океаны целиком замерзли, поскольку тепла, получаемого от солнца в теплое время, было бы недостаточно для их оттаивания.
Строение молекул воды
Молекула воды имеет форму треугольника (дипольный момент ≠ 0). Угол между прямыми соединяющими ядра водорода с ядром кислорода (валентный угол кислорода) = 105 0С. Расстояние О-Н в жидком и твердом состоянии равно 0,99 А.
Ассоциация молекул воды за счет водородных связей.
О … Н Н
/ \ \ /
Н Н … О
Изотопный состав воды
У водорода 3 изотопа 1Н (≈1); 2Н (D –дейтерий ≈2); 3Н (Т – тритий ≈3). Кислород имеет 3 изотопа с массовыми числами 16, 17, 18. Природная вода является смесью различных молекул. Вода состава Д216О, Д217О, Д218О – тяжелая вода; в состав которой входит Т – сверхтяжелая вода. Сверхтяжелая вода замерзает при 3,8 0С, кипит при 101,4 0С. Максимальная плотность при +11 0С. Растворимость в тяжелой воде ниже чем в обычной. Тяжелая вода оказывает тормозящее действие на жизненные процессы в растительных и живых организмах. Применяется в урановых котлах в качестве замедлителя ядерного распада.
Дата: 2019-02-02, просмотров: 410.