Химическая реакция, протекающая в пределах одной фазы, – гомогенная реакция. Все реакции делятся на обратимые и необратимые. Необратимые реакции протекают в одном направлении до конца. Обратимые реакции протекают при одних и тех же заданных условиях одновременно в двух противоположных направлениях.
А+В ↔ С+Д
Обратимая реакция протекает только до определенного момента, когда Vпр и Vобр становятся одинаковыми, то есть в системе наступает динамическое равновесие.
V1 = k1[A][B]
V2 = k2[C][Д]
V1 = V2 , следовательно k1[A][B] = k2[C][Д], следовательно:
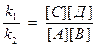 или
или 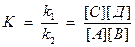
К – константа равновесия.
В общем виде:
аА + вВ ↔сС + dД
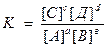
Ле Шателье (1887г): если изменить одно из условий, при котором установилось равновесие (t, p, C), то произойдет смещение равновесия в направлении процесса, препятствующего производимому изменению.
Увеличение температуры вызывает усиление эндотермической реакции.
Увеличение давления смещает равновесие в сторону образования меньшего числа молекул.
Увеличение концентрации веществ, стоящих в одной части равенства, вызывает образование веществ в другой части равенства.
5. ОКИСЛИТЕЛЬНО - ВОССТАНОВИТЕЛЬНЫЕ ПРОЦЕССЫ
Окислительно – восстановительные реакции (ОВР) сопровождаются оттягиванием или перемещением части или всех валентных электронов от одного атома или иона к другому атому или иону.
Окисление – отдача электронов.
Восстановление – принятие электронов.
Атомы, которые присоединяют электроны – окислители; атомы или ионы, которые отдают электроны – восстановители.
Степень окисления – это кажущийся заряд атома, возникающий после отдачи или принятия электронов в ионных соединениях или оттягивания электронных пар от одного атома к другому в молекулах полярных соединений.
Абсолютную величину окислительно – восстановительную потенциала измерить невозможно. Поэтому измеряют относительную величину по отношению к водородному электроду, потенциал которого в реакции 2Н++2ē→Н20 принимают равным нулю.
Зависимость окислительно – восстановительного потенциала от концентрации окисленной и восстановленной формы в растворе описывается формулой Нернста.
 ;
;
или
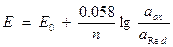
Например, Сl2 + 2Fe2+ = 2Fe3+ + 2Cl-.
Eh вычисляется для каждой из окислительно – восстановительных пар по формулам.
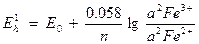
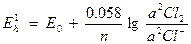 .
.
Эквивалент окислителя (восстановителя) равен количеству окислителя (восстановителя), которое соответствует одному присоединенному (отданному) электрону в данной окислительно – восстановительной реакции.
Окислители и восстановители различаются между собой по активности. Возможность и направленность протекания окислительно – восстановительных процессов определяется количественной характеристикой химической активности окислителя и восстановителя – окислительно – восстановительным потенциалом.
Работа гальванических элементов основана на протекании реакции окисления – восстановления. В медно – цинковом гальваническом элементе.
Zn0 + Cu2+ → Cu0 + Zn2+
Zn-2ē → Zn2+
Cu2+ +2ē → Cu0.
Степень окисления может иметь положительное, нулевое и отрицательное значение. Она вычисляется как алгебраическая сумма полярных связей. Степень окисления атомов в ионных соединениях по величине и знаку соответствует заряду иона, а у атомов неполярных молекул (Н2 и О2 и др.) равна нулю, так как отсутствует одностороннее оттягивание общих электронных пар электронов.
2КМnO4 + 5H2C +22O4 + 3 H2SO4 = 10 +4CO2 + 2MnSO4 + 8 H2O + K2SO4
Пеманганат Щавелевая
калия кислота
Н — О — С
| \
O O
| /
Н — О — С
щавелевая кислота
К типичным окислителям относятся Сl2, F2, O2, КМnО4 и другие, в которых содержаться атомы, имеющие высшую степень окисления.
Восстановители – водород, металлы, сероводород и другие водородные соединения.
Окислительная способность соединений зависит от рН в тех реакциях, где одним компонентом является вода или ионы Н+. Зависимость окислительно – восстановительного потенциала Еh от концентрации ионов Н+ можно рассчитать по формуле Нернста.
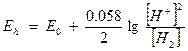 , так как Е0 =0 (для водорода), то
, так как Е0 =0 (для водорода), то
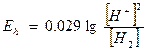 ;
;
-lg [H+] = рН, а отрицательный логарифм давления молекулярного водорода обозначают через rH2. , таким образом
Еh = 0.029 (-2pH + rH2).
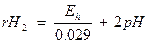
Это уравнение позволяет охарактеризовать окислительно – восстановительные свойства среды:
- чем меньше rH2, тем легче идут процесса восстановления;
- увеличение rH2 способствуют протеканию окислительных процессов.
При равенстве молярных концентраций кислорода и водорода rH2 =28; для водного раствора насыщенного водородом rH2 =0.
Дата: 2019-02-02, просмотров: 358.