Для количественной характеристики кислотности раствора пользуются двумя способами.
1. Для выражения активной кислотности раствора служит концентрация ионов водорода; рН.
2. Для выражения общей кислотности раствора служит нормальность его, равная числу грамм – эквивалентов кислоты в литре раствора.
Рассмотрим в чем различие.
Например: при взаимодействии растворов с индикаторами принимают участие только свободные Н+, имеющиеся в растворе в данных условиях.
Концентрация Н+ и рН раствора характеризуют именно эту величину и выражают активную кислотность раствора.
В других случаях может принимать участие весь содержащийся в кислоте водород. При титровании раствора кислоты щелочью ионы ОН- связывают прежде всего свободные Н+. Но по мере уменьшения [Н+] происходит диссоциация новых молекул кислоты.
Следовательно, в реакцию может вступить весь водород, а не только свободные ионы водорода.
Общая кислотность называется аналитической или титруемой кислотностью.
Активная кислотность представляет собой лишь часть общей кислотности и не может быть больше ее.
Соотношение между активной и общей кислотностью зависит от степени диссоциации кислоты в данном растворе. Чем меньше степень диссоциации, тем меньшую долю общей кислотности составляет активная кислотность.
Если α =1, то активная кислотность равна общей кислотности. Это имеет место в разбавленных растворах сильных кислот. Если же сравнить сильную и слабую кислоту (например, 1N раствор HNO3 и CH3COOH), то общая кислотность в них будет одинакова (1N растворы), а активная кислотность отличается весьма сильно. Для НNО3 [Н+] ≈ 1 моль/л, а для уксусной [Н+] =0,0034 моль/л.
Кислотность воды обуславливается гидролизом солей слабых оснований и сильных кислот, содержащихся в воде.
Общая и свободная щелочность
Под общей (или титруемой) щелочностью воды подразумеваются все ионы гидроксила способные связываться с ионами водорода.
Причиной появления щелочности в природной воде является гидролиз солей образованных слабыми кислотами и сильными основаниями.
А+ + НОН ↔ НА + ОН –
При введении в воду ионов водорода равновесие смещается вправо и гидролиз доходит до конца.
Количество миллиграмм – эквивалентов кислоты, израсходованное на нейтрализацию гидроксильных ионов, содержащихся в одном литре воды, называется ее общей (или титруемой) щелочностью.
Щелочность природных вод зависит в основном от присутствия в ней карбонатов и гидрокарбонатов, а в водах с высокой цветностью от содержания в ней гуматов.
Различают гидратную (свободную) щелочность, обусловленную наличием свободных гидроксилов, гидрокарбонатную (НСО3-), карбонатную (СО32-).
ХИМИЧЕСКАЯ КИНЕТИКА И ХИМИЧЕСКОЕ РАВНОВЕСИЕ
На скорость химической реакции влияет природа реагирующих веществ (энергия активации) и условия, при которых она протекает:
1) концентрация;
2) давление;
3) температура;
4) присутствие катализатора.
Энергия, необходимая для активирования исходных частиц, называется энергией активации. Чем больше эта энергия, тем меньше молекул обладают ею при данной температуре, тем медленнее идет реакция.
Влияние температуры.
При повышении температуры возрастает скорость движения молекул и столкновение между ними происходит чаще. С другой стороны при более высокой температуре молекулы становится более активным, повышается число эффективных столкновений. В соответствии с правилом Вант –Гоффа при увеличении температуры на 10 0С скорость реакции возрастает в 2 -3 раза.
Отношение констант скорости при разных температурах (t и t +100), называется температурным коэффициентом и обозначается через γt.
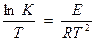 ,
,
где К – константа скорости;
Т- температура в К;
R – универсальная газовая постоянная = 8,31Дж/моль∙К;
Е – энергия активации, Дж.
Влияние концентрации.
Закон действия масс.
А+В = АВ V = К[A][B],
где К - константа скорости, моль/ л∙с;
[A][B] – мольные концентрации, моль/дм3.
В общем виде mA+mB = AmBn
V = K[A]m [B]n
Влияние катализаторов.
Катализаторы - вещества которые изменяют скорость реакции не принимая в ней участия и остаются химически неизмененными и в прежнем количестве.
Каталитические процессы широко распространены в природе.
Вода – универсальный катализатор.
Природные катализаторы – ферменты.
Дата: 2019-02-02, просмотров: 456.